植酸对腐败希瓦氏菌的抑菌机理
2011-10-24侯伟峰蓝蔚青
谢 晶,侯伟峰,汤 毅,蓝蔚青
(上海海洋大学食品学院,上海 201306)
植酸对腐败希瓦氏菌的抑菌机理
谢 晶,侯伟峰,汤 毅,蓝蔚青
(上海海洋大学食品学院,上海 201306)
结合植酸对南美白对虾的保鲜,以虾体优势腐败菌-腐败希瓦氏菌为研究对象,利用植酸溶液处理后,通过对细菌的抑菌效果及最小抑菌浓度、细菌生长曲线、碱性磷酸酶(AKP)等的测定研究其抑菌机理。结果表明,植酸对腐败希瓦氏菌有较强的抑菌效果,最低抑菌浓度(体积分数)为0.2%。同对照组相比,植酸能够影响细菌的生长规律,使细胞破损。细胞壁和细胞膜遭到破坏,AKP及电导率均增大,初步阐述了植酸对腐败希瓦氏菌的抑菌机理。
植酸,腐败希瓦氏菌,抑菌,机理
植酸(Phytic acid),又名肌醇六磷酸,是从植物种籽中提取的一种淡黄褐色粘稠液体,分子式:C6H18O24P6,分子量约为660.08,是一种天然存在的含磷有机酸类化合物。植酸主要以Ca、Mg及K盐等复合形式广泛存在于谷物、豆类等植物种子的果壳和胚芽中[1],具有较强的络合金属离子的特性,是一种抗营养因子,此外,植酸的毒性极低[2],广泛应用于食品、化工和医学等行业,是一种安全、新型的食品添加剂。在前期利用植酸保鲜南美白对虾的实验中发现,在南美白对虾中添加0.08%的植酸溶液,能够有效地预防黑变及由微生物污染而造成的腐败,这与《食品添加剂卫生标准GB2760-86增补品种》[3]中规定植酸适用于水产品对虾保鲜参考用量以0.05%~0.1%的水溶液作为冷冻保鲜液相吻合。目前,植酸在南美白对虾中已得到了初步的应用[4],但关于其作用机理还没有得到很好的阐述。本文结合植酸在南美白对虾的保鲜作用,选取南美白对虾中优势腐败菌—腐败希瓦氏菌[5-6](Shewanella putrefacens)作为实验对象,来探讨植酸的保鲜机理。
1 材料与方法
1.1 材料与设备
腐败希瓦氏菌(Shewanella putrefacens) 上海海洋大学微生物实验室保存;胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、平板计数琼脂 北京陆桥技术有限责任公司;植酸 浙江桐乡鑫洋食品添加剂有限公司,50%高纯度植酸液体,食品级;2.5%戊二醛水溶液 上海凌峰化学试剂有限公司,分析纯;碱性磷酸酶(AKP)试剂盒 南京建成科技有限公司;无水乙醇、醋酸乙戊酯、PBS磷酸缓冲液 国药集团化学试剂有限公司,均为分析纯。
日立E-1010离子溅射仪、HCP-2临界点干燥仪、S-3400N扫描电子显微镜 日本Hitach公司;SG3电导率仪 梅特勒-托利多仪器(上海)有限公司;UV-3000 PC型紫外可见分光光度计 上海美谱达仪器有限公司;TH2-82(A)气浴恒温振荡器 江苏金坛市科稀仪器有限公司;stat fax-3200酶标仪 美国awareness公司;Z36HK大容量高速冷冻离心机 德国哈默(Herm Le)公司;洁净工作台 苏净集团苏州安泰空气技术有限公司;YXQ-LS-30SH全自动立式压力蒸汽灭菌器上海博迅实业有限公司医疗设备厂;电热鼓风干燥箱 上海一恒科学仪器有限公司;XW-80A旋涡混合器 上海青浦沪西仪器厂;DHP-9162型电热恒温培养箱 上海一恒科技有限公司;牛津杯(外径7.82±0.1mm),游标卡尺,一次性无菌针筒,0.22μm水系微孔滤膜等。
1.2 实验方法
1.2.1 菌种的活化及植酸溶液的配制 菌种活化方法参照李诚[7]等对聚赖氨酸的研究,将活化后的菌种转接到液体培养基TSB中,摇床内培养17h后用灭菌的TSB进行梯度稀释,使菌落总数为106~107cfu/m L,作为菌悬液待用。摇床培养条件均为37℃、150r/m in。
将植酸溶液配制成体积分数为2%的水溶液作为母液,用0.22μm的微孔滤膜进行物理灭菌[8]后,用无菌水进行稀释,使其体积分数分别为:1%、0.8%、0.4%、0.2%、0.1%、0.05%,以无菌水代替植酸溶液作为对照组(CK)。
1.2.2 植酸对腐败希瓦氏菌的抑菌效果实验及最低抑菌浓度(M IC)的测定 取0.1m L制备好的菌悬液进行涂布,制成含菌平板。参考倪清艳[9]等的方法,利用牛津杯方法进行植酸抑菌效果的实验。
取植酸溶液0.5m L与同体积106cfu/m L的菌液混合,使其最终浓度分别为2%、1%、0.8%、0.4%、0.2%、0.1%、0.05%,摇床培养16h后,倒入平板中进行培养,通过观察,以不生长细菌的最小浓度作为最低抑菌浓度,平行两次,以无菌水代替植酸作为对照组。
1.2.3 植酸对腐败希瓦氏菌生长曲线的影响 取106cfu/m L菌悬液5m L与用TSB稀释的植酸溶液等体积混合,使其最终浓度为1倍MIC、1/2MIC浓度,摇床培养,分别取样,利用分光光度计,调整波长为630nm处进行菌液OD值的测定[10],实验平行3次,结果取其平均值。
1.2.4 植酸对腐败希瓦氏菌菌体细胞壁的影响 取106cfu/m L菌悬液5m L与配制好的植酸溶液等体积混合,使其最终浓度为1倍M IC、1/2M IC浓度,摇床培养后,按照刘蔚[11]等的方法并稍作改进,测定菌液AKP的含量,从而间接反映细菌细胞壁的变化情况,实验平行3次,结果以平均值表示。
1.2.5 植酸对腐败希瓦氏菌菌体细胞膜通透性的影响 将菌悬液浓度调至108cfu/m L,取该菌悬液5m L与配制好的植酸溶液等体积混合,使其最终浓度为1倍M IC、1/2M IC浓度,摇床培养后,按照Lee[12]的方法测定培养液的电导率值,同时做对照组。
1.2.6 植酸对腐败希瓦氏菌菌体超微结构的影响 植酸对细菌细胞超微结构的影响通过扫描电镜进行观察。具体操作方法为:取生长至对数期的腐败希瓦氏菌菌液与等体积植酸溶液混合,使其最终浓度为1倍M IC浓度,摇床培养10h后,取此菌液1.5m L,6500r/m in离心4m in,PBS清洗菌体后,用2.5%戊二醛固定,于4℃条件下过夜。过夜后取出溶液,于6500r/min离心后,PBS清洗两次,再用1%锇酸固定6h,经PBS清洗2~3次后,分别用30%、50%、70%乙醇梯度脱水,过夜后经90%、100%、100%乙醇脱水,即用乙酸异戊酯或丙酮处理2次,每次约20m in,将处理好的样品在CO2临界条件下干燥4~6h,上铜台,喷金,于扫描电镜下观察形态结构变化[13-15],同时做对照组,操作方法相同。
1.3 数据分析
利用SPSS17.0软件进行实验数据分析,结果以平均值±平均偏差表示,利用t-检验进行组间分析,当P<0.01时为极显著差异,0.01<P<0.05时为显著性差异,P>0.05时为不显著差异,并采用Excel进行绘图。
2 结果与分析
2.1 植酸对腐败希瓦氏菌抑菌效果及最低抑菌浓度(MIC)
抑菌效果可以通过抑菌圈的方法进行判定,一般来说,抑菌物质浓度越高,抑菌圈直径就越大。腐败希瓦氏菌经不同浓度植酸溶液处理后,由表1可知,当植酸浓度较低时,同对照组相比,基本上没有抑菌圈,但随着植酸浓度的增高,抑菌效果变得明显,其抑菌圈直径逐渐变大,这说明植酸对希瓦氏菌具有明显的抑菌作用,并且随着浓度的增大,抑菌效果逐渐增强。
最低抑菌浓度(minimum inhibitory concentration,MIC)是测量抗菌药物抗菌活性大小的指标,对于保鲜剂保鲜机理的研究及保鲜剂在食品中的应用具有重要的意义。通过最低抑菌浓度实验可知,当植酸浓度为0.2%时已没细菌生长,因此可以确定其最低抑菌浓度为0.2%。
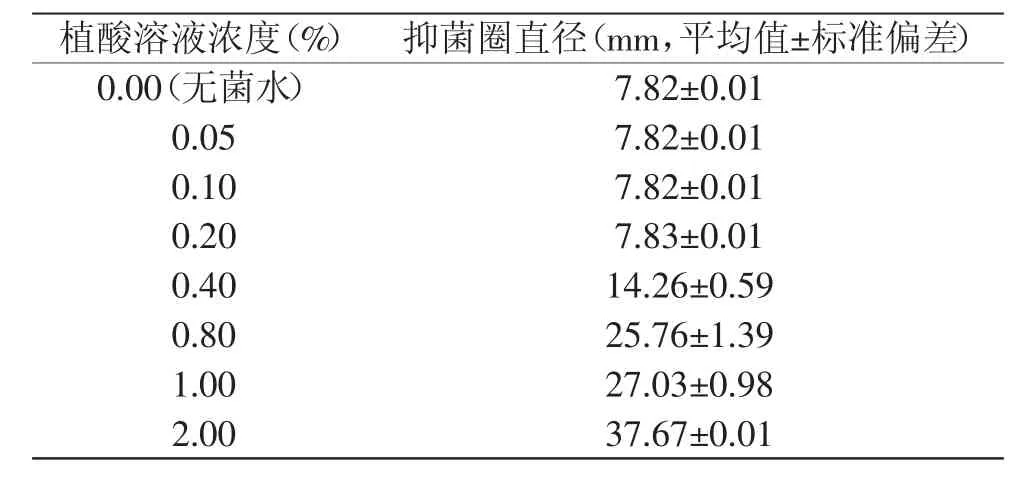
表1 植酸对腐败希瓦氏菌的抑菌效果
2.2 植酸对腐败希瓦氏菌生长曲线的影响结果
菌液的光密度值可以用来衡量细菌的生长情况,一般来说,在液体培养基中,细菌呈现S型生长规律。如图1所示,细菌的对照组具有典型的细菌生长规律。当在菌液中添加1倍M IC(0.2%)和1/2M IC浓度(0.1%)的植酸时,细菌的生长曲线具有不同程度的变化,没有典型的生长规律,菌液在630nm的OD值明显低于对照组(P<0.05),尤其是在菌液中添加较高浓度的植酸时,细菌菌液的OD值始终处于一个较低的平稳状态。但在1/2MIC浓度下,细菌菌液OD值尽管有所上升,但上升趋势处于不规则的状态,并始终低于对照组。这说明较高浓度的植酸能够将细菌完全抑制或杀灭,从而导致生长曲线始终处于较低的平稳状态。而低浓度的植酸能够有效抑制部分细菌活性,使细菌生长呈现不规则的趋势,并且由于植酸的抑制作用,从而导致其OD值始终低于对照组。

图1 植酸处理后腐败希瓦氏菌的抑菌曲线变化
2.3 植酸对腐败希瓦氏菌菌体细胞壁的影响结果
细菌细胞壁位于细胞最外层,能够有效地保持菌体形状及抗渗透压能力。碱性磷酸酶(AKP)是存在于细胞壁与细胞膜之间的一种酶,当细胞壁处于完整状态时,AKP不能透过细胞壁,因此正常情况下在胞外不能检出。但当细胞壁遭到破坏后,细菌不能保持良好的形状和抗渗透压能力,AKP大量渗透到胞外,因此通过测定AKP的变化情况可以间接反映植酸对细菌细胞壁的影响[16]。
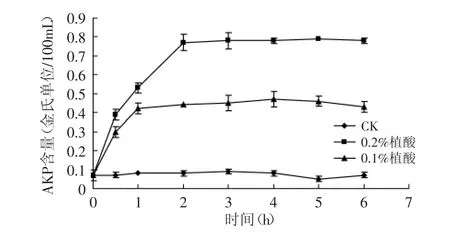
图2 植酸对腐败希瓦氏菌细胞壁的影响
植酸对腐败希瓦氏菌细胞壁的影响情况如图2所示,由图2可知,对照组AKP含量基本上始终处于一个较低的平稳状态,在胞外很难检测出其含量,但经不同浓度植酸处理的菌液,在最初的2h内AKP含量迅速上升至较高的含量,以后基本上处于平稳趋势,并且植酸溶液浓度越高,AKP含量越高。这说明植酸溶液能够破坏细菌细胞壁的完整性,浓度越高,破坏程度越大,并且在较短的时间内能够造成菌体细胞壁通透性的增加。
2.4 植酸对腐败希瓦氏菌细胞膜通透性的影响结果
细菌细胞膜是细菌的保护屏障,具有流动性和半透性等功能,但当细菌细胞膜遭到破坏后,细胞膜所固有的功能将会丧失,导致细菌细胞膜的流动性降低和通透性增大,从而对菌体的保护作用被打破,细胞内部电解质大量外泄至液体培养基中,导致培养液的电导率上升,因此,细菌细胞膜通透性的变化可由菌液电导率的变化情况来反映[17]。
腐败希瓦氏菌经植酸处理后其菌液电导率的变化情况如图3所示。由图3可知,对照组菌液的电导率呈现稳定的上升趋势,这可能与菌液细菌菌体浓度的增大有一定的关系。但当在菌液中添加1倍M IC浓度的植酸时,菌液的电导率值明显高于对照组(P<0.05),这说明高浓度的植酸对细菌细胞膜的影响作用较大,导致细胞膜遭到严重破坏,通透性增大,原生质及电解质外渗严重,从而起到抑菌作用。而在菌液中添加1/2M IC浓度的植酸时,菌液的电导率反而明显低于对照组(P<0.01),其原因可能是由于植酸浓度较低,对细菌细胞膜作用较小,反而由于静电作用,使菌液中其他的金属离子与细胞膜结合[18],同时由于植酸具有较强的金属离子螯合作用[19],从而导致菌液电导率的降低。

图3 植酸处理后腐败希瓦氏菌菌液电导率的变化
2.5 植酸对腐败希瓦氏菌超微结构的影响结果

图4 未经植酸处理腐败希瓦氏菌的扫描电镜图(37℃培养10h,15000×,30000×)

图5 植酸处理后腐败希瓦氏菌的扫描电镜图(37℃培养10h,15000×,30000×)
经植酸处理腐败希瓦氏菌,通过扫描电镜对其微观形态进行观察,结果如图4、图5所示。由图4可知,未经植酸处理的腐败希瓦氏菌,形态比较完整,呈现狭长状,表面比较光滑,颜色鲜亮,折光性好,没有出现细胞破损和内容物溢出现象,菌体生长良好,没有聚集现象。而经过植酸处理后的希瓦氏菌,如图5所示,菌体开始皱缩、无饱满感,部分细胞出现了断裂和破损现象,菌体表面粗糙,同时,细胞原生质的外泄明显,细菌细胞由于原生质的粘稠性而导致细胞聚集在一起,产生严重的重叠现象。由此表明,植酸对细菌的细胞具有破坏损伤作用,能够通过细胞壁和细胞膜的破坏,造成细胞内原生质和电解质的外渗,这与菌液吸光度、AKP及电导率的变化具有一致性。
3 结论
通过植酸处理腐败希瓦氏菌实验,结果表明:植酸对腐败希瓦氏菌具有较强的抑制和杀灭作用,且随着植酸浓度的增大,抑菌作用逐渐增强;植酸对腐败希瓦氏菌的最低抑菌浓度为0.2%;在腐败希瓦氏菌菌液中添加1倍M IC浓度的植酸,对生长曲线、碱性磷酸酶和菌液电导率的影响较大,细菌细胞壁和细胞膜的完整性遭到破坏,渗透性增加,从而菌体细胞质外渗,导致碱性磷酸酶含量和电导率较大;当植酸浓度为1/2MIC时,植酸没有造成细菌的破裂,细菌未被完全抑制,反而由于静电作用和植酸金属离子螯合作用,造成菌液电导率偏小;通过对扫描电镜实验,直观地表明了植酸对细菌形态变化的影响,不仅使细菌表面开始皱缩,变得粗糙,同时还使细菌因原生质和电解质的外渗发生聚集现象,细菌正常的生理代谢受到影响。为深入研究植酸的保鲜机理,期望下一步能开展对其抑菌谱的研究,选取不同类型的微生物,如细菌、霉菌、酵母等,进一步探明植酸的抑菌保鲜机理。
[1]Beom Jun Lee,Deloy G Hendricks.Phytic acid protective effect against beef round muscle lipid peroxidation[J].Journal of Food Science,1995,2:241-244.
[2]吴谋成,袁俊华.植酸的毒理学评价和食用安全性[J].食品科学,1997,18(2):46-49.
[3]GB2760-1986.食品添加剂卫生标准-增补品种[S].
[4]曹荣,薛长湖,徐丽敏.复合保鲜剂在对虾保鲜及防黑变中的应用[J].农业工程学报,2009,25(8):294-298.
[5]赵海鹏,谢晶,严文蓉.南美白对虾冷藏过程中的细菌分离、初步鉴定及菌相分析[J].江苏农业学报,2011,27(1):164-168.
[6]郭红,董士远,刘尊英,等.南美白对虾冰温下菌相变化[J].中国海洋大学学报,2010,40(6):77-80.
[7]李诚,石磊.ε-聚赖氨酸抑菌性能研究[J].食品与发酵工业,2009,35(2):39-43.
[8]马绪荣,苏德模.药品微生物学检验手册[M].2版.北京:科学出版社,2001:350-351.
[9]倪清艳,李燕,张海涛.ε-聚赖氨酸的抑菌作用及在保鲜中的应用[J].食品科学,2008,29(9):102-105.
[10]郝刚.BuforinⅡ抗菌肽的分子设计及对DNA作用抑菌机理研究[D].江南大学博士学位论文,2009.
[11]刘蔚,周涛.ε-聚赖氨酸抑菌机理研究[J].食品科学,2009,30(9):15-20.
[12]Lee H J,ChoiG J,Cho K Y.Correlation of lipid peroxidation in Botrytis cinerea caused by dicarboximide fungicides with their fungicidal activity[J].Journal of Agricultural Food Chemistry,1998,46:737-741.
[13]凌诒萍,俞彰.细胞超微结构与电镜技术——分子细胞生物学基础[M].2版.上海:复旦大学出版社,2004.
[14]曾庆梅,谢慧明,潘见,等.超高压处理对枯草芽孢杆菌超微结构的影响[J].高压物理学报,2006,20(1):83-87.
[15]戴鼎震,赵永前,侯继波,等.鸡源大肠杆菌1型菌毛菌株粘附鸡呼吸道上皮的电镜观察[J].江苏农业学报,2002,18(2):103-105.
[16]Haras,Yam akaw am.A novel type of antibacterial peptide isolated from the silkworm,Bombyx mori[J].J Biol Chem,1995,270:29923-29927.
[17]李明春,等译.微生物生物学 [M].11版.北京:科学出版社,2009:95-113.
[18]钱丽红,陶妍,谢晶.茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J].微生物学通报,2010,37(11):1628-1633.
[19]Katherine L,Empson Theodore P,Labuza.Phytic acid as a food antioxidant[J].Journal of Food Science,1991(2):560-563.
Antimicrobial mechanism s of phytic acid against Shewanella putrefacens
XIE Jing,HOU Wei-feng,TANG Yi,LAN Wei-qing
(College of Food Science and Technology,Shanghai Ocean University,Shanghai201306,China)
Combined with phytic acid on the preservation of Penaeus Vanmamei,advantage corruption bacteria of Penaeus Vanmamei-Shewanella putrefacens was selected as the sample to investigate the antimicrobial mechanisms of phytic acid by inhibition effects,minimum inhibitory concentration(MIC),bacterial curve,alkaline phosphatase(AKP)and so on.Results showed that phytic acid had a strong inhibition function against the bacteria,the MIC(volume fraction)of Shewanella putrefacens was 0.2%.Com pared with the controlled,phytic acid can change bacterial curve,destroyed the cells.Cellmembrane and wall were destroyed,then,AKP and electric conductivity were increased.The antimicrobial mechanisms of phytic acid against Shewanella putrefacens were proposed.
phytic acid;Shewanella putrefacens;antim icrobial;mechanisms
TS201.2
A
1002-0306(2011)10-0085-04
2011-08-05
谢晶(1968-),女,教授,博士,研究方向:食品冷链技术与装备,食品保鲜。
“十二五”国家支撑计划项目(2011BAD24B02);上海市教育委员会重点学科建设项目(J50704)。
