抑菌型纳豆菌株的分离筛选及其微生态菌剂的制备
2011-10-24刘变芳乔冬玲
刘变芳,石 磊,乔冬玲,雒 丹
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
抑菌型纳豆菌株的分离筛选及其微生态菌剂的制备
刘变芳,石 磊,乔冬玲,雒 丹
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
纳豆杆菌具有抗菌、溶血栓、产生各种胞外酶等优良特征,着重关注了其抗菌活性,期望能够为饲料添加抗菌型微生态制剂的研究提供理论依据。实验从市售不同品种豆豉和纳豆中,分离纯化纳豆菌株23株,并通过对纳豆菌个体特征显微观察、水解酪蛋白实验、VP实验、吲哚实验等生理生化实验进行鉴定。研究了不同纳豆菌株对4种致病菌,志贺氏菌、金黄色葡萄球菌、沙门氏菌、大肠杆菌的抗性特征,选育出7株抗致病菌性能良好的纳豆菌。选育的菌株进行组合发酵,采用冷冻干燥技术制备复合纳豆菌微生态制剂。实验结果显示,选育的纳豆菌株抑菌效果明显,冷冻干燥的微生态制剂中活菌数为1.05×109cfu/g,益生菌的存活率为72.7%。
纳豆菌株,分离选育,抗致病菌,微生态制剂
纳豆中含有多种营养因子,使其具有多种功能,如溶血栓、抗肿瘤、降血压、抗氧化性、防止骨质疏松、促凝血等[1]。纳豆芽孢杆菌为革兰氏阳性菌,具有鞭毛,可形成芽孢,是枯草芽孢杆菌属。纳豆芽孢杆菌能增强以厌氧菌为优势菌群的肠道正常菌群的生长能力,消耗肠道中的氧,从而抑制有害需氧菌的生长;还能产生多种营养物质,如维生素、氨基酸、促生长因子等,参与机体的生长代谢。纳豆菌分泌的各种胞外酶,包括蛋白酶、淀粉酶、谷氨酸转肽酶、脂肪酶和植酸酶等,比其他枯草芽孢杆菌分泌同样活性的酶高几十倍,促进动物对营养物质的吸收,增强机体的免疫功能。纳豆菌不仅能发酵大豆,生产出营养丰富、功能多样的纳豆产品,还能用于生产保健药品、调味品以及微生态制剂,是美国FDA公布的40种益生菌之一[2]。微生态制剂是用益生菌(Probiotics)经培养而制成的活菌制剂,产品无污染、无毒副作用,在使用时多制成该菌休眠状态的活菌制剂[3]。纳豆菌能在条件不利的情况下形成芽孢,将自己保护起来,复活率高。由于纳豆菌具有芽孢,因而能耐盐耐碱、耐高温及耐挤压,在制粒过程及通过酸性胃环境中均能保持高度的稳定性,因此是生产微生态制剂的理想菌株[4]。纳豆菌可以产生的抗菌素如杆菌肽、多黏菌素、2,6-吡啶二羧酸,具有抑制金黄色葡萄球菌、沙门氏菌、伤寒菌、痢疾菌及O-157∶H7大肠杆菌等致病菌的作用,可以起到抗菌素的作用[5]。本研究关注纳豆菌的抗菌功能,分离筛选了抑菌型纳豆菌株,并将其制备为微生态制剂。
1 材料与方法
1.1 材料与仪器
纳豆 旭松食品株式会社,购自西安;豆豉1,豆豉2,豆豉3 分别购自杨凌本地菜市场、好又多超市、人人家超市;枯草芽孢杆菌、沙门氏菌、志贺氏菌、金黄色葡萄球菌(ATCC25923)、大肠杆菌(ATCC25922) 均由西北农林科技大学食品学院微生物实验室提供;基本培养基 蛋白胨1%、牛肉膏0.5%、NaCl 0.5%;酪蛋白培养基 脱脂乳粉5%、NaCl 0.5%、葡萄糖1%;大豆氮源基本培养基 大豆蛋白胨1%、牛肉膏0.5%、NaCl 0.5%;发酵液[1]蔗糖2.5%、大豆蛋白胨0.72%、豆粕6.3%、Na2HPO40.45%、NaH2PO40.4%、MgSO40.05%、CaCl20.01%、pH7.0。
SPX-150智慧生化培养箱 上海悦丰仪器仪表有限公司;CH2-82A恒温振荡器 国华企业;Eclipse E100双目生物显微镜 Nikon;MCFD5508 TY8276冷冻冻干机 美国SIM;S-450D超声波细胞破碎仪
美国BRANSON;超净无菌工作台 哈尔滨市东联电子技术开发有限公司。
1.2 实验方法
1.2.1 纳豆菌株分离纯化 分别取纳豆以及豆豉1、豆豉2、豆豉3样品10g,加入已灭菌的100mL生理盐水中,浸泡、振摇30min后,使得豆子的表面物质在水中分散均匀,用移液枪分别将每种悬浮液取100μL,涂布接种在基本培养基上,倒置36℃培养16h。观察并转接单菌落。
1.2.2 纳豆菌的鉴定
1.2.2.1 个体形态镜检与革兰氏染色 依据《伯杰氏细菌鉴定手册》[6]中枯草芽孢杆菌的菌落特征:菌落为圆形,菌落直径约2mm,边缘不规则,呈现叶状,乳白色,色暗无光泽,不透明,有拉丝。镜检观察纳豆菌个体形态,并进行革兰氏染色。挑取革兰氏染色阳性,短杆状,具芽孢,芽孢中生,呈椭圆或柱状,不明显膨大的菌株保存备用。
1.2.2.2 生理生化鉴定 依据伯杰手册(第八版)和《常用细菌系统鉴定手册》上芽孢杆菌的鉴定方法对经过酪蛋白平板实验筛选的菌株进行生理生化特征鉴定实验,进行耐盐能力实验、过氧化氢酶实验、VP实验、水解淀粉实验、吲哚实验、水解明胶实验、发酵葡萄糖产酸实验[6]。
酪蛋白水解实验:挑取菌株在酪蛋白培养基上划线培养16~18h,之后观察,挑选出有明显透明亮带的菌株保存。
耐盐能力实验:用NaCl作盐浓度梯度测试纳豆菌株的生长状况。
过氧化氢酶实验:将菌株涂布接种在平板上,30℃上培养24h,在菌落上面滴3%H2O2,观察是否有气泡产生,有气泡产生的为过氧化氢酶阳性。
VP实验:将菌株接种在液体培养液中,37℃,24h后加等量的40%的NaOH,再加少许肌酸,猛烈振荡,放置在37℃下保持10~30min观察,产生红色的菌株为VP实验阳性。
水解淀粉实验:将菌株在淀粉培养基平板上点接种,30℃培养2~3d,形成明显菌落后,在菌落上滴加碘液,平板背景呈蓝黑色,菌落四周均不变色,有明显透明圈,证明该菌分泌淀粉酶。
水解明胶实验:在明胶试管中穿刺接种,培养2~3d,在20℃下观察菌的生长状况及明胶液化情况。
发酵葡萄糖产酸实验:将斜面上挑取培养物作穿刺接种两支HL培养基,其中一支于接种后滴加溶化的1%琼脂液于表面,高度约1cm,于36℃培养48h。两支培养基均无变化为产碱型或不分解糖型;两支培养基均产酸(黄色)为发酵型;若仅不加石蜡的培养基产酸为氧化型。
吲哚实验:将菌接种至蛋白胨水培养基中,37℃培养48h,在培养液中加入乙醚1~2mL,静置片刻后乙醚层浮于培养液的上面,此时沿管壁缓慢加入5~10滴吲哚试剂,如有吲哚存在,乙醚层呈现玫瑰红色,为吲哚实验阳性反应,反之为阴性反应。
1.2.3 纳豆菌株的抑菌测定
1.2.3.1 单菌株纳豆菌抑菌实验 将纳豆菌接种于液态的基本培养基,志贺氏菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌接种于液态的LB培养基,36℃,120r/min摇床培养16~18h,作为备用菌悬液。将1mL纳豆菌悬液置于1.5mL的离心管中,4000r/min离心10min,取上清液备用。
牛津杯双层平板抑菌实验,先在培养皿上倒少量LB培养基,待凝固后,放置牛津杯并倒上第二层含指示菌的培养基,凝固后取出牛津杯,在小孔内加入100μL纳豆菌上清液,36℃培养16~18h,观察抑菌圈大小。每株纳豆菌重复3孔。
1.2.3.2 优化组合的抑菌实验 依据单菌株抑菌效果,筛选7株抑菌效果明显的纳豆菌株,进行优化组合发酵。检测优化组合对致病菌的抑制效果。双层平板抑菌实验方法同1.2.3.1。将实验室保存的枯草芽孢杆菌和购买的旭松食品株式会社纳豆作为对照进行同样发酵处理。
1.2.4 发酵氮源对纳豆菌抑菌效果的影响 采用大豆氮源培养基和基本培养基分别培养筛选的抗菌纳豆菌株,双层平板法检测不同氮源对抑菌效果的影响[7-8]。
1.2.5 超声波协同离心法处理纳豆菌发酵液对抑菌效果的影响 将筛选的抗菌纳豆菌株发酵液分别用离心和超声波处理,检测其对致病菌抑制效果的影响。菌悬液的制备和双层平板抑菌实验同上。
纳豆菌悬液3mL置于离心管中,用超声波细胞破碎仪处理,超声频率为24kHz,功率为200W,超声处理时间5min,在冰浴中进行超声波细胞破碎,然后用4000r/min,离心10min,吸取上清液备用[9]。
1.2.6 混合微生态菌剂的制作 筛选的7株抗菌效果明显的菌株分别为H1、H5、H8、H9、C5、C8、R6,作为复合微生态菌剂的菌株。将复合纳豆菌接种发酵培养液中36℃,120r/min摇床发酵48h。发酵液中加入20%(W/V)脱脂奶粉,在-20℃条件下预冻12h后,移至真空冷冻干燥机,-72℃下进行冻干燥制备成固体菌剂[9-11]。采用稀释平板法分别测定发酵液和固体菌剂的活菌数。
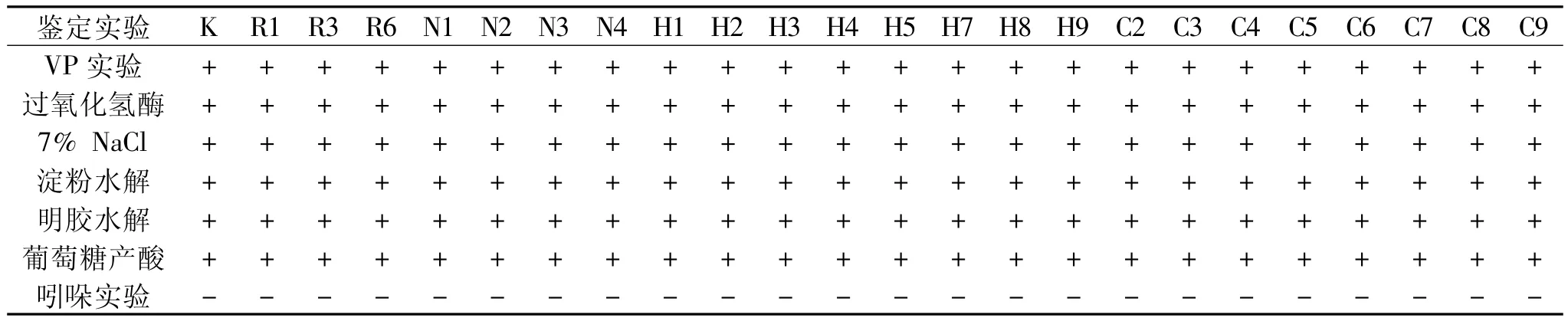
表1 纳豆菌生理生化特征鉴定
存活率(%)=N后/N前×100%
注:N后为干燥前总菌数(发酵液体积(mL)× cfu/mL发酵液),N前为干燥后总菌数(菌粉(g)× cfu/g菌粉)。
2 结果与分析
2.1 纳豆菌菌株的水解酪蛋白实验
由图1可见,纳豆菌可以水解酪蛋白,同时分解酪蛋白的酶类属于胞外酶。对水解透明圈明显的菌株做标记[12],初步筛选到23株纳豆菌分别为R1、R3、R6、N1~N4、H1~H5、H7~H9、C2~C9。

图1 纳豆菌的水解酪蛋白平板
2.2 生理生化实验结果
由表1可知,筛选出的23株菌在耐受7%氯化钠、VP反应、过氧化氢酶作用等生化鉴定中与枯草芽孢杆菌相同,吲哚实验为阴性反应,其余均呈阳性反应。
2.3 单株纳豆菌的抑菌结果
由图2可见,不同纳豆菌株对致病菌株的抑制效果存在明显区别。对大肠杆菌抑制效果强的纳豆菌株有H5、H1、H 9;对沙门氏菌的抑制效果强的纳豆菌株有H5、H1、H 8;对金黄色葡萄球菌的抑制效果强的纳豆菌有H1、R6、H 5;对志贺氏菌的抑制效果强的纳豆菌株有H5、C5、C8。
2.4 复合纳豆菌剂的抑菌结果
由图3可知,复合纳豆菌剂对大肠杆菌、沙门氏菌和金黄色葡萄球菌的抑菌效果明显优于原料纳豆和单株芽孢杆菌。复合纳豆菌剂和原料纳豆发酵液
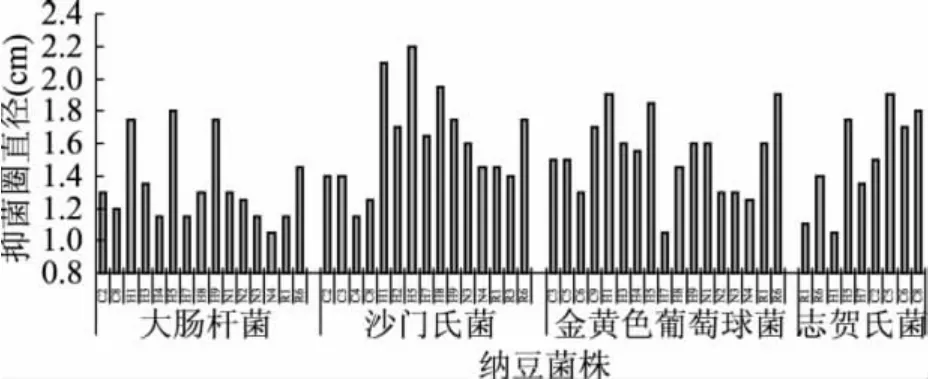
图2 单株纳豆菌抑菌结果

图3 复合纳豆菌剂抑菌结果
2.5 大豆氮源和超声波协同离心处理发酵液对抑菌效果的影响
由图4可知,超声波协同离心方法处理纳豆菌发酵液可以显著提高其抑菌效果。用大豆氮源代替基本培养基中的蛋白胨氮源可以使发酵液抑菌效果增强,但差别不显著。

图4 大豆氮源和超声波协同离心处理发酵液对抑菌效果的影响
2.6 纳豆菌微生态制剂
100mL发酵液冷冻干燥后获得的制剂粉末为11.7g。通过稀释平板计数法得发酵液活菌数为8.93 ×107cfu/mL,干燥后复合菌剂活菌数为 1.05× 109cfu/g。冷冻干燥后微生态制剂的益生菌存活率为72.7%。
3 小结
实验从32株原始纳豆菌株中筛选出23株对沙门氏菌、志贺氏菌、金黄色葡萄球菌、大肠杆菌有明显抑制作用的纳豆菌株。实验针对4种致病菌确定了复合纳豆菌剂组合为H1、H5、H8、H9、R6、C5、C8。采用真空冷冻干燥技术制备了纳豆菌的微生态制剂,复合纳豆菌剂中活菌数达1.05×109cfu/g。冷冻干燥过程中采用20%的脱脂乳作为保护剂,纳豆菌存活率为 72.7%,与王发祥等[13]报导的存活率86.8%相比偏低,因此本研究有待于对真空冷冻干燥工艺的参数和保护剂配方做进一步深入探讨。
[1]杨薇.纳豆及其保健功能[J].吉林农业,2011(2):27.
[2]欧阳涟,李曼,徐尔尼,等.纳豆食品的研制[J].大豆科学,2007,26(1):115-117.
[3]张进荣,李飞,田军德,等.微生态制剂促生长机理及其在畜牧生产上的应用[J].畜牧兽医杂志,2009,28(6):21-23.
[4]郑蕾.纳豆菌微生态制剂的研究现状[J].芜湖职业技术学院学报,2006,8(4):71-72.
[5]孔繁东,鲁玉.蚕蛹纳豆菌发酵物抗菌性研究[J].食品工业科技,2010,31(11):213-215.
[6]布瑞德.伯杰细菌鉴定手册[M].第八版.科学出版社,1984.
[7]孙森,宋俊梅,张长山.豆豉、纳豆及天培的研究进展[J].中国调味品,2008(3):29-33.
[8]王发祥,钟青萍,钟士清.纳豆菌液体发酵条件的优化[J].微生物学杂志,2004,24(3):64.
[9]钟青萍,余世望,梁胜媛.纳豆菌的抗菌作用及其培养基的优化[J].食品工业科技,2001,22(5):20-22.
[10]曹峰,董贝磊,陆晓滨,等.保护剂及冷休克处理对纳豆菌冻干后存活率的影响[J].食品工业科技,2008,29(2): 123-125.
[11]Jeffery R B,Chan L.Effect of heat shock or cold shock t reatment on the resistance of lactococcus lact is to freezing and lyophilization[J].Cryobiology,1999,39:87-123.
[12]Shih I L,Van Y T,Yeh L C,et al.Production of a biopoltmer flocculantfrom Bacillus licheniformis and its flocculation properties[J].Bioresource Technology,2001,78:267-272.
[13]王发祥,王青云,钟青萍,等.纳豆菌微生态制剂加工中两种干燥方法的比较[J].食品科学,2006,27(11):294-296.
Screening of the Natto strains and preparation of the Natto microecological agent
LIU Bian-fang,SHI Lei,QIAO Dong-ling,LUO Dan
(College of Food Science and Engineering,Northwest Agriculture and Forestry University,Yangling 712100,China)
The bacillus natto as the beneficial and safety strains to human body,are aerobic gram-positive bacterium.It belongs to Bacillus subtilis.The original materials were different brand glycine maxes and natto which brought from market.23 bacillus natto strains were separated and purified from the material,according to the particular of bacterial colony.At the same time,these strains were identified as bacillus subtilis by its main physiological and biochemical properties,for example,casein hydrolysate experiment,VP experiment and so on.By the experiment on resistance characteristic to the different strains,including Shigellae,Staphylococcus aureus,Salmonella,Escherichia coli,selected out 7 strains anti-pathogenic bacillus natto with good performance.Put different strains with the excellent properties together for the mixed fermentation and tested different bacillus natto strains combinations on antibacterial properties.Finally,made the best bacillus natto strains combination into the natto microecological agent by vacuum freeze drying method.The experiment results showed that the natto strain elected had obvious antibacterial effect.The viable count of the microecological agent was 1.05×109cfu/g and the bacillus natto survival rate was 72.7%.
bacillus natto;screening breeding;resistance pathogenic bacteria;microecological agent
TS201.3
A
1002-0306(2011)12-0210-04
2011-07-14
刘变芳(1975-),女,博士,讲师,主要从事食品微生物学及分子生物学研究。
西北农林科技大学青年启动基金(08080230)。
