温度对低温选育复合菌系产甲烷活性的影响
2011-10-22东北农业大学资源与环境学院郭建全徐凤花李金赵忠宝杜俊杰
东北农业大学资源与环境学院 ■ 郭建全 徐凤花 李金 赵忠宝 杜俊杰
一 引言
近年来,生物产甲烷技术因其具有废物资源综合利用和净化环境的双重功效而备受关注[1]。目前国内沼气发酵以中、高温为主,低温研究尚处探索阶段,一些研究者认为低于20℃沼气发酵速度将急剧降低[2~3]。我国北方地区池温在25℃以上仅有3个月,其余时间的户用沼气池平均池温在8~25℃,达不到中、高温发酵温度。若冬季进行沼气发酵,加热、保温措施会增加成本[3],因此选育能在低温下高效产气的菌株及复合菌系具有重要意义。
由于产甲烷古菌的分离培养十分困难,从应用角度来看选育产甲烷复合菌系是一个更好的选择。本文以低温厌氧活性污泥为出发样品,利用温度对微生物的选择作用,获得一组稳定的低温、高效产甲烷复合菌系,并研究了温度对复合菌系产甲烷活性的影响,以期为低温沼气发酵提供微生物资源。
二 材料与方法
1 样品来源
厌氧污泥、稻田灌溉渠污泥等不同厌氧生境的样品。
2 培养基质
(1)培养基
富集培养基(g/L):NH4Cl 1.0;MgCl2·7H2O 0.1;K2HPO4·3H2O 0.1;KH2PO4·3H2O 0.2;胰蛋白胨1;酵母膏1;乙酸钠2;甲酸钠2;L-半胱氨酸盐0.5。
维生素液(mg/L):生物素2;叶酸2;盐酸吡哆醇10;盐酸硫胺素5;核黄素5;D-泛酸钙5;维生素B12 0.1;硫辛酸5;对氨基苯甲酸5;烟酸 5。
微量元素(mg/L):MgSO4·7H2O 3.0;NaCl 10;MnSO4·2H2O 0.5;FeSO4·7H2O 0.1;CoCl20.1;H3BO30.01;CuSO4·5H2O 0.01;ZnSO40.1;AlK(SO4)2·12H2O 0.01;CaCl2·2H2O 0.1;NaMoO4·2H2O 0.01。
(2)酸化液
取自东北农业大学工程学院正在运行的沼气发酵罐中。
3 试验方法
(1)试验装置及仪器
倒置荧光相差显微镜、岛津GC2010气相色谱、发酵反应器。
试验装置由本实验室根据改良亨盖特厌氧技术设计而成,如图1所示。以250mL的广口瓶作为反应容器,倒置的量筒收集气体。整个反应体系置于恒温培养箱中,同时,用KHCO3调节每组反应物的初始pH值,使pH值为7.5±0.1。反应的周期为30d,在这个周期内,每一组的甲烷生成基本停止。

(2)低温产甲烷复合菌系的筛选
将100mL产甲烷菌富集培养液分装到图1的反应器中驱氧、灭菌备用。再加入30mL驯化样品,三次重复,14.0±0.5℃培养,定期通过排水法测定产气量,气相色谱测CH4含量。将产气量、CH4含量高的培养物继代培养,直至获得性能稳定的菌群。
(3)不同温度对复合菌系产气效果的影响
试验温度设6℃、10℃、14℃、18℃、22℃、26℃、30℃7个水平,3次重复,间隔一天测定产气量和甲烷含量,直到产气终止。
(4)复合菌系应用效果研究
以酸化液作为发酵原料,物料浓度为8%,设置四组试验,复合菌系的接种量分别设为5%、10%、15%按体积百分比进行接种,以接种5%的沼液为对照(CK),培养温度14±0.5℃、pH调整为7.0,发酵周期30d。发酵过程中每天用排水法测定产气量,气相色谱测定甲烷含量作为研究指标。
以酸化液作为发酵原料,初始发酵液的底物浓度分别设为4%、8%、16%、20%按质量百分比配制,在14±0.5℃、pH调整为7.0下进行30d的发酵,其他操作同上。
4 分析方法
(1)产甲烷复合菌系形态观察
荧光显微镜(DM4000B,德国Leica公司)、S-3400N扫描电子显微镜。
(2)气相末端发酵产物的测定
用岛津14C型气相色谱分析气体组分。TCD检测器,TDX-01不锈钢填充柱,氮气作为载气,流速为30 mL/min,进样口温度、柱温、检测器温度分别是80℃、80℃、100℃。
以外标法确定CH4标准曲线,气体检测环境为25℃。确定峰高与CH4体积含量的关系为y=0.4038x−0.0168,R2=0.9973。
(3)温度对产甲烷活性抑制程度的表示方法
以累计甲烷产量Q作为判定温度梯度对综合生物活性Am的影响指标,计算公式[4]为:

式中:Am为复合菌系的综合生物活性指标;Qt、Qc分别为考察系和对照系的累计甲烷产量(产气量×甲烷纯度)以26℃作为对照组。
相应地复合菌系受到温度抑制程度表达式为:

当温度抑制解除后,在恢复阶段复合菌系的生物活性为:

式中:AM为复合菌系恢复后的综合生物活性指标;QT、QC分别为恢复期间考察系、对照系的累计甲烷产量。
(4)统计分析
试验期间测定CH4、CO2及产气量所得数据以SPSS(17.0)中的单因素方差分析及Duncan氏多重比较进行统计分析,以P<0.05作为差异显著的水平。
5 产气量的测定
产气量采用自行设计排水装置(见图1)。
三 分析与讨论
1 复合菌系的筛选
以CH4、CO2含量及15d累计产气量为指标,从驯化的样品中选育出一组甲烷含量高、产气量稳定的复合菌系。
图2表明随着传代次数的增加,CH4含量明显提高,从第4代开始达到50%以上,第6代达到最高为63.3%,较样品提高386.0%,之后处于稳定保持在60%以上。伴随着CH4含量的提高CO2含量则迅速降低,经SPSS分析,驯化过程中CH4和CO2含量呈极显著负相关(P<0.05)。

15d累计产气量随着传代次数的增加也持续上升,1~5代产气量急剧增加,第5代15d时累计产气量达到最高为139mL,较驯化前提高了18.7%,经单因素方差分析达到显著水平(P<0.05),之后产气量稳定在132mL左右。传代过程中CH4含量及产气量提高与产甲烷古菌数量在富集过程中迅速增多结果一致(见图3)。产甲烷古菌有CO2、甲酸、乙酸、甲醇等多种营养类型,据此可以推断复合菌系中产甲烷古菌多为CO2营养型。
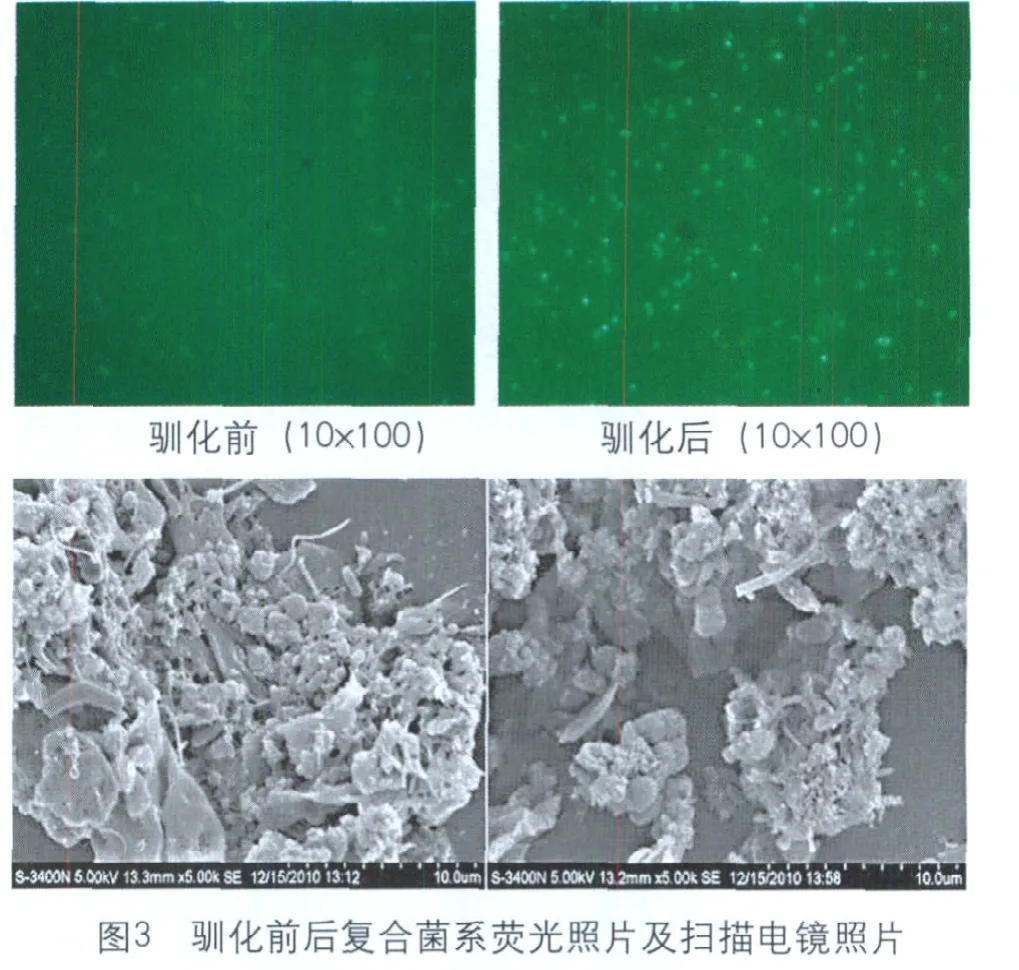
产甲烷古菌细胞内有两种特有的F420和F430辅酶,能在一定波长范围内产生蓝绿色荧光,因此荧光数量一定程度可以反映产甲烷古菌的数量[5]。
由图3可以看出,驯化前后复合菌系中产甲烷古菌的荧光数量及亮度有明显差异,驯化后荧光数量及亮度远大于驯化前,说明驯化对复合系中产甲烷古菌的富集有明显作用。现阶段发现的专性嗜冷产甲烷古菌多为甲烷八叠球菌。通过荧光显微照片和电镜照片(图3)可以看到,驯化后复合菌系中杆菌数量减少,球菌数量增多并以八叠球菌为主。
2 温度对复合菌系日产气量及甲烷含量的影响
温度是影响沼气发酵的重要因素。在沼气发酵过程中35~55℃为高温发酵,25~35℃为中温发酵,低于25℃为低温发酵。低温产甲烷古菌包括专性和兼性嗜冷菌。最适、最低、最高生长温度低于25℃、10℃、30℃的为专性嗜冷产甲烷古菌;最低生长温度低于10℃,但可在30~40℃下生长则为兼性嗜冷产甲烷古菌[7]。
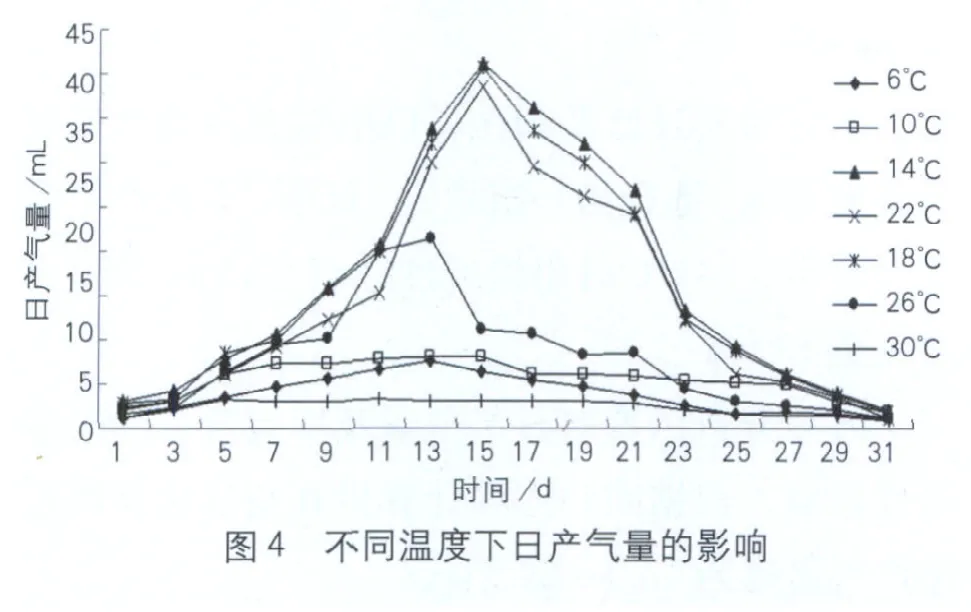
从图4不同温度下日产气量的变化动态中可以看出,复合菌系在14、18、22℃时启动时间均为9d,启动后日产气量在10mL以上持续了14d,26℃处理启动时间为7d,10mL以上日产气量为8d。随着发酵进行各处理日产气量先增加后降低,26℃时第13d达到最高为21.4mL,而14、18、22℃处理均在第15d达到高峰,分别为41.3、40.6、38.6mL,较26℃分别提高93.0%、89.7%和80.3%,单因素方差分析达到极显著水平(P<0.05)。多重比较显示14、18、22℃不同发酵时间日产气量差异不显著(P>0.05),6、10、30℃在整个发酵周期日产气量变化差异不显著(P>0.05)。
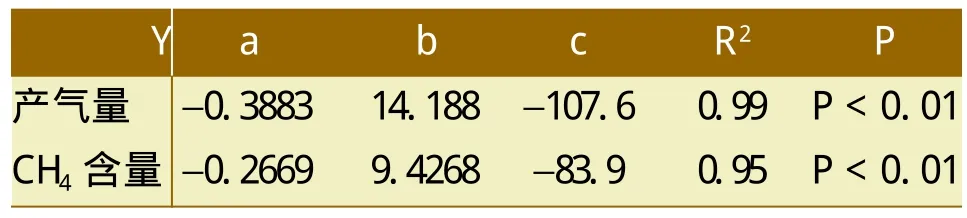
表1 产甲烷测定指标与温度T的二次回归方程(Y=aT2+bT+c)
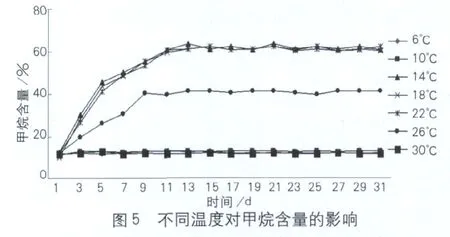
温度对复合菌系甲烷含量的影响如图5所示。从图5可以看出,复合菌系26℃处理第9d甲烷含量开始稳定,平均值稳定在41.6%,14、18、22℃培养时甲烷含量则在第11d达到稳定,平均值分别稳定在62.1%、61.7%、60.9%,分别较26℃提高49.2%、48.3%、46.4%,单因素方差分析均达到显著水平(P<0.05),但多重比较显示14、18、22℃甲烷含量均值差异不显著(P>0.05)。6、10、30℃处理在整个发酵周期甲烷含量差异不显著(P>0.05),这是由于温度可以通过影响产甲烷古菌的酶活性进而影响其产气能力。
利用产气量和CH4含量与温度的关系建立二次回归方程见表1。根据回归方程计算得出,温度在13.83℃和21.71℃复合菌系分别具有最大的CH4含量及产气量,因此13.0~22.0℃为该复合系的最适温度。表明该复合菌系能够在低温范围内正常产气并且产气指标均达到中、高温户用沼气发酵水平[8~9]。
3 不同温度对复合菌系发酵周期累计甲烷产量的影响
从图6中可以看出,当温度分别为14、18、22℃时,对产甲烷有促进作用,三者的产气量分别较26℃提高120.6%、93.9%和74.5%。当培养温度为6、10℃时,对产甲烷有抑制作用。抑制作用主要发生在反酵的中后期,累计甲烷产量下降了50.7%、17.7%,当培养温度达到30℃时产甲烷活性下降68.7%。
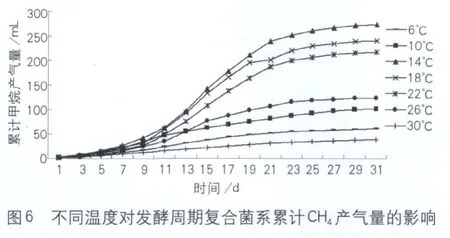
根据式(1)~式(3)计算出不同温度条件下复合菌系的综合生物活性、抑制程度及恢复过程中综合生物活性值。由表2可知,将一直由6、10℃处理的复合菌系置于14±0.5℃进行恢复性培养,其综合活性和一直在14±0.5℃条件下培养的综合活性值相同,但是30℃恢复后的综合活性值和受抑制时相比保持不变。表明6、10℃处理14±0.5℃条件培养时,产甲烷具有可恢复性,而30℃处理则不能恢复。
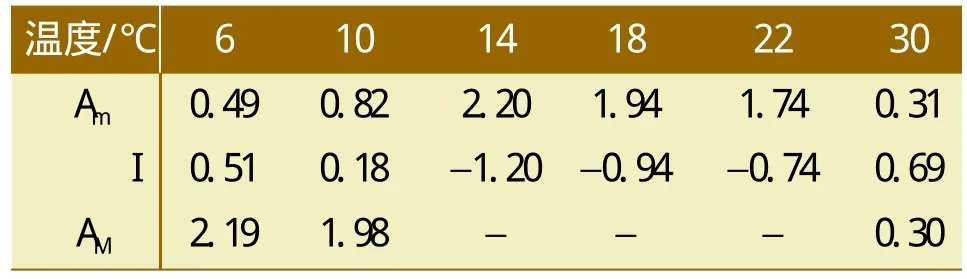
表2 综合生物活性、抑制程度及恢复后综合生物活性值
其原因是适宜的温度范围可以提高产甲烷活性,增加累计甲烷产量。但是超过最适温度范围时产甲烷古菌细胞内酶活、蛋白质和核酸会产生不可逆的变性,或者破坏了细胞的其他成分,导致抑制甚至致死作用,从而降低了产甲烷活性[10]。
根据定义推断,复合菌系中的微生物多为专性嗜冷产甲烷古菌,与图3结果相一致,但仍需进一步分离鉴定目前该工作正在进行。
4 复合菌系应用效果研究
不同复合菌系接种量对累计甲烷产气量的影响如图7所示。从图7可以看出,随着接种量的增加,累计甲烷产气量也持续增加,10%、15%接种量15d累计甲烷产气量最高分别为211mL、234mL,对照仅为103mL,分别较对照提高100.5%、106%,达到显著水平(P<0.05),多重比较显示10%、15%处理在整个发酵周期累计甲烷产气量变化差异不显著(P>0.05)考虑到添加成本问题,10%为最适接种量。

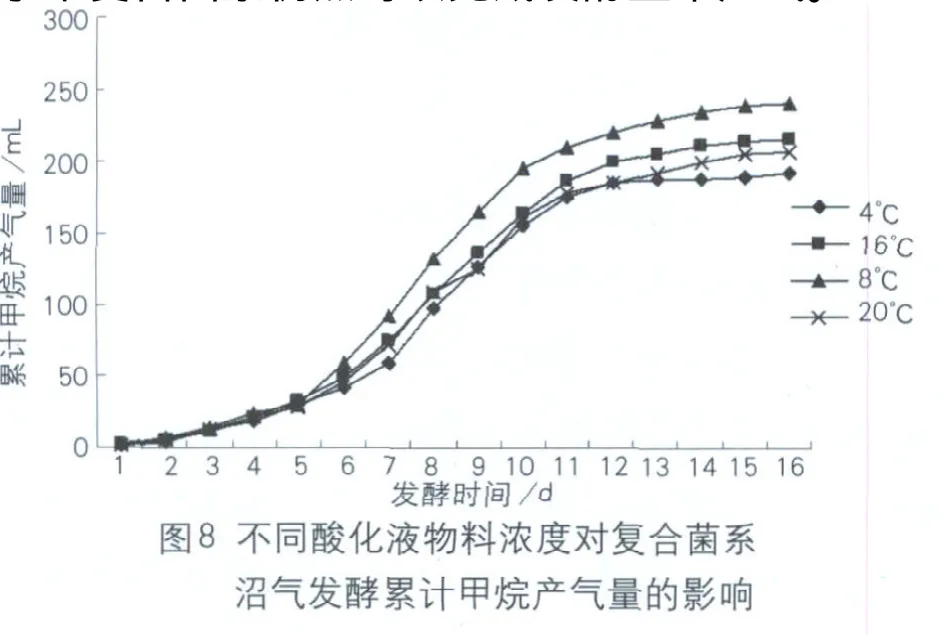
不同酸化液物料浓度对复合菌系沼气发酵累计甲烷产气量的影响如图8所示。从图中可以看出,酸化液物料浓度为8%时15d累计甲烷产气量最大为236mL,4%、16%、20%处理分别为201mL、213mL、207mL,分别较8%处理降低12.3%、11.6%、12.1%达到显著水平(P<0.05),多重比较显示4%、16%、20%处理整个发酵周期累计甲烷产气量变化差异不显著(P>0.05),表明8%为沼气发酵过程复合菌系的最佳底物浓度,且增加底物浓度接近干法水平复合菌系仍然可以完成发酵正常产气。
四 结论
本实验通过低温驯化,以甲烷含量及产气量为研究指标,选育出一组稳定、低温、高效产甲烷复合菌系。14.0℃时甲烷纯度达到63.3%,15d时产气量139mL。
方差分析温度对日产气量及甲烷含量均有显著性影响,根据回归方程计算得到复合菌系的最适产气温度为13.0~22.0℃。
产甲烷活性抑制与恢复实验表明当温度为14、18、22℃时,表现为促进产甲烷作用;当温度为6、10℃时,则表现为抑制产甲烷作用。重新置于14±0.5℃进行恢复性培养,原来6、10℃抑制作用消失,而30℃抑制作用保持不变,表明温度对复合菌系中的关键微生物在6、10℃的抑制作用是可恢复性的,而在30℃下则是不可恢复性的,从而推测复合菌系中的微生物多为专性嗜冷产甲烷古菌,尚需进一步分离鉴定目前该工作正在进行。
10%为该复合菌系最适接种量,8%为沼气发酵过程复合菌系的最佳底物浓度,且增加底物浓度接近干法水平复合菌系仍然可以完成发酵正常产气。
[1] 袁敏.低温厌氧生境中产甲烷古菌的分离、鉴定及菌群结构分析[D].中国农业科学院农业部沼气所,2009.
[2] 杨光.低温对沼气菌群产气能力的影响以及产甲烷菌的分离[D].西北农林科技大学,2008.
[3] 裴占江, 王大慰, 张楠, 等.温度对产甲烷菌群发酵性能的影响[J].黑龙江农业科学,2009, (5):128-129.
[4] 何仕均, 王建龙, 赵璇.氨氮对厌氧颗粒污泥产甲烷活性的影响[J].清华大学学报, 2005, 45(9):1294-1296
[5] 邓功成, 李静, 赵洪, 等.沼气发酵微生物低温驯化研究[J].安徽农业科学, 2009, 37(27):12894-12895.
[6] 苏海锋, 张磊, 曹良元, 等.低温下沼气促进剂驯化菌种及其应用研究[J].能源工程, 2008, (2):31-35.
[7] 袁敏, 胡国全.低温条件下的甲烷生成与嗜冷产甲烷古菌研究进展[J].中国沼气, 2009, 27(3):8-12.
[8] 王敦球, 蒙杰, 张琴,等.利用微生物菌群低温下提高沼气产气量试验研究[J].环境科学与技术, 2009, 32(1):32-34.
[9] 张振华, 呼世斌, 景岳龙, 等.变温条件下牲畜粪便与秸秆混合发酵研究[J].农机化研究, 2010, (7):205-208.
[10] 魏荣荣, 成官文, 罗介均, 等.不同温度猪粪厌氧发酵甲烷产量和产能实验[J].农机化研究, 2010, (4):170-171.
