Cu/SiO2两步法催化甘油氢解制备1,2-丙二醇
2011-10-19卯福林周小平
顾 斌,王 红,卯福林,周小平
(南京工业大学生物与制药工程学院,江苏 南京 211816)
研究开发
Cu/SiO2两步法催化甘油氢解制备1,2-丙二醇
顾 斌,王 红,卯福林,周小平
(南京工业大学生物与制药工程学院,江苏 南京 211816)
采用两步法从甘油制备1,2-丙二醇,首先甘油在催化剂上进行脱水反应生成丙酮醇,然后丙酮醇在催化剂上进行加氢反应生成1,2-丙二醇。两个反应应用的催化剂都是采用浸渍法制备的Cu/SiO2催化剂。催化剂制备简单,成本较低且绿色无污染。结果表明:加氢反应在反应温度为180 ℃,催化剂相对原料用量为10%,反应时间为30 h,反应压力为4 MPa,10%Cu负载量的催化剂上具有最高的转化率(>96%)和选择性(>96%)。该催化剂为双功能催化剂既具有酸中心又具有金属活性位点。研究结果表明催化剂上单质铜粒径的大小是影响催化剂活性的主要因素;催化剂表面铜物种与载体间较弱的相互作用使活性物种易于发生聚集,从而导致催化剂失活。制备的催化剂采用BET、XRD等进行了表征。
甘油;催化加氢;1,2-丙二醇
把生物质转化为高附加值的化学产品是绿色化学的一个重要研究方向[1-2]。绿色化学所追求的目标是化学反应的原料具有可再生性、化学过程不产生污染,实现高效的化学反应[3]。甘油作为一种理想的可再生原料,以其为平台可以提供一条绿色且经济的生产大宗化学产品的途径。它作为生物柴油的副产物产量大,每生产9 kg生物柴油就有1 kg粗甘油生成[4-5]。随着对生物柴油需求的持续增长,寻找和开发利用甘油的新用途,将其作为原材料加工成其它产品,不但可以降低生物柴油的生产成本和提高综合经济效益,而且还可以解决甘油的生产过剩问题。
甘油所富含的羟基易被官能化或降解,进而合成许多需要经过复杂的石油化工路线才能得到的化学品,其中选择性氢解可以得到各种二醇 ,包括乙二醇、1,2-丙二醇和 1,3-丙二醇等[6]。近年来,有关甘油催化氢解合成1,2-丙二醇的研究情况国外已有较多报道,而国内却鲜有报道。报道的催化剂一般是含 Rh[7-9]、Ru[8,10]、Pt[11-13]、PtRu[14]、AuRu[14]等贵金属以及Ni[15]基和Cu[7,10,16-17]基催化剂。
含有Pt、Pd、Ru、Rh等的活性炭负载贵金属催化剂在催化氢解中的研究较多,其中 Ru/C是研究最多、效果最好的一种贵金属催化剂。Ru/C催化剂由 Ru(NO)(NO3)3水溶液与较低比表面积的活性炭混合蒸发去除溶剂后在393 K下干燥12 h制得。其特点是:①具有较低比表面积且含较少的氧化性官能团的活性炭制备的催化剂催化效果较好;②催化剂活性与颗粒粒径大小无关。③催化剂在573 K下用30 cm3/m in的氩气进行预处理后使用效果更好;④Ru在甘油氢解反应中表现了很好的活性,但过多的Ru常促进C—C键的过分断裂,使反应进一步分解而得较多的碳氢化合物(主要是甲烷),一般5% Ru/C催化甘油的转化率及生产1,2-丙二醇的选择性最好[18]。Perosa等[15]采用Raney-Ni催化剂,在1.0 MPa H2、190 ℃下,反应20 h转化率达到63%,1,2-丙二醇选择性达到77%。Werpy等[19]发现Ni、Re/C双金属催化体系可催化合成1,2-丙二醇,在8.2 MPa H2、230 ℃下反应4 h,1,2-丙二醇产率为44%、选择性高达88%。反应受温度影响明显,稳定性较差,低温时效果好,但反应时间长,不利于实现工业化。Dasari等[16]利用 Cu/Cr催化剂催化氢解甘油生产1,2-丙二醇的选择性可达 95%以上,甘油的转化率接近100%。但是该催化体系中的Cr对环境污染较大。研究表明在各种金属催化剂当中,对甘油催化氢解生成1,2-丙二醇效果最好的是含Cu的催化剂。铜系催化剂对C—C键氢解的反应活性较低,而对C—O键的氢解活性较高[20-21],具有较高的1,2-丙二醇选择性。
本研究采用浸渍法制备了Cu/SiO2催化剂,使用两步法制备1,2-丙二醇,其中较温和的反应条件有利于第一步的脱水反应,而第二步的加氢反应需要较高的温度和压力。两步法工艺可以分别控制反应的工艺参数使两步反应都处在更佳的反应条件从而获得更高的收率以及降低反应成本。作者主要研究了第二步反应,即:以甘油在催化剂上进行脱水反应生成的丙酮醇为原料加氢制备 1,2-丙二醇的工艺研究及催化剂设计。结果表明,该催化剂具有较高的反应活性及选择性,其制备简单并且绿色无污染,有良好的工业应用前景。
1 实验部分
1.1 催化剂的制备
载体 SiO2的制备:将 136 g 的四乙氧基硅(TEOS)和20 g的去离子水加入烧杯中混合,然后放进油浴锅中在70 ℃下搅拌,并加入75.4 g稀硝酸[稀硝酸用 500 g去离子水和 37 g 浓硝酸(65%~88%)配制而成],后用保鲜膜封口,搅拌大约2 h,待形成凝胶后在120 ℃下干燥12 h。干燥后所得的固体在马弗炉中于300 ℃焙烧3 h得催化剂,制成10~50目的颗粒备用。
Cu/SiO2催化剂的制备:取 7.4 g 的Cu(NO3)2·3H2O,加入50 g的蒸馏水,待完全溶解后,倒入制备好的SiO2颗粒中,搅拌后浸渍24 h,放入120 ℃干燥箱干燥12 h,最后用马弗炉在450℃煅烧3 h,待降温后取出,使用10~50目的筛子过筛后得到成型的催化剂。
1.2 催化剂的表征
催化剂的比表面积是在 ASAP 2020(美国M icromeritics公司)型物理吸附仪上测定的,采用N2作吸附剂。样品经过300 ℃抽真空6 h预处理后,再进行比表面积测定。
样品的 X射线衍射(XRD)分析是在 D8 Advance型X射线衍射仪(德国Bruker公司)上进行的,采用Cu靶Kα射线作光源,扫描速度为5°/m in,扫描范围为2θ=10°~70°,管电压为40 kV,管电流为40 mA。
1.3 催化剂的活性评价
催化剂性能评价是在自行设计的反应装置上进行的。甘油脱水制丙酮醇的反应是在固定床反应器(长135 cm,内径3 cm)中进行的,在管式反应器内填充有500 g催化剂(位于反应管中部),反应管两端装填25~45目的石英砂。反应用25%的甘油水溶液以0.5 m L/min的流速泵入反应器中。产物收集于反应器后面的容器中。
丙酮醇加氢制1,2-丙二醇的反应是在反应釜中进行的。秤取10.0 g第一步反应的产物(丙酮醇的水溶液及少量副产物)和1.0 g Cu/SiO2催化剂加入高压反应釜中。拧紧反应器,通过氢气钢瓶向釜内充入适量氢气压力至2 MPa,关闭氢气钢瓶阀门和反应釜阀门。观察反应釜半小时,如果釜内压力无变化,可以确定反应装置不漏气。排出釜内气体,再进行一次同样的排气操作。基本可以排空釜内的空气,然后开始加热至温度达到预设值。打开氢气钢瓶阀门,把压力调节到反应所需的压力,再打开反应釜阀门使得釜内压力达到反应所需压力,打开磁力搅拌器调节到适当的转速进行反应。观察反应过程中压力的变化,压力每减少0.1 MPa就需要补气一次,确保反应在设定的压力下进行。反应结束后,等待反应釜冷却到室温再打开阀门放出气体,收集产物。产物用气相色谱仪(岛津GC-2010)进行分析,采用内标法计算各物质的百分含量。气相用氢气为载气,在色谱柱Stabilwax-DA上进行分析,气象色谱的检测器是热导检测器。液相产物用GC-MS进行分析,其副产物主要为乙二醇、甲醇、异丙醇、正丙醇、丙酮醇等。
2 结果与讨论
反应中用恒流泵将 25%的甘油水溶液以 0.50 m L/min的流量注入固定床反应器进行反应,反应温度为220 ℃。在甘油脱水反应中,甘油的转化率大于99%,丙酮醇的选择性大于96%。这一反应的结果表明,10%Cu/SiO2是一个有效的甘油脱水催化剂,甘油几乎达到100%的转化率。该产物丙酮醇的水溶液没有经过进一步提纯,在本研究工作中作为下一步反应的原料,进行丙酮醇的加氢反应。
2.1 载体对催化剂性能的影响
载体的选择对催化剂的性能影响较大,选择合适的载体不仅有利于提高反应活性而且对提高目的产物的选择性也很重要。铜基催化剂常用的载体是SiO2和 Al2O3。选用现有的几种常用载体,采用浸渍法制备了催化剂,考察了这些催化剂在丙酮醇氢解反应中的催化性能,结果见表1。
表1表示以Cu 为活性组分时载体SBA-15、堇青石、3A型分子筛、4A型分子筛、活性炭及SiO2)对催化性能的影响,活性组分的负载量为10%。由表1可以看出,载体对丙酮醇的转化率和 1,2-丙二醇的选择性影响较大。根据1,2-丙二醇的收率可以得出不同载体制备出的催化剂活性大小依次为 Cu/SiO2>Cu/活性炭>Cu/3A型分子筛>Cu/SBA-15 >Cu/堇青石>Cu/4A型分子筛。因此,选取SiO2作为催化剂的载体。
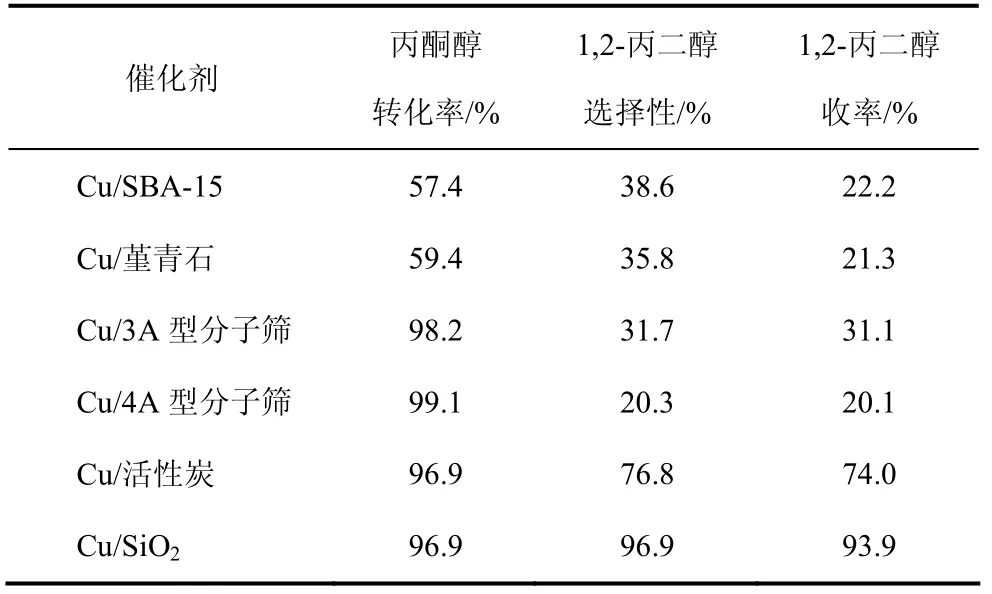
表1 不同载体对催化剂性能的影响
2.2 Cu负载量对催化剂性能的影响
对负载型催化剂而言,活性物种的负载量是影响催化活性的一个重要因素。
采用浸渍法制备了不同铜负载量的 Cu/SiO2催化剂,考察铜含量对丙酮醇氢解活性和主产物1,2-丙二醇选择性的影响。催化剂都在250 ℃下用氢气还原2 h预处理。催化剂的 XRD 图谱如图1所示。由图1可知催化剂3%Cu/SiO2、5%Cu/SiO2、8%Cu/SiO2和 10%Cu/SiO2中没有出现 CuO和Cu0的衍射峰,表明此时CuO或/和Cu0是高度分散在载体表面的非晶态物质。当铜负载量大于10%时,从图谱中可以观察到 Cu0的特征衍射峰(2θ=43.4°),随着铜负载量的增加衍射峰加强,说明催化剂中有Cu0晶相存在。

图1 不同铜含量催化剂反应前的XRD图谱

图2 不同铜含量催化剂反应后的XRD图谱
图2为反应后的Cu/SiO2催化剂的XRD图谱。从图中可以看出,没有SiO2的峰出现表明它仍然是非晶态。在2θ=43.4°处有明显的金属Cu0的衍射峰,并且峰的强度随负载量的增大而增强,这个现象说明在反应后的催化剂上发生了 Cu0的集聚,Cu0的粒径变大了,催化剂的活性可能会降低。
表2给出了丙酮醇在不同铜含量的催化剂上的加氢反应结果。由表 2可以看出,在 250 ℃和 4 MPa 下,随着Cu的负载量从3%增加到20%,丙酮醇的转化率从 58.5%升高至 98.5%。当 Cu的负载量从1%增加到10%时,1,2-丙二醇的选择性从 79.5%增加至 96.9%;Cu的负载量超过 10%时,1,2-丙二醇的选择性略有下降,生成了少量的乙二醇和CO2等。对于3%Cu/SiO2催化剂,由于铜的负载量过低,催化剂表面的活性中心数量不足,因此丙酮醇的转化率很低。对于 10%Cu/SiO2催化剂,铜的负载量较 3%Cu/SiO2催化剂提高3倍多,因此丙酮醇的转化率明显提高。由表2可以看出BET比表面积随着铜负载量的增大而减小的现象,说明过高的 Cu负载量可能使载体表面Cu形成多层负载,生成较大的Cu0晶体。XRD 的研究结果表明,当铜的负载量大于 10%时,催化剂上出现金属Cu0的衍射峰(图1),并且随铜含量的增加Cu的衍射峰增强,铜晶体可能长大。本文作者认为催化剂表面高度分散的微簇是反应的主要活性中心,大晶粒的 Cu0表面可能有催化副反应发生,从而产生了较多乙二醇等副产物。因此,当铜负载量从10%增加到20%时1,2-丙二醇的选择性下降。
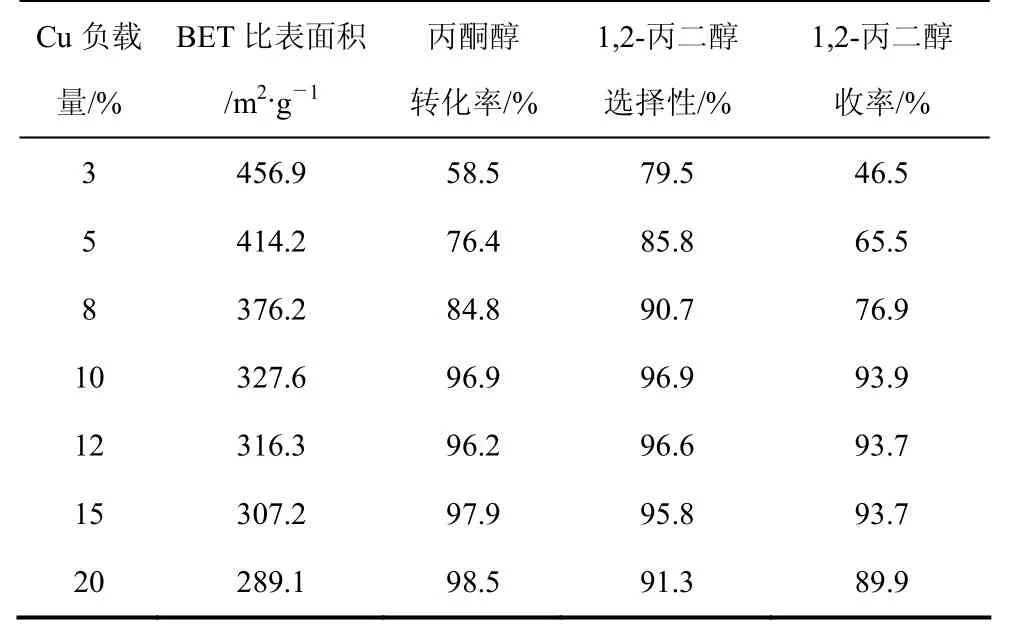
表2 铜负载量对催化剂性能的影响
2.3 反应温度对催化剂性能的影响
表3给出了在不同反应温度下Cu/SiO2催化剂上丙酮醇氢解生成 1,2-丙二醇反应的结果。由表 3可看出,反应温度对丙酮醇的转化率和生成1,2-丙二醇的选择性有较大影响。随着反应温度的升高,丙酮醇的转化率由25.8%提高至 96.9%;1,2-丙二醇的选择性出现先增加后减少的趋势,在 200 ℃时,1,2-丙二醇的选择性达到 97.6%。1,2-丙二醇的收率在180 ℃时最好,为93.9%。因此,180 ℃为该反应的最佳反应温度。在220 ℃时由于水蒸气重整反应,1,2-丙二醇的选择性很低。
2.4 反应压力对催化剂性能的影响
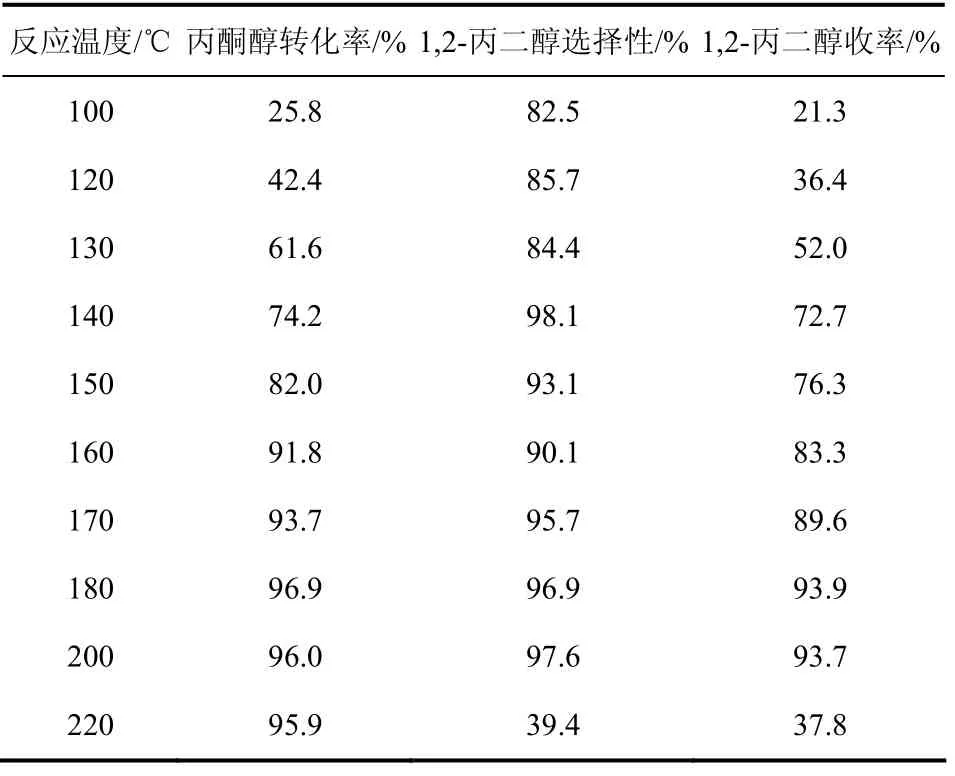
表3 反应温度对催化剂性能的影响
表 4给出了在 180 ℃和不同氢气压力下丙酮醇在 Cu/SiO2催化剂上氢解生成 1,2-丙二醇的反应结果。结果表明,增加反应压力有助于丙酮醇的加氢反应,但是考虑到反应的安全性和工业化成本,4.0 MPa的反应压力比较合适。
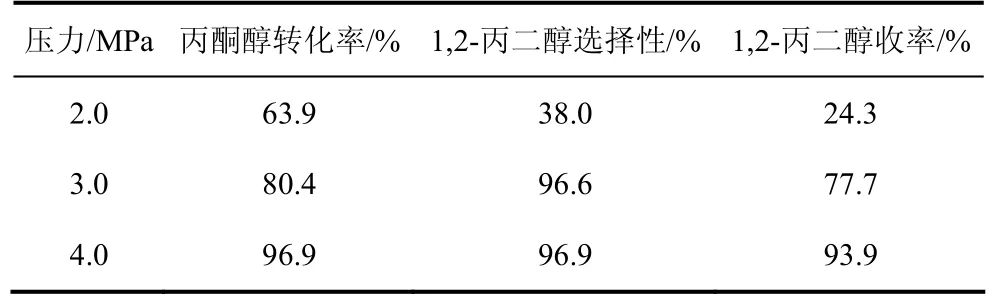
表4 反应压力对催化剂性能的影响
2.5 不同反应时间对反应的影响
表5给出了反应时间对反应的影响。随着反应时间的增加,转化率、选择性、收率都有所增加。但是考虑到反应的效率,选取30 h为合理的反应时间。
2.6 不同催化剂用量对反应的影响
表 6给出了催化剂相对原料用量对反应的影响。随着催化剂用量的增加,1,2-丙二醇的收率出现先升高后下降的趋势,在15%的时候达到最大。催化剂相对用量为10%时1,2-丙二醇的收率只是略低于15%时的催化剂相对用量。考虑到反应的经济性,选取10%的催化剂相对原料用量。
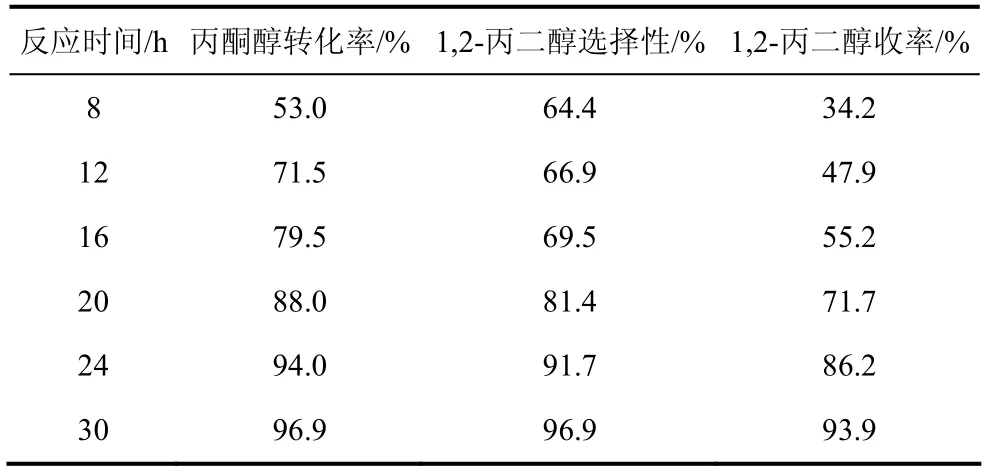
表5 不同反应时间对反应的影响

表6 不同催化剂用量对反应的影响
2.7 催化剂稳定性测试
为了了解催化剂的稳定性,考察了Cu/SiO2催化剂在丙酮醇氢解反应中的性能。如表7所示,随着反应次数的增加,丙酮醇的转化率和1,2-丙二醇的选择性均出现下降的趋势,丙酮醇的转化率由开始的96.9%下降至79.3%,选择性亦从 96.9%下降至85.3%。

表7 催化剂稳定性测试
对比图1、图2反应前后催化剂的XRD表征结果可知,反应后的催化剂峰强增加,说明在反应后,催化剂的活性物种粒径长大。可能正是因为 Cu0粒径的增大导致了催化剂失活。也可能是负载的 Cu0从载体表面脱落造成了催化剂的活性下降。
3 结 论
采用两步法从甘油制备1,2-丙二醇,并重点研究了加氢反应的工艺参数。使用浸渍法制备了具有不同铜负载量的 Cu/SiO2催化剂并考察了催化剂的反应性能。此催化剂既有酸性位又有金属加氢位,是双功能型催化剂。结果表明:负载量 10% Cu/SiO2催化剂表现出了较好的催化性能,在优化的反应条件下,1,2-丙二醇的收率达到93.9%。
结合 XRD 及 BET等表征结果,可以认为催化剂上单质铜粒径的大小是影响催化剂活性的主要因素;催化剂表面铜物种与载体间较弱的相互作用使活性物种易于发生聚集,从而导致催化剂活性降低。
[1] Clark J H. Green chem istry:Today(and tomorrow)[J].Green Chem.,2006:17-21.
[2] Dale B E. ‘Greening’ the chem ical industry:Research and development priorities for biobased industrial products[J].J.Chem.Technol. Biotechnol.,2003,78:1093-1103.
[3] 闵恩泽.绿色化学技术[M].南昌:江西科学技术出版社,2001:1-28.
[4] Suppes G J,Dasari M A,Goff M J,et al.Transesterification of soybean oil w ith zeolite and metal catalysts[J].Appl.Catal.A:Gen.,2004,257:213-223.
[5] Plank C,Lorbeer E. Simultaneous determ ination of glycerol,and mono-,di- and triglycerides in vegetable oil methyl esters by capillary gas chromatography[J].J. Chromatogr. A,1995,697:461.
[6] Huang L,Zhu Y L,Zheng H Y,et al. Continuous production of 1,2-propanediol by the selective hydrogenolysis of solvent-free glycerol under m ild conditions[J].J. Chem.Technol.Biotechnol.,2008,83:1670 .
[7] Cham inand J,Djakovitch L A,Gallezot P,et al. Glycerol hydrogenolysis on heterogeneous catalysts[J].Green Chem.,2004,6:359-361.
[8] Lahr D G,Shanks B H. Effect of sulfur and temperature on ruthenium-catalyzed glycerol hydrogenolysis to glycols[J].J. Catal.,2005,232:386-394.
[9] Furikada I,M iyazawa T,Koso S,et al. Catalytic performance of Rh/SiO2in glycerol reaction under hydrogen[J].Green Chem.,2007,9:582-588.
[10] Brandner A,Lehnert K,Bienholz A,et al. Production of biomassderived chemicals and energy:Chemocatalytic conversions of glycerol[J].Top Catal.,2009,52:278-287.
[11] M iyazawa T,Koso S,Kunimori K,et al. Development of a Ru/C catalyst for glycerol hydrogenolysis in combination w ith an ion-exchange resin[J].Appl. Catal. A:Gen.,2007,329:30-35.
[12] Kurosaka T,Maruyama H,Naribayashi I,et al.Production of 1,3-propanediol by hydrogenolysis of glycerol catalyzed by Pt/WO3/ZrO2[J].Catal.Commun.,2008,9:1360-1363.
[13] Yuan Z,Wu P,Gao J,et al.Pt/solid-base:A predom inant catalyst for glycerol hydrogenolysis in a base-free aqueous solution[J].Catal.Lett.,2009,130:261.
[14] Maris E P,Ketchie W C,Murayama M,et al.Hydrogenolysis of glycerol catalyzed by Ru-Cu bimetallic catalysts supported on clay w ith the aid of ionic liquids[J].J. Catal.,2007,251:281-294.
[15] Perosa A,Tundo P. Selective hydrogenolysis of glycerol w ith Raney nickel[J].Ind.Eng.Chem.Res.,2005,44:8535-8537.
[16] Dasari M A,Kiatsimkul P P,Sutterlin W R,et al. Low-pressure hydrogenolysis of glycerol to propylene glycerol[J].Appl.Catal.A:Gen.,2005,281:225-231.
[17] Balaraju M,Rekha V,Prasad P S S,et al.Selective hydrogenolysis of glycerol to 1,2 propanediol over Cu-ZnO catalysts[J].Catal.Lett.,2008,126:119-124.
[18] M iyazawa T,Koso S.Parameters affecting the formation of 1,2-propanediol from glycerol over Ru/SiO2catalyst[J].Appl. Catal. A:Gen.,2007,318:244-251.
[19] Werpy T A,Frye J G,Zacher A H,et al. Hydrogenolysis of 6-carbon sugars and other organic compounds:US,6841085B2[P]. 2005-01-11.
[20] Runeberg J,Baiker A,Kijenski J. Copper catalyzed am ination of ethylene glycol[J].Appl. Catal.,1985,17:309-319.
[21] Montassier C,Giraud D,Barbier J.Polyol conversion by liquid phase heterogeneous catalysis over metals[J].Stud. Surf. Sci. Catal.,1988,41:165-170.
Hydrogenolysis of glycerol to 1,2-propanediol by two steps over Cu/SiO2
GU Bin,WANG Hong,MAO Fulin,ZHOU Xiaoping
(Department of Biotechnology and Pharmaceutical Engineering,NanJing University of Technology,Nanjing 211816,Jiangsu,China)
1,2-propanediol was prepared by hydrogenolysis of glycerol in two steps. Firstly,glycerol was dehydrated over bi-functional catalyst Cu/SiO2into acetol,which was in turn hydrogenated into 1,2-propanediol over the same catalyst. The catalyst Cu/ SiO2was prepared,by the coprecipitation method. The catalyst preparation was simple,of low cost,and environmentally friendly. The prepared catalyst was characterized w ith BET and XRD. The result indicated that the prepared catalyst had comparatively high activity. The best conversion(>96%)and selectivity(>96%)performance of the catalyst was achieved when the Cu loading amount was 10%. This bi-functional catalyst possessed acid site and metal active site as well. The particle size of Cu was the major factor to influence the activity of the catalyst. Deactivation of the catalyst was attributed to interaction of the copper species on the catalyst surface and the carrier,which caused aggregation of the active species.
glycerol;catalytic hydrogenation;1,2-propanediol
TQ 214
A
1000–6613(2011)09–1961–06
2011-02-28;修改稿日期:2011-03-27。
顾斌(1987—),男,硕士研究生。联系人:周小平,教授。E-mail hgx2002@hnu.cn。
