巴氯芬与胃蛋白酶相互作用的光谱研究
2011-10-16李步海刘宇飞孙小梅
李步海,刘宇飞,孙小梅,王 献
(中南民族大学化学与材料科学学院分析化学国家民委重点实验室,武汉430074)
巴氯芬与胃蛋白酶相互作用的光谱研究
李步海,刘宇飞,孙小梅,王 献
(中南民族大学化学与材料科学学院分析化学国家民委重点实验室,武汉430074)
采用荧光光谱法和紫外可见吸收光谱法研究了巴氯芬与胃蛋白酶的结合.观测到巴氯芬使胃蛋白酶的最大紫外吸收峰蓝移.由Stern-Volmer方程求得其荧光猝灭类型为静态猝灭,求出结合常数,由热力学参数判断其作用力主要为疏水作用.根据非辐射能量转移理论,胃蛋白酶与巴氯芬之间发生了能量转移,从而使胃蛋白酶发生了荧光猝灭.用红外光谱法研究了巴氯芬对胃蛋白酶的影响,结果表明:巴氯芬改变了胃蛋白酶的二级结构.
巴氯芬;胃蛋白酶;静态猝灭;光谱法
巴氯芬(baclofen,4-氨基-3(4-氯苯)-丁酸),是哺乳动物中枢神经系统中神经递质的主要抑制剂[1],通过GABAA,GABAB,和GABAC三种不同类型的受体执行其生理功能[2].主要用于骨骼肌松驰,神经性痉挛如多重硬化及外伤等.
胃蛋白酶(pepsin),长期以来被认为是胃部疾病的攻击因子之一[3].药物分子进入胃后必定会与胃蛋白酶发生作用.然而目前对巴氯芬与胃蛋白酶相互作用后光谱性质变化的研究尚未见报道.本文用光谱法研究了巴氯芬与胃蛋白酶相互作用,为探明巴氯芬对胃蛋白酶构象的影响提供数据.
1 仪器与试剂
UV-2550型紫外可见分光光度计(日本岛津);L S-55型荧光/磷光发光分光光度计 (美国PE公司);pHS-3C型精密酸度计(上海虹益仪表有限公司);SHZ-03恒温水浴摇床(上海堪鑫仪器设备有限公司);FTS 240型傅立叶变换红外光谱(N icolet M agna-750Ⅱ).
巴氯芬(意大利M SDS公司);胃蛋白酶(1∶3000,苏州吴县生物化学厂).溶液用超纯水配制.胃蛋白酶溶液用0.10 mol/L N aA c-HA c缓冲液(含0.10 mol/L N aCl以保持相同的离子强度)配制,以保持胃蛋白酶生理pH=2.00±0.02.
2 实验方法
2.1 巴氯芬对胃蛋白酶紫外光谱的影响
于2 mL 3.0×10-5mol/L胃蛋白酶液中加入不同体积的1.0×10-3mol/L巴氯芬溶液,定容至10.0 mL.静置约0.5 h,以同浓度的巴氯芬作参比,记录不同浓度的巴氯芬作用下胃蛋白酶的紫外吸收光谱.
2.2 巴氯芬对胃蛋白酶荧光光谱的影响
于5mL 1.0×10-5mol/L胃蛋白酶液中加入不同体积的1.0×10-3mol/L巴氯芬溶液,定容至10.0 mL.在一定温度下静置0.5 h,用恒温循环水维持其温度,分别在λex=278 nm 和λex=295 nm 处,于300~400 nm范围扫描胃蛋白酶的荧光光谱及胃蛋白酶在巴氯芬作用下的荧光猝灭光谱.
2.3 巴氯芬对胃蛋白酶红外光谱的影响
将少量巴氯芬与胃蛋白酶放入玛瑙研钵中,加入少量水,充分研磨,直至水分烘干.以KBr为压片,测定其红外光谱,并扣除巴氯芬谱线,比较所得谱图与胃蛋白酶谱图.
3 结果与讨论
3.1 巴氯芬对胃蛋白酶的紫外光谱
巴氯芬对胃蛋白酶紫外光谱的影响见表1.
由表1可见,随着巴氯芬浓度的升高,胃蛋白酶的吸光度变化不大,但最大吸收波长随巴氯芬浓度的升高而发生蓝移.胃蛋白酶在266.5 nm处的吸收由多种因素所引起,如氨基酸残基(T rp(色氨酸)、Tyr(酪氨酸)、Phe(苯丙氨酸))侧链基团对光的吸收以及由于某些氢键的吸收、或与其构象和螺旋有关的相互作用[4].随着巴氯芬浓度的增加,胃蛋白酶体系发生蓝移,说明巴氯芬可能影响了胃蛋白酶T rp、Tyr及Phe残基的微环境,并使其结构发生了一定的变化,导致胃蛋白酶电子跃迁形式及能级差发生变化.
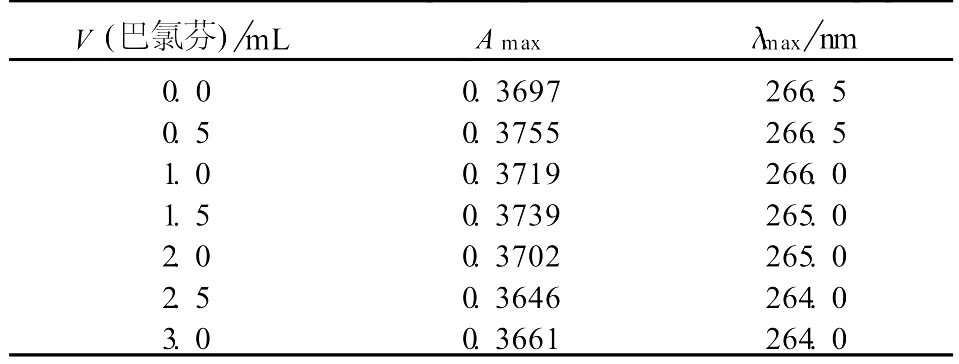
表1 巴氯芬-胃蛋白酶的紫外最大吸收光谱数据Tab.1 UV maximum absorption spectra data of baclofen-pepsin
3.2 巴氯芬对胃蛋白酶的荧光光谱
3.2.1 巴氯芬对胃蛋白酶的荧光猝灭作用
依照2.2的方法测定在不同浓度下巴氯芬对胃蛋白酶的荧光强度,结果见图1.
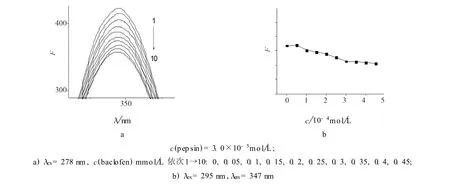
图1 37℃下不同浓度巴氯芬对胃蛋白酶的荧光猝灭作用Fig.1 Quenching of fluorescence spectra of pepsin after treatment w ith different concentration of baclofen at 37℃
由于蛋白质中T rp、Tyr、Phe的存在使其具有内源荧光.此蛋白质内源荧光可作为探针检测蛋白质构象变化[3].T rp、Tyr、Phe因为其侧链生色基团的不同而有不同的荧光激发和发射光谱.278 nm波长激发时,蛋白质分子中的T rp和Tyr残基受到激发(见图1a),而295 nm波长光仅激发蛋白质分子中T rp残基(见图1b),所产生荧光的强度和位置与这些残基所处的微环境密切相关[5,6].
由图1可见,随着巴氯芬浓度的升高,胃蛋白酶在278 nm和295 nm的激发波长下,其最大发射波长均在347nm附近.而在278 nm激发波长下,胃蛋白酶的荧光强度随巴氯芬浓度的升高而降低,而在295 nm激发波长下则变化不明显.由此说明,巴氯芬主要作用于胃蛋白酶中的Tyr残基,并改变了Tyr所处的微环境,使其结构发生了变化,导致胃蛋白酶的内源荧光发生猝灭,而巴氯芬同T rp残基的作用则较弱.
3.2.2 巴氯芬对胃蛋白酶内源荧光的猝灭机制
能使胃蛋白酶荧光发生猝灭的机制主要有2种,即动态猝灭和静态猝灭.动态猝灭是由蛋白质激发态分子和小分子物质因热运动发生碰撞而引起的,其作用过程符合Stern-Volmer方程[7]:

式(1)中Kq为Stern-Volmer猝灭常数,ζ0为无猝灭剂时生物大分子的平均寿命,通常取值10-8s,Ksv为双分子猝灭过程速率常数.依据Stern-Volmer方程,对F0/F和[Q]进行线性回归,所得37℃时Stern-Volmer方程及其相关系数如下:
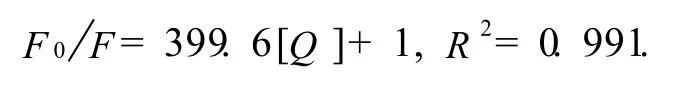
由式(1)可得,巴氯芬对胃蛋白酶的荧光猝灭常数Kq=4.0×1010L/(mol·s),略大于猝灭剂对生物大分子最大扩散控制的碰撞猝灭常数2.0×1010L/(mol·s)[9],说明巴氯芬对胃蛋白酶的猝灭可能由动态猝灭与静态猝灭共同产生的.3.2.3 结合常数、结合位点数、热力学参数的计算
按文献[9]公式(2),可算得巴氯芬在不同温度下与胃蛋白酶的结合常数及结合位点数.

式(2)中,F0为空白胃蛋白酶的荧光强度;F为加入巴氯芬后的荧光强度;Kb为结合常数;n为结合位点数;[Q]为巴氯芬浓度;通过公式(2)作图lg[(F0-F)/F]~lg[Q],可得不同温度下的线性方程,结合常数和结合位点数见表2.

表2 不同温度下巴氯芬与胃蛋白酶的结合常数和结合位点数Tab.2 Binding constants and binding sites between baclofen and pepsin at different temperatures
由表2可见,巴氯芬与胃蛋白酶的结合常数与结合数随着温度的升高而升高,这表明,升温度有利于巴氯芬同胃蛋白酶的结合.
通过不同温度下巴氯芬与胃蛋白酶的结合常数,可根据热力学公式(ΔG= ΔH-TΔS,且ΔG=-R T·lnK,得lnK=-ΔH/R T+ΔS/R),计算巴氯芬与胃蛋白酶结合的热力学参数,所得结果见表3.

表3 巴氯芬-胃蛋白酶体系的热力学参数Tab.3 Thermodynam ic parameters of the baclofen-pepsin system
由表3可见,巴氯芬与胃蛋白酶作用,均ΔG<0,说明反应均为自发反应.依据热力学常数及其大小确定作用力类型[9]:当ΔH>0,ΔS>0时为典型的疏水作用力;当ΔH<0,ΔS>0时为氢键和范德华力;当ΔH≈0或较小,ΔS>0时为静电作用力;当ΔH<0时,静电作用力为主要作用力.由此可见,巴氯芬同胃蛋白酶的结合以疏水作用力为主.
3.2.4 巴氯芬与胃蛋白间的能量转移
图2为巴氯芬溶液的紫外吸收光谱(见图2a)和胃蛋白酶溶液的荧光光谱(见图2b).比较2图谱,可见二者有重叠部分.根据F¨o rster非辐射能量转移理论[7],可认为胃蛋白酶与巴氯芬之间发生了能量转移作用,从而使胃蛋白酶发生了荧光猝灭.
3.3 巴氯芬对胃蛋白酶红外光谱的影响
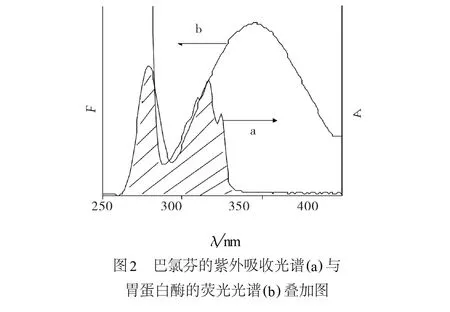
Fig.2 Overlapping between the UV absorption spectra ofbaclofen(a)and em ission spectrum of pepsin(b)
依据2.3节方法,得胃蛋白酶及巴氯芬-胃蛋白酶的红外图谱,见图3.

图3 胃蛋白酶(a)与巴氯芬-胃蛋白酶混合物(b)的红外光谱Fig.3 FT-IR spectra of the pure pepsin(a)and the m ixture of baclofen and pepsin(b)
蛋白质IR的酰胺I带在1600~1700 cm-1(主要为C=O伸缩振动)有吸收;酰胺Ⅱ带在l600~1500cm-1(主要为C—N伸缩振动和N—H的弯曲振动)有吸收.酰胺Ⅰ带和酰胺Ⅱ带的IR吸收峰的变化反映了蛋白质的二级结构的变化[10].由图3可知,结合巴氯芬后,胃蛋白酶的酰胺I带吸收峰的位置向低波数位移约5 cm-1,而酰胺Ⅱ带(1533.8 cm-1)的吸收峰则变得非常微弱.此结果表明巴氯芬与胃蛋白酶发生作用后,使得胃蛋白酶多肽链的C—N或N—H发生了变化,并改变了胃蛋白酶的二级结构.
[1] Sunit M Patel, Ivor S Ebenezer. The effects of chronic intraperitoneal adm inistration of the GABAB receptor agonist baclofen on food intake in rats.[J].European Journal of Pharmacology,2008,593:68-72.
[2] Gabriele C,A ntonio M,A ntonio E G,et al.Q SAR and molecular modeling studies of baclofen analogues as GABAB agonists: insights into the role of the aromatic moiety in GABAB binding and activation[J].M ed Chem,2001,44:1827-1832.
[3] 谢 光,刘芯韵,郑 芸,等.茶碱与胃蛋白酶相互作用的光谱性质研究[J].天然产物研究与开发,2006,18:558-561.
[4] 李 政,赵 巍,张蜀艳,等.粪臭素对胃蛋白酶部分理化性质的影响[J].天然产物研究与开发,2007,19:599-602.
[5] 张 静.荧光光谱法研究盐酸胍浓度不同时变性胰蛋白酶的构象变化[J].光谱学与光谱分析,2004,24:455-458.
[6] 雷 芳,喻 东,胡 源,等.葛根素对胃蛋白酶部分性质的影响[J].天然产物研究与开发,2005,17:704-707.
[7] 冷晓莲,杨 娟,苏 波,等.芦丁对胃蛋白酶部分性质的影响[J].天然产物研究与开发,2007,19:270-273.
[8] Cui Fengling,Fan Jing,L i Jianping,et al.Interactions between 1-benzoyl-4-p-chlorophenyl thiosem icarbazide and serum album in: investigation by fluorescence spectroscopy[J].Bioorganic&M edicinal Chem istry,2004,12:151-157.
[9] Zhang Yezhong,Dai Jie,Zhang Xiaoping.Studies of the interaction between Sudan I and bovine serum album in by spectroscopic methods. [J].Journal of M olecular Structure,2008,888:152-159
[10] 张海蓉,边贺东,潘英明,等.光谱法研究儿茶素与牛血清白蛋白的相互作用[J].光谱学与光谱分析,2009,29:3052-3056.
Study of Interaction between Baclofen and Pepsin by SpectroscopyM ethods
L i B uhai,L iu Yuf ei,S un X iaom ei,W ang X ian
(Key L aboratory of A nalytical Chem istry of the State Ethnic A ffairs Comm ission,South-centralU niversity for N ationalitiesW uhan 430074,China)
The binding interaction between baclofen and pepsin was studied by ultraviolet absorption and fluorescence spectroscopies.Baclofen caused max imum of UV absorption peak of pepsin to undergo a blue shift.Stern-Volmer equation indicated that the fluorescence intensity of pepsin was quenched by baclofen via a static quenching mechanism,and the association constantswere calculated.The thermodynam ic parameters showed that the main binding force was hydrophobic inature.M eanwhile,according to the non-radiative energy transfer theory,there is a energy transfer between pepsin and baclofen,so that the fluorescence intensity of pepsin was quenched.FT-IR investigation showed that the secondary structure of pepsin has been changed by baclofen.
baclofen;pepsin;static quenching;spectroscopy
R971+.8;O657.3
A
1672-4321(2011)01-0021-04
2011-01-22
李步海(1946-),男,教授,研究方向:富集分离,E-mail:libh@scuec.edu.cn
国家自然科学基金资助项目(20705041)
