改良的黄嘌呤氧化酶法测定动植物组织中S O D比活力
2011-10-13黄汉昌
徐 东,赵 建,黄汉昌,文 镜*
(北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191)
改良的黄嘌呤氧化酶法测定动植物组织中S O D比活力
徐 东,赵 建,黄汉昌,文 镜*
(北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191)
针对黄嘌呤氧化酶法测定动植物组织中SOD活力存在干扰的问题,对方法加以改良。以使SOD变性而不影响干扰物质的干扰值为原则,通过测定酶活力及圆二色光谱寻找制备样品空白的最佳实验条件,设计经过加热的样品空白;利用扣除法排除样品中其他物质对黄嘌呤氧化酶体系的干扰;通过加标回收实验以及对动植物组织的实测,对改良前后的测定结果进行比较。结果表明:用改良的黄嘌呤氧化酶法可使动植物组织中SOD活力的检测结果更准确。
黄嘌呤氧化酶法;样品空白;检测超氧化物歧化酶活力
超氧化物歧化酶(SOD)是生物体内能够清除超氧阴离子自由基的预防型抗氧化剂[1],在动植物体内广泛存在,因其具有抗衰老、提高机体对多种疾病的抵抗力,增强机体对外界环境的适应力,减轻肿瘤患者在放疗、化疗过程中的毒副作用等生理功能,已作为一种抗氧化功能因子用于临床、食品、化妆品等领域[2-4]。目前,动、植物中SOD活性的测定方法有很多,主要包括邻苯三酚法、化学发光法、NBT还原法及黄嘌呤氧化酶法等[5]。其中黄嘌呤氧化酶法是目前应用最广泛的测定SOD活性的方法,该方法以对反应体系中产生的超氧阴离子自由基的清除率定义为酶的活力单位[6]。其检测的基本原理是在反应体系中先产生超氧阴离子自由基,超氧阴离子自由基作用于某种化合物最终使之产生颜色反应即对一定波长光的特异吸收,用分光光度计测定其吸光度。而当反应体系中加入待测SOD后,由于SOD的作用使应体系中超氧阴离子自由基数量减少,分光光度计测定的吸光度减少。根据这两个吸光度值可以计算反应体系中加入的SOD对超氧阴离子自由基的清除率从而计算出SOD的活力和比活力[7]。最初设计者设计这种方法的目的是测定SOD样品的活性,从实验原理到具体操作步骤都没有问题,但是近年来随着人们对抗氧化天然产物及食品的研究越来越有兴趣,人们开始采用这一方法测定天然产物或食品中SOD的活力,也有人将天然产物或食品饲喂动物后测定动物组织中SOD的活力,甚至直接检测人体血清中SOD的活力[8-9]。但是最初设计者所设计的方法只是针对SOD样品的,并不适用于这些天然产物、食品或动物组织的测定。在一些期刊、杂志上出现了用这种方法对天然产物、食品或动物组织测定结果的报告。实际上当人们将天然产物、食品或动物组织的提取液加入到反应体系中去之后。由于自由基的活泼性。反应体系中的超氧阴离子自由基不仅与样品中的SOD发生反应。而且与加入的组织提取液中的其他化合物同时发生反应。按照小鼠血清中所含比例向黄嘌呤氧化酶法测定SOD反应体系中分别加入总蛋白、清蛋白、甘油三酯、葡萄糖、谷胱甘肽等物质都测到“SOD活性”[10],证明血清中的这些物质都会给SOD的测定带来严重的干扰从而使检测结果大大的高于真实值。为了消除黄嘌呤氧化酶法测定SOD的干扰,有必要对该方法加以改良,使其能够运用于对动植物组织的测定。
1 材料与方法
1.1 试剂与仪器
磷酸二氢钠、磷酸氢二钠、盐酸羟胺、黄嘌呤、黄嘌呤氧化酶、对氨基苯磺酸、甲萘胺、VC(均为分析纯) 广东西陇化工厂;还原型谷胱甘肽 上海丽珠东风生物技术有限公司;SOD标准品(6000U/mg) 北京Biodee生物技术有限公司;总蛋白校准液(7.0g/dL)、白蛋白校准液(4.0g/dL)、甘油三脂校准液(2.26mmol/L)、葡萄糖校准液(5.55mmol/L) 中生北控生物科技股份有限公司。
UV2450可见-紫外分光光度计 日本岛津公司;电热恒温水浴锅;BP211D电子天平(精度0.01mg) 德国赛多利斯公司;Plus-Pr015XXM/PL5123超纯水系统 美国Pall Purelab公司;微量移液器。
1.2 方法
1.2.1 实验原理和操作步骤
实验通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O2·),它氧化盐酸羟胺形成亚硝酸盐,亚硝酸盐再与对氨基苯磺酸及甲萘胺反应产生紫红颜色化合物。当反应体系中加入SOD之后,催化超氧阴离子自由基发生歧化反应而减少,进而使形成的亚硝酸盐减少,使最终产生的紫红颜色变浅,通过分光光度计在550nm波长处测定加入SOD样品管及未加SOD对照管中吸光度的变化来计算SOD的活性。显然,加入的SOD越多其活性越高,颜色变化越显著[11-12]。
将动植物组织提取液装入截留相对分子质量为12000的透析袋中,用去离子水4℃透析4h,以除去提取液中小分子干扰物质[13-14]。取出透析袋中样品,准确测量体积。等量取透析后的样品两份,其中一份作为样品加入到反应体系中直接用黄嘌呤氧化酶法测定其SOD活力值,另一份于80℃水浴中加热5min后作为变性样品空白加入到反应体系中测其所含SOD活力值。用样品管活力测定值减去变性样品空白管活力测定值即可扣除样品中大分子物质的干扰,其结果才是该样品所含SOD所具有的真正酶活力。具体操作见表1。
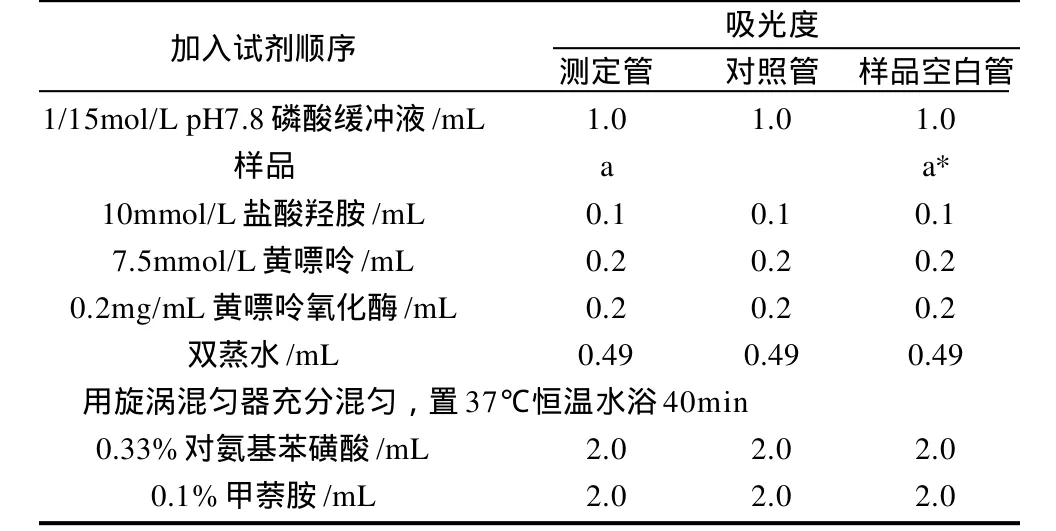
表1 改良的黄嘌呤氧化酶法操作步骤Table 1 Experimental procedures of improved xanthine oxidase method
1.2.2 指标的计算
1.2.2.1 对于液体样品

SOD样品真实比活力值/(U/mL)= SOD样品比活力值-SOD样品空白比活力值
1.2.2.2 对于固体样品

SOD样品真实比活力值/(U/g)= SOD样品比活力值-SOD样品空白比活力值
2 结果与分析
2.1 加热对SOD圆二色光谱的影响
通过圆二色光谱仪检测SOD标准品在不同温度下的结构变化,寻找SOD变性的最低温度条件。根据圆二色光谱仪对样品浓度要求,配制120μg/mL的SOD标准品溶液,对该溶液在25、70℃和80℃条件下作用5min进行光谱检测,结果如图1所示。
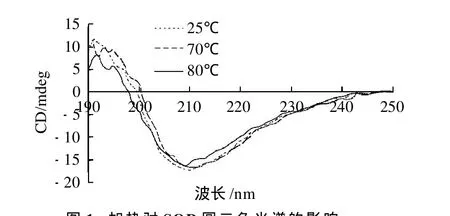
图1 加热对SOD圆二色光谱的影响Fig.1 Effect of heating on circular dichroism spectrum of SOD
从图1可以看出,70℃与未加热SOD曲线在210~220nm之间有变化但不显著,说明此时SOD已经有部分变性但不完全,而80℃在210~220nm处明显上移,说明其结构发生了较大变化(变性)。因此80℃加热5min为SOD明显变性的最低温度条件。
2.2 加热对SOD活力的影响
根据图1 SOD 变性光谱,配制15μg/mL的SOD标准溶液,分别于70、80、90℃和100℃水浴5min后各取50μL加入到黄嘌呤反应体系中,与未加热同浓度SOD标准溶液比较活力值见表2。

表2 SOD加热后在黄嘌呤反应体系中测出的酶活力(n=5)Table 2 SOD activity measured in xanthine oxides reaction system after heating (n=5)
从表2可以看出,70℃水浴5min测得的SOD活力还比较高,说明此时SOD尚未完全失活。从80~100℃虽然仍然能够测出SOD活性,但其数值比70℃水浴5min明显下降。且80、90、100℃所测出的SOD活力值并没有显著差异。结合图1可知,由于此时SOD已经变性,因此所测出的“活力值”实际上并不是酶的催化作用,而是SOD肽链与自由基作用的结果[15-16]。因此80℃水浴5min为SOD失活的最低温度条件,在此条件下SOD已经变性失活,此时采用黄嘌呤反应体系,其产生的自由基与变性后的蛋白质肽链仍然能够反应,此时所测定的“活力”并不是真正的酶活性。正因为如此,可以设计加热变性样品空白,以便消除非酶干扰。2.3 80℃加热5min对血清中SOD活性的影响
为了观察血清中的SOD在80℃加热5min的实验条件下是否也变性失活,以大鼠血清作为测试样品,配制10、20μg/mL和30μg/mL的SOD标准溶液。取血清20μL,各质量浓度SOD标准溶液20μL,混合共40μL加入到黄嘌呤氧化酶反应体系中,血清与3种不同质量浓度SOD标准溶液混合物分别在常温(25℃)与80℃保温5min条件下进行实验,以判断血清中的SOD在80℃加热5min的实验条件下是否也变性失活。

表3 80℃加热5min对血清中SOD活性的影响(n=5)Table 3 Effect of heating at 80 ℃ for 5 min on serum SOD activity(n=5)
由表3可以看出,将不同质量浓度的SOD标准溶液加入到血清中,在25℃条件下,随着血清中标准SOD量的增加,检测出的比活力值基本呈线性增加。而在80℃加热5min的实验条件下测出的比活力值并不随血清中标准SOD量的增加而显著增加,且“活力值”也远低于25℃实验条件的测定结果,说明80℃保温5min可以让血清中的SOD变性失活。
2.4 加热对血清中主要干扰物质的影响
从2.2节可知,80℃水浴5min为SOD失活的最低温度条件,在此条件下SOD已经变性失活,但作为样品空白则需要样品中的干扰物质在此实验条件下对黄嘌呤反应体系的干扰不发生变化。为此进一步考察加热对血清中主要干扰物质的影响。选择血清中含量较高且对黄嘌呤反应体系有严重干扰的白蛋白、总蛋白、甘油三酯、葡萄糖和谷胱甘肽进行加热实验,观察80℃水浴5min对这些干扰物的影响,结果见表4。

表4 黄嘌呤氧化酶法测出的5种物质SOD比活力(n=5)Table 4 Specific activities of SOD in 5 substances detected by xanthine oxidase method (n=5)
由表4可知,白蛋白、总蛋白、甘油三酯、葡萄糖和谷胱甘肽在加热后与未加热加入到黄嘌呤氧化酶反应体系中所测定出的SOD比活性变化不大。因此证实可以将80℃水浴加热5min作为制备样品空白的实验条件。之所以寻找最低变性温度是防止温度过高对那些干扰物质发生作用。而上述结果证明在80℃水浴5min的条件下血清中主要干扰物质对SOD检测体系的影响与不加热没有很大区别,因此可以作为样品空白。
用不加热的样品管测定值减去加热样品管的测定值就能够将血清中主要干扰物质的影响扣除掉。而像VC这类小分子物质则在实验一开始就已经通过透析的方法除去了。
2.5 加样顺序对样品中主要干扰物质的影响
能否采用改变加样顺序的方法制备样品空白进行以下实验:取等量白蛋白(4.0g/dL)、总蛋白(7.0g/dL)、甘油三酯(2.26mmol/L)、葡萄糖(5.55mmol/L)和谷胱甘肽(40mg/L)混合,取20μL混合液分别在黄嘌呤氧化酶法水浴前(酶作用前)和水浴后(酶作用后)加入到反应体系中,结果见表5。

表5 改变干扰物的加样顺序测出的SOD活力值(n=5)Table 5 SOD activity detected under the changed addition order of interferences (n=5)
从表5可以看出,在恒温水浴40min后(酶反应后)加入干扰物所测出的SOD活力值比水浴前(酶反应前)明显降低。说明干扰物质在黄嘌呤氧化酶反应体系中作用的时间与生成的颜色有关,因此不能设计采用改变加样顺序的样品空白。
2.6 两种方法准确性比较
取白蛋白(4.0g/dL)、总蛋白(7.0g/dL)、甘油三酯(2.26mmol/L)、葡萄糖(5.55mmol/L)和谷胱甘肽(40mg/L)各200μL混合作为样品中的干扰物质,然后加入1mL 15μg/mL的SOD标准溶液,将该混合物分为两份,一份用改良法测定样品所含SOD比活力值,另一份用不经改良的原方法测定样品SOD比活力值。同时测定未加干扰物同一浓度SOD标准溶液的比活力值,结果见表6。
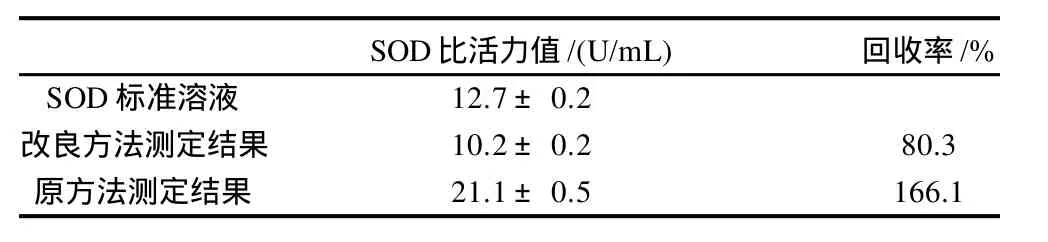
表6 两种方法准确性比较(n=5)Table 6 Comparison of the accuracy determined by two methods (n=5)
从表6可知,改良的方法能够通过制备样品空白扣除样品中杂质的干扰,其检测结果比原方法准确得多。
2.7 两种方法测定大鼠血清SOD活力的比较
取大鼠血清30μL分别用改良法和不经改良的原方法测定样品所含SOD比活力值,结果见表7。

表7 两种方法测定大鼠血清SOD比活力结果比较(n=5)Table 7 Comparison of serum SOD specific activities in rats determined by two methods (n=5)
从表7结果可以看出,由于原方法没有将大鼠血清中干扰物质扣除掉因此测定结果比改良后的方法高了38%。
2.8 两种方法测定大鼠肝脏SOD活力的比较
取大鼠肝脏,匀浆,分别取离心后的匀浆液20μL用改良法和不经改良的原方法测定样品所含SOD比活力值,结果见表8。

表8 两种方法测定大鼠肝脏SOD比活力结果比较(n=5)Table 8 Comparison of SOD specific activities in rat liver tissues determined by two methods (n=5)
从表8可以看出,由于原方法没有将大鼠肝脏中干扰物质扣除掉因此测定结果比改良后的方法高了45%。
2.9 两种方法测定香蕉中SOD活力的比较
取一定量香蕉加水匀浆,分别取离心后的匀浆液用改良法和不经改良的原方法测定样品所含SOD比活力值,结果见表9。

表9 两种方法测定香蕉中SOD比活力结果比较(n=5)Table 9 Comparison of SOD specific activities in banana determined by two methods (n=5)
从表9可以看出,由于原方法没有将香蕉中干扰物质扣除掉因此测定结果比改良后的方法高了35倍。
3 讨 论
3.1 SOD经过80℃、5min的加热后,结构有明显变化。由于SOD分子较小,其结构的改变对功能的影响很大。结合不同温度对SOD活性影响的实验结果可以看到,当加热温度从80℃再向上升高,测出的SOD比活力值基本不变,因此可以认为SOD经过80℃、5min的加热后基本失去催化功能。所以用80℃、5min 作为让样品中SOD变性失活的最低温度条件。且80℃加热5min能够让血清中的SOD变性失活。
3.2 80℃、5min的实验条件对血清中主要物质白蛋白、总蛋白、甘油三酯、葡萄糖和谷胱甘肽在黄嘌呤氧化酶反应系统中的干扰作用没有影响,而SOD在该条件下则会变性失活。所以可以通过加热制作一个样品空白,用不加热的样品测得的SOD比活力值减去样品空白,即可扣除样品中杂质的干扰,使得到的SOD活力值更接近样品中SOD的真实活力值。
3.3 通过两种方法准确度比较实验可以看出,改良方法虽然可以达到去除干扰的目的,但采用这种扣除样品空白的方法还是会有一定误差。不过对于现有方法来说,已经能使测定的结果更接近样品所含SOD真实活性。通过对大鼠血清、肝脏和香蕉的SOD活力测定,可以看到样品空白测得的SOD比活力还是相当大的,所以说本方法对于去除干扰物质对黄嘌呤反应体系的影响是有效的而可行的。
[1] 蔡敬杰, 樊志. 超氧化物歧化酶的研究进展[J]. 天津化工, 1997(2):2-4.
[2] 时沁峰, 曹威荣. 超氧化物歧化酶(SOD)的研究概况[J]. 畜禽业, 2009(4): 66-68.
[3] 曹淑华, 查向东. 超氧化物歧化酶研究综述[J]. 安徽农业科学, 2003,31(4): 599-601.
[4] PERRY J J P, SHIN D S, GETZOFF E D, et al. The structural biochemistry of the superoxide dismutases[J]. Biochimica et Biophysica Acta (BBA) - Proteins & Proteomics, 2010, 1804(2): 245-262.
[5] 李革新, 皮静波, 郑全美, 等. 三种SOD测定方法的比较[J]. 中国卫生检验杂志, 1999, 6(5): 273-274.
[6] 冯优, 滕莉, 王凤山. 超氧化物歧化酶的研究进展[J]. 食品与药品,2006(2): 5-8.
[7] PARK C K, LEE J H, CHEONG H T, et al. Effect of superoxide dismutase (SOD) on pronucleus formation of porcine oocytes fertilizedin vitro[J]. Theriogenology, 1997, 48(7): 1137-1146.
[8] 桂兴芬, 杨萍, 刘隽, 等. 饮品中超氧化物歧化酶的活性及影响因素[J]. 郑州工程学院学报, 2000, 21(4): 67-68.
[9] 姜云, 茅力, 蔡云清. 果蔬中超氧化物歧化酶的提纯与测活技术研究进展[J]. 食品科学, 2008, 29(12): 780-785.
[10] 赵建, 李想, 鲁政, 等. 影响超氧化物歧化酶活性测定的因素[J]. 食品科学, 2010, 31(9): 216-218.
[11] 张凤翔. 黄嘌呤氧化酶法测定血清中超氧化物歧化酶活力的影响因素[J]. 云南医药, 2001, 22(6): 473-474.
[12] 王珉, 李洪, 朱红枫. 改良的黄嘌呤氧化酶-羟胺法检测血清SOD活性[J]. 川北医学院学报, 2003(2): 92-93.
[13] 张晓燕, 朱乐敏. 植物食品中SOD的测定[J]. 食品科技, 2006(10):254-256.
[14] 孙永君. 大蒜中SOD的提取研究[J]. 化学与生物工程, 2005(10): 23-25.
[15] DUTTA S, PADHYE S, MCKEE V. Structural characterization and SOD activity of copper-oxaprozinate[J]. Free Radical Biology and Medicine, 2004, 7(9): 1071-1074.
[16] DEMICHELI V, QUIJANO C, ALVAREZ B, et al. Inactivation and nitration of human superoxide dismutase (SOD) by fluxes of nitric oxide and superoxide[J]. Free Radical Biology and Medicine, 2007, 42(9):1359-1368.
Determination of SOD Specific Activity in Animal and Plant Tissues by Improved Xanthine Oxidase Method
XU Dong,ZHAO Jian,HUANG Han-chang,WEN Jing*
(Beijing Key Laboratory of Bioactive Substances and Functional Foods, Beijing Union University, Beijing 100191, China)
In order to minimize the interference in xanthine oxidase method for the determination of superoxide dismutase (SOD)activity in animal and plant tissues, the xanthine oxidase method was modified. The optimal experimental conditions for preparing bank samples were explored by measuring the activity and circular dichroism spectrum of SOD. A heated sample was designed as the experimental blank. Subtraction rule was used to eliminate the interference of other substances in xanthine oxidase system. Standard addition recovery experiments and actual determination of SOD activity in animal and plant tissues were used to compare the method with and without modification. Results indicated that the improved xanthine oxidase method could result in more accurate determination of SOD activity in animal and plant tissues.
xanthine oxidase method;sample blank;SOD activity determination
TS207.3
A
1002-6630(2011)06-0237-05
2010-04-19
北京市教委重点实验室引导基金项目(21202543503)
徐东(1985—),男,助理工程师,学士,主要从事保健食品功能评价研究。E-mail:xudong7879@sohu.com
*通信作者:文镜(1952—),男,教授,学士,主要从事保健食品功能学评价机理和方法学研究。E-mail:wenjing@ygi.edu.cn
