快速分离液相-四级杆飞行时间串联质谱分析大豆中的异黄酮成分
2011-10-13郑振佳初玉圣迟炳海
郑振佳,初玉圣,迟炳海,王 晓,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.山东省分析测试中心,山东 济南 250014;3.山东龙大食品集团有限公司,山东 烟台 265231)
快速分离液相-四级杆飞行时间串联质谱分析大豆中的异黄酮成分
郑振佳1,2,初玉圣3,迟炳海3,王 晓1,2,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.山东省分析测试中心,山东 济南 250014;3.山东龙大食品集团有限公司,山东 烟台 265231)
建立快速分离液相-四级杆飞行时间串联质谱(RRLC-Q-TOF)联用技术分析大豆中的异黄酮的方法。大豆样品经甲醇超声辅助提取后,选用Welch Materials C18柱,以乙腈-水(含0.1%甲酸)为流动相进行梯度洗脱。结果表明在正离子模式下,经快速分离液相-四级杆飞行时间串联质谱分离并检测出9种异黄酮成分。RRLC-Q-TOF联用技术可以快速准确鉴定样品中的异黄酮成分。
快速分离液相-四级杆飞行时间串联质谱(RRLC-Q-TOF);大豆;异黄酮
大豆异黄酮是大豆中的重要生理活性物质,以大豆异黄酮为活性成分的保健食品和功能食品逐渐为人们所接受[1-2]。研究证明:大豆异黄酮有预防癌症、防止骨质疏松、防止心血管疾病、抗炎、抗菌、抗衰老、抗氧化以及防止酒精中毒等生理活性,日本已将大豆异黄酮添加于食品中做为食品营养剂来使用[3-4]。目前发现的大豆异黄酮共有12种,分为游离型的苷元及其相应的糖苷[5]。大豆异黄酮的检测方法多采用紫外分光光度法(UV)、高效液相色谱法(HPLC)、高效液相色谱-质谱联用方法(HPLC-MS)等[6-9],分析过程依赖对照品且灵敏度不高,快速鉴定效果不理想。
高分辨率飞行时间质谱具有高分辨率,能够不降低灵敏度而测定化合物的精确分子质量[10-11],对分子质量数相差10-6的不同分子进行有效区分,与液相色谱联用是分析植物活性成分的有效方式,在天然产物分析方面越来越受到重视[12-13]。
本实验采用快速分离液相-四级杆飞行时间串联质谱联用技术,利用分子离子的精确质量数,无需对照品,快速分析鉴定大豆中的异黄酮,旨在为快速评价大豆及其制品的品质提供参考。
1 材料与方法
1.1 材料、试剂与仪器
大豆(粉碎至60目) 千佛山农贸市场;Welch Materials C18色谱柱(250mm×4.6mm,5μm)美国Welch Materials公司。乙腈(色谱纯);甲醇(分析纯);实验用水为去离子超纯水。6520四极杆-飞行时间串联液质联用仪 美国安捷伦公司。
1.2 样品制备
精密称取大豆粉末1.0g,放入50mL具塞试管中,加入10mL甲醇,室温超声提取15min,取上清液,过0.22μm滤膜,作供试样品。
1.3 液质联用分析方法
1.3.1 色谱条件
色谱柱:Welch Materials C18;流动相:A为乙腈,B为0.1%甲酸溶液,流动相梯度组成如表1所示;流速:1mL/min;进样量:20μL;柱温:30℃;检测波长:260nm。
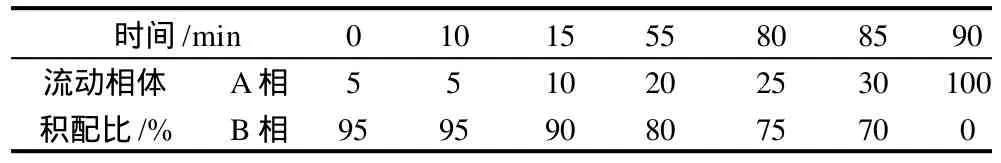
表1 线性梯度洗脱表Table 1 Linear gradient elution of tetracyclines
1.3.2 质谱条件
离子源ESI,四极杆温度100℃,雾化压力50psi,碎裂电压175V,干燥器温度350℃,干燥气流量10L,毛细管电压4000V,正离子模式扫描,扫描范围m/z100~1000。
2 结果与分析
2.1 Q-TOF条件优化
本实验分别采用正、负两种离子模式进行质谱分析,优化最佳分析条件以获得最佳灵敏度。实验表明,正离子模式比负离子模式更加灵敏,因此本实验采用正离子模式进行检测。同时发现流动相中加入适当甲酸更利于增强质谱信号,从而提高灵敏度,考虑到酸性太强会对色谱柱有所损害,因此选择在水中添加0.1%甲酸。
2.2 大豆中异黄酮成分的分析

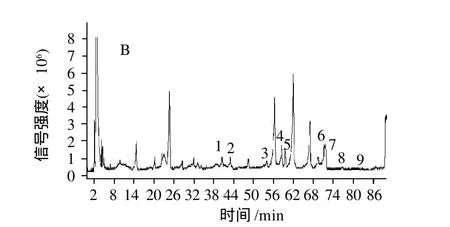
图1 大豆提取液的色相色谱图(A)和总离子流图(B)Fig.1 Rapid resolution liquid chromatogram (A) and total ion chromatogram (B) of soybean extract
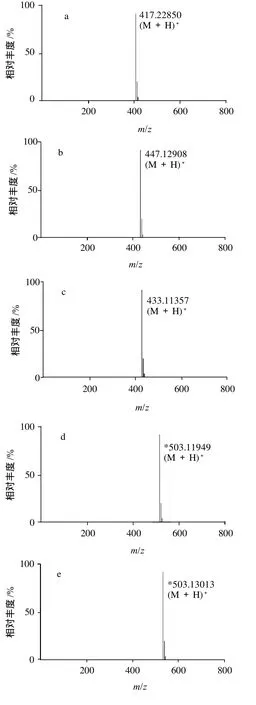

图2 异黄酮的质谱图Fig.2 Mass spectra of soybean extract
经四极杆-飞行时间串联液质联用仪分析,大豆提取物的液相色谱图和总离子流图见图1。
本实验所采用的高分辨率飞行时间质谱能够得到待测组分的分子离子峰及其精确相对分子质量,根据得到化合物的精确相对分子质量,参考相关文献,对各化合物进行鉴别。根据图2由文献推断大豆异黄酮的成分如下:
峰1(图2a)获得m/z417.22850[M+H]+质谱信号,峰2(图2b)获得m/z447.12908[M+H]+质谱信号,峰3(图2c)获得m/z433.11357[M+H]+质谱信号,峰7(图2g)获得m/z271.06014[M+H]+质谱信号,峰8(图2h)获得m/z255.06551[M+H]+质谱信号,峰9(图2i)获得m/z285.07611[M+H]+质谱信号,根据文献[15]推断其分别为大豆苷(C21H20O9)、黄豆黄苷(C22H22O10)、染料木苷(C21H20O10)、染料木素(C15H10O5)、大豆甙元(C15H10O4)和黄豆黄素(C16H12O5)。
峰4(图2d)获得m/z503.11949[M+H]+质谱信号,峰5(图2e)获得m/z533.13013[M+H]+质谱信号,峰6(图2f)获得m/z519.11411[M+H]+质谱信号,根据文献[14]推断其分别为丙二酰化大豆苷(C24H22O12)、丙二酰化黄豆黄苷(C25H24O13)和丙二酰化染料木苷(C24H22O13)。
大豆中的异黄酮成分液相保留时间、质谱分子离子峰、相对分子质量实验测定值和理论值如表2所示,通过比较可以看出相对分子质量实验测定值和理论值相差很小。
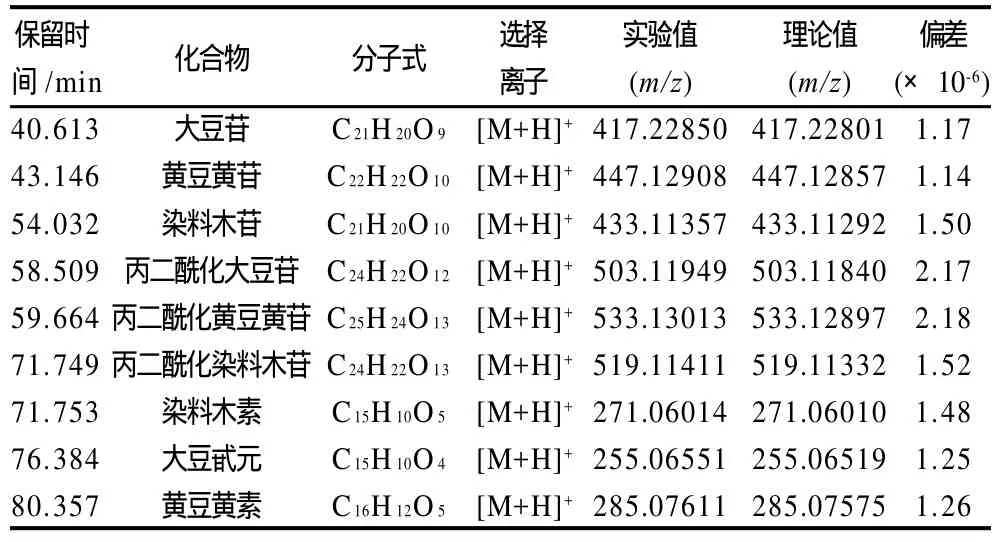
表2 大豆提取液中异黄酮的RRLC-Q-TOF分析Table 2 RRLC-Q-TOF analysis of isoflavonoids in soybean extract
3 结 论
本实验采用快速分离液相-四级杆串联飞行时间质谱联用技术,利用分子离子的精确质量数,无需对照品,快速分析鉴定大豆中的异黄酮,对大豆的质量控制、提取物指纹图谱的建立及不同大豆品质差异的分析检测具有重要意义。所建方法对植物中黄酮类物质的分析检测提供了新的参考依据,对天然产物有效成分的定性分析具有重要的意义。
[1] 李鹏, 李晓磊, 高长城. 大豆异黄酮生理功能的研究进展[J]. 长春大学学报, 2009, 19(10): 58-60.
[2] 黄文宇, 柳陈坚, 李海燕. 传统大豆发酵食品中大豆异黄酮的生理保健机能的研究进展[J]. 中国微生态学杂志, 2009, 21(10): 949-952.
[3] 张艳舫, 王晶, 傅博强. 保健食品中大豆异黄酮含量的高效液相色谱法测定[J]. 食品科技, 2008(8): 191-196.
[4] ZUBIK L, MEYDANI M. Bioavailability of soybean isoflavones from aglycone and glucoside foems in American women[J]. American J Clinical Nutrition, 2003, 77(6): 1459-1465.
[5] 金米聪, 龚文杰, 马建明. 大豆及其制品中 12种大豆异黄酮的HPLC及HPLC-MS法测定研究[J]. 中国卫生检验杂志, 2005, 15(8): 900-903.
[6] 高荣海, 李长彪, 孟宪文, 等. 大豆异黄酮分离及其检测方法的研究进展[J]. 中国调味品, 2006(7): 4-8.
[7] 胡晓娟, 苏惠. 保健品原料中大豆异黄酮的HPLC法测定[J]. 光谱实验室, 2007, 24(2): 268-270.
[8] MITANI K, NARIMATSU S, KATAOKA H. Determination of daidzein and genistein in soybean foods by automated on-line in-tube solid-phase microextraction coupled to high performance liquid chromatography[J].J Chromatography A, 2003, 986(2): 169-177.
[9] WU Qingli, WANG Mingfu, SIMON J E. Determination of isoflavones in red clover and related species by high-performance liquid chromatography combined with ultraviolet and mass spectrometric detection[J]. J Chromatogr A, 2003, 1016(2): 195-209.
[10] 李文龙, 陈军辉, 殷月芬, 等. 加速溶剂提取-高效液相色谱-电喷雾飞行时间质谱联用分析莲子心中生物碱[J]. 分析化学, 2008, 36(1): 79-82.
[11] 韩超, 陈军辉, 刘劼, 等. 高效液相色谱-电喷雾飞行时间质谱分析太子参中环肽类化合物[J]. 分析化学, 2006, 34(12): 1719-1722.
[12] 叶茂, 谢国祥, 赵爱华, 等. 超高效液相色谱-飞行时间质谱法测定苦参素注射液中苦参碱和氧化苦参碱[J]. 中国中药杂志, 2008, 32(12): 1390-1401.
[13] 何忠梅, 孙佳明, 张辉, 等. 固相萃取-高效液相色谱-电喷雾串联质谱法分析芍药和酒芍药的水溶性化学成分[J]. 分析化学, 2009, 37(8): 1021-1025.
[14] DU Qizhen, LI Zhonghua, ITO Y. Preparative separation of isoflavone components in soybeans using high-speed counter-current chromatography[J]. J Chromatogr A, 2001, 923(1/2): 271-274.
[15] YANG Fuquan, MA Ying, ITO Y. Separation and purification of isoflavones from acrude soybean extract by high-speed counter-current chromatography[J]. J Chromatogr A, 2001, 928(2): 163-170.
Analysis of Isoflavonoids in Soybean by Rapid Resolution Liquid Chromatography-Quatrupole-Time of Flight Mass Spectrometry
ZHENG Zhen-jia1,2,CHU Yu-sheng3,CHI Bing-hai3,WANG Xiao1,2,*
(1. College of Food Science and Engineering, Shandong Agricultural University, Taian 271018, China;2. Shandong Analysis and Test Center, Shandong Academy of Sciences, Jinan 250014, China;3. Shandong Longda Foodstuff Group Co. Ltd., Yantai 265231, China)
A novel method for the analysis of isoflavonoids in soybean was established by rapid resolution liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry (RRLC-Q-TOF-MS). Samples were extracted with methanol under ultrasound assistance, and then a Welch Materials C18 column was applied in the RRLC separation using acetonitrile and water (0.1% formic acid) as the mobile phase. Elutes were detected by Q-TOF to obtain MS spectra with a positive ion mode.Nine isoflavonoids were identified. Therefore, this method can be used to rapidly determine isoflavonoids of soybean.
RRLC-Q-TOF;soybean;isoflavonoids
O657.63
A
1002-6630(2011)06-0233-04
2010-04-29
国家自然科学基金项目(20872083);山东省科技攻关项目(2009GG2001021-16);
作物生物学国家重点实验室开放课题(20082KF05)
郑振佳(1985—),男,硕士研究生,研究方向为天然产物分离纯化与活性。E-mail:pengyou-jia@163.com
*通信作者:王晓(1971—),男,研究员,博士,研究方向为天然产物分离纯化与活性。E-mail:wangx@keylab.net
