蔬菜中1 1种有机磷农药残留的气相色谱检测及其对蔬菜基质的影响
2011-10-13风华亮李晓凤
吴 晖,朱 珍,风华亮,李晓凤*
(华南理工大学轻工与食品学院,广东 广州 510640)
蔬菜中1 1种有机磷农药残留的气相色谱检测及其对蔬菜基质的影响
吴 晖,朱 珍,风华亮,李晓凤*
(华南理工大学轻工与食品学院,广东 广州 510640)
建立蔬菜中11种农药多残留的气相色谱分析方法。对NY/T 761—2008《蔬菜和水果中有机磷、有机氮、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》标准的蔬菜前处理方法进行改进,并探讨蔬菜基质对检测的影响。使用DB-17毛细管柱分离,FPD检测器进行检测。结果显示:11种有机磷农药分离效果好,在黄瓜、西红柿、生姜中的3个添加水平,回收率为71.2%~117.9%,相对标准偏差(RSD)为2.1%~11.2%,最低检出限为0.005~0.060mg/kg,保留时间为6.396~19.400min。在各自线性范围内线性关系好(r>0.999);使用40℃加热氮吹浓缩,可分别提高敌敌畏、甲拌磷回收率至95.00%和103.30%;在被测的13种蔬菜中,甘蓝、娃娃菜、上海青有少量杂峰影响农药检出;韭菜有大量的基质峰干扰农药检出。
气相色谱(GC);有机磷农药残留;蔬菜;基质
我国农药使用量居世界首位[1],而相对地,我国农药品种单一,剧毒、高毒农药品种居多,存在着“3个70%”,即农药中杀虫剂占70%;杀虫剂中有机磷类品种占70%;有机磷类中少数几个高毒品种占70%[2]。蔬菜是人们日常生活中必不可少的食品,也是农药污染较为严重的食品之一。其农药残留检测越来越受到人们的重视[3-6]。2008年,我国农业部发布了标准NY/T 761—2008《蔬菜和水果中有机磷、有机氮、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》。此标准前处理方法简单、快捷和经济等优点,适用于基层检测单位推广使用,但存在净化过程中氮吹温度高,存在过程难控制,敌敌畏、甲拌磷等易挥发农药回收率低的问题[7]。同时此标准中需将待测样用双自动进样器同时注入气相色谱仪的两个进样口,农药组分经不同极性的两根毛细管柱分离,火焰光度检测器(FPD磷滤光片)检测。此方法对气相色谱的要求高,需要双柱气相色谱设备[8],且54种农药需分5组分别进行检测,大多数基层检测部门不具有此条件。本研究尝试通过改变前处理中的净化条件以提高敌敌畏、甲拌磷等易挥发物质的回收率,通过改变该方法的气相色谱分析条件,达到单柱法同时检测蔬菜中11种常用有机磷农药的目的,并利用该方法对各种蔬菜中有机磷农药残留量进行检测,以分析本检测条件与NY/T 761—2008《蔬菜和水果中有机磷、有机氮、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》前处理结合检测的基质适应性。
1 材料与方法
1.1 材料与试剂
娃娃菜、上海青、黄瓜等13种蔬菜均购于广州市天河区。
乙腈(色谱纯)、丙酮(AR重蒸) 天津市科密欧公司;氯化钠(AR) 上海瑞泉公司;敌敌畏(dichlorovos)、甲胺磷(methamidophos)、甲拌磷(phorate)、甲基对硫磷(methyl parathion)、乐果(dimethoate)、氧乐果(o m e t h o a t e)、内吸磷(d e m e t o n)、久效磷(monocrotophos)、乙酰甲胺磷(acephate)、马拉氧磷(malaoxon)、水胺硫磷(isocarbophos)标准品 农业部环境保护科研监测所;马拉氧磷质量浓度为20μg/mL,其余均为100μg/mL。
1.2 仪器与设备
SHIMADZU GC-2014气相色谱仪[配FPD火焰光度检测器(磷滤光片)和AOC-20i自动进样器] 日本岛津公司;6890N /5975气质连用仪(配7683B自动进样器)、DB-17色谱柱(30m×0.32mm,0.25μm)、DB-23色谱柱(30m×0.25mm,0.25μm) 美国Agilent公司;N-EVAP111氮吹仪 美国Organomation公司;AC-1色谱柱(30m×0.25mm,0.25μm) 澳大利亚SGE公司;MX-PSC101G1榨汁机 日本松下公司;FJ-200高速分散均质机 上海标本模型厂;WH-90A微型漩涡混合器 上海振荣科学仪器有限公司。
1.3 方法
1.3.1 气相色谱分析条件
1.3.1.1 11种有机磷农药分离色谱分析条件
进样口温度:2 40℃,不分流进样。升温程序:50℃以20℃/min速度升温至120℃,再以10℃/min速度升温至180℃后保留4min,再以10℃/min速度升温至240℃并且保留1 m i n。检测器温度:2 5 0℃,进样量:1.00μL。载气:氮气。柱流量:4.13mL/min,总流量:10mL/min。毛细管柱:DB-17(30m×0.32mm,0.25μm)。
1.3.1.2 基质峰影响验证色谱分析条件
Ⅰ:进样口温度:2 3 0℃,升温程序:5 0℃以8℃/min速度升温至250℃,保留5min。其他同1.3.1.1节方法。
Ⅱ:进样口温度:2 3 0℃,升温程序:5 0℃以25℃/min速度升温至125℃,再以10℃/min上升至300℃后保留10min。其他同1.3.1.1节方法。
Ⅲ:分流比:1:5 毛细管柱:AC-1(30m×0.25mm,0.25μm)其他同1.3.1.1节。
1.3.2 GC-MS分析条件
进样口温度 250℃;升温程序:50℃以20℃/min速度升温至120℃,以10℃/min速度升温至180℃并保留1min,再以10℃/min速度升温至210℃并保留5min;接口温度270℃;EI温度 230℃;柱流量1mL/min; 不分流; 进样量1.00μL; 溶剂切除时间3min;SIM模式;色谱柱DB-23(30m×0.25mm,0.25μm)。
1.3.3 样品提取[9]
准确称取粉碎的待测样25.0g放入匀浆机中,加入50.0mL乙腈,在匀浆机中高速匀浆2min后用滤纸过滤,滤液收集到装有5~7g氯化钠的100mL具塞量筒中,收集滤液40~50mL,盖上塞子,剧烈振荡1min,室温静置30min,使乙腈相和水相分层。
1.3.4 净化
从具塞量筒中吸取5.00mL,放入150mL烧杯中,将烧杯放在40℃水浴锅上加热,杯内缓缓通入氮气,蒸发近干,加入1.0mL丙酮,盖上铝箔,备用。将上述备用液完全转移至10mL刻度离心管中,再用约1.5mL丙酮分3次冲洗烧杯,并转移至离心管,最后定容至2.5mL。在漩涡混合器上混匀,移入自动进样器样品瓶,供色谱测定。
2 结果与分析
2.1 11种有机磷农药混合标准液色谱分离
将各农药标准品分别用丙酮稀释成10μg/mL(马拉氧磷为2μg/mL)的单一标准液,在同一色谱分析条件下确定各自的保留时间,采用1.3.1.1节方法进行气相色谱分析。气相分离效果如图1A所示,11种有机磷农药能在此条件下完全分离,其中敌敌畏和甲胺磷得到了很好的分离,而在NY/T 761—2008《蔬菜和水果中有机磷、有机氮、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》中敌敌畏和甲胺磷被分在两个组进行测定,在同一个条件下难以分离,特别是DB-1柱对这两种农药的分离效果更加不理想,本实验尝试用AC-1柱将敌敌畏和甲胺磷分离(图1B),分离效果不理想。DB-17为中等极性柱,对有机磷农药的分离效果较好。而DB-1柱和AC-1柱为非极性柱,对敌敌畏和甲胺磷分离能力弱。
通过改变升温程序,发现采用50℃开始升温,升温时间共21.5min的程序,可将溶剂以及样品中大部分干扰物先通过色谱柱形成色谱峰,避免杂质对样品峰的影响。图1A中2、5、8号峰均存在内吸磷标准液。2、5号峰可能是治螟磷[10]和异内吸磷[11]。治螟磷与内吸磷有相似官能团,内吸磷与其异构体异内吸磷在一定条件下能相互转化。本实验以8号峰作为内吸磷的定量峰。
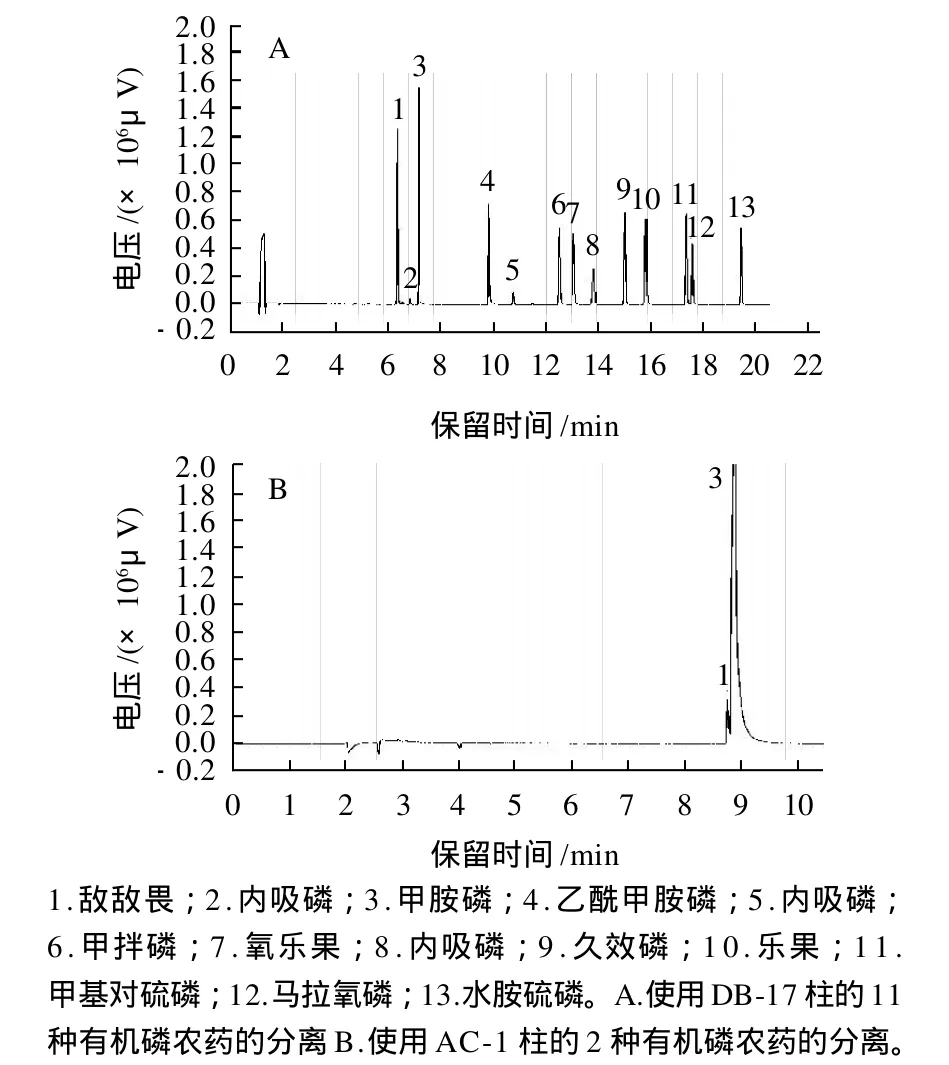
图1 11种有机磷农药混合色谱分离效果图及1柱的分离效果图Fig.1 Gas chromatogram of 11 organophosphorus pesticides on DB-17 column and gas chromatogram of 2 organophosphorus pesticides on AC-1 column
2.2 氮吹温度对敌敌畏、甲拌磷回收率的影响
在检测的11种农药中,敌敌畏和甲拌磷是挥发性较强的物质[12]。敌敌畏蒸汽压为1.5998Pa(20℃);甲拌磷蒸汽压为0.112Pa(20℃),相比之下氧乐果蒸汽压为3.333×10-3Pa(20℃);乙酰甲胺磷蒸汽压为2.266×10-4Pa(24℃)。NY/T 761—2008《蔬菜和水果中有机磷、有机氮、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》使用80℃高温下的氮吹浓缩,操作难控制,易使敌敌畏和甲拌磷挥发损失。使用较低的蒸发温度可以减少两者的挥发,提高回收率。另外NY/T 761—2008《蔬菜和水果中有机磷、有机氮、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》的浓缩方法为:吸取10mL乙腈溶液氮吹,浓缩至5mL。为了节约时间,降低成本,可将浓缩用量减半。以西红柿作为基质,10mL乙腈溶液80℃氮吹后加入一定量的标准液定容至5mL溶液作为对照,对80、60、40℃条件下氮吹进回收率的对比。如表1所示,随着氮吹温度的降低,敌敌畏和甲拌磷的回收率明显提高,但氮吹时间较长。为了降低氮吹过程中温度对回收率的影响,使用40℃氮吹,同时浓缩用量减半。以下实验均使用此改进的前处理方法。
2.3 不同基质对检测效果的影响
不同蔬菜含有的成分可能会在气相分析时产生背景峰,从而对样品峰形成干扰,因此,针对不同蔬菜进行个别分析,了解本方法的适用范围。本实验选取了黄瓜、青椒、萝卜、茄子、苦瓜、娃娃菜、上海青、韭菜、胡萝卜、西红柿、生姜、包菜、生菜13种常见蔬菜进行检测。大部分蔬菜的背景峰都出现在升温程序的初始阶段,不影响11种农药残留的检测,特别的如生姜、茄子和青椒,在此条件下没有任何杂峰。
通过多次检测发现甘蓝中存在影响乙酰甲胺磷的杂峰(图2),通过两种不同的升温程序方法(1.3.1.2节 A和B)对甘蓝基质和乙酰甲胺磷标准品进行对比。图3A~3D,通过气相色谱检测发现此峰与乙酰甲胺磷峰的保留时间仍然一致。为了避免假阳性结果的出现,使用双柱法和GC-MS的方法进行验证,使用AC-1柱和1.3.1.2节Ⅲ方法未出现干扰乙酰甲胺磷的杂峰(图3E、3F)。用GC-MS做进一步验证,选择乙酰甲胺磷的特征离子(m/z94、136、42),对甘蓝样品进行SIM模式检测,以检出物中碎片离子的种类和丰度比作为依据。未发现存在与乙酰甲胺磷特征离子匹配度高的离子。因此判断此干扰峰为基质峰。本检测结果与吴岩等[13]的报道一致。
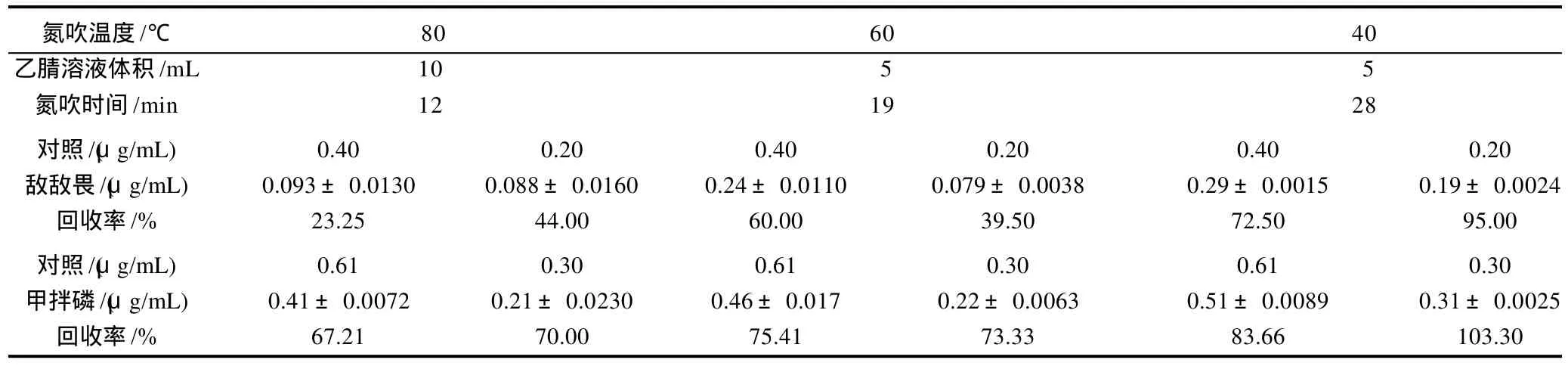
表1 氮吹温度对敌敌畏、甲拌磷回收率的影响Table 1 Effect of N2 temperature on recovery rates of dichlorovos and phorate
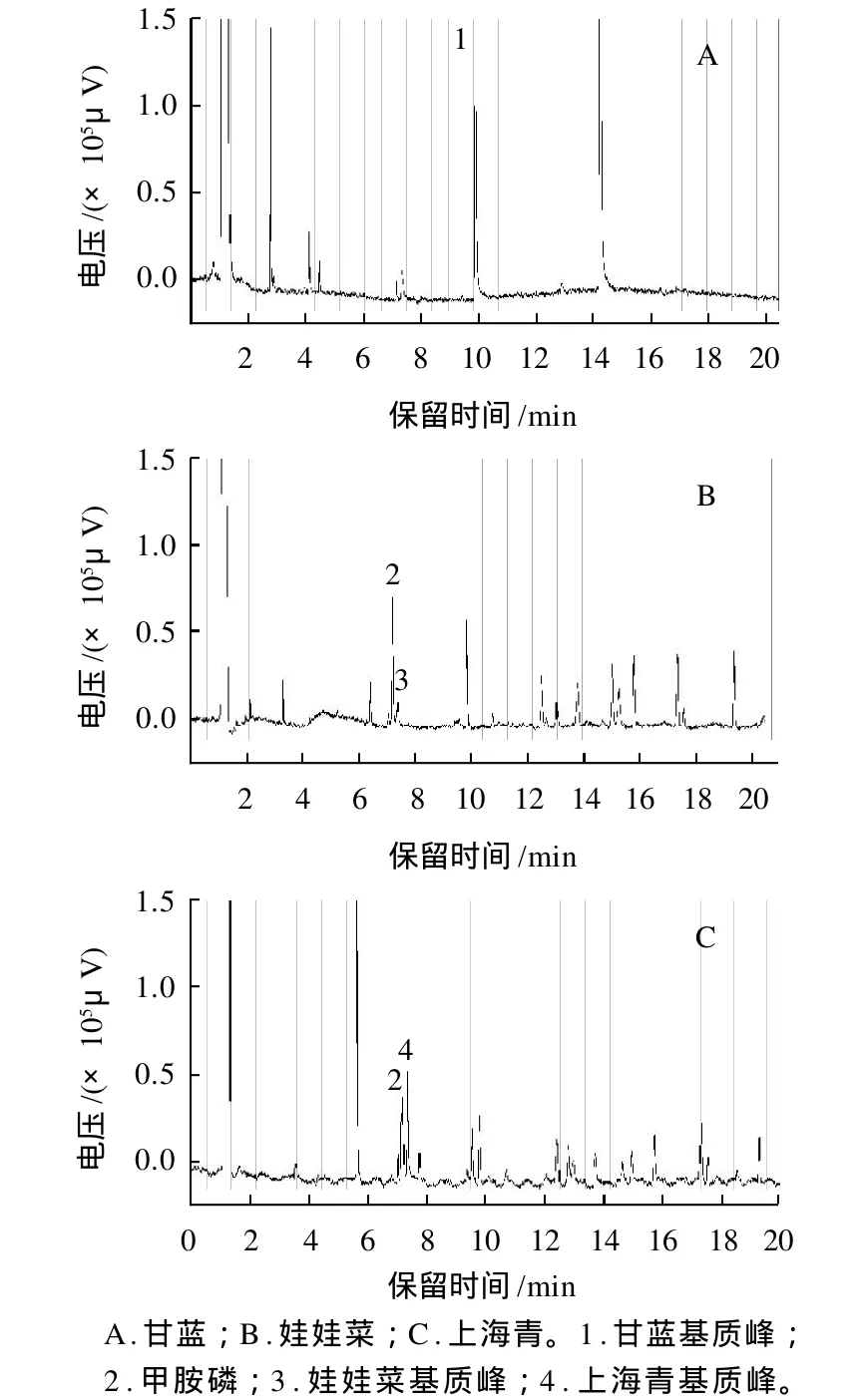
图2 3种蔬菜基质对有机磷农药检出的影响Fig. 2 Effect of vegetable matrix on the detection of organophosphorus pesticides
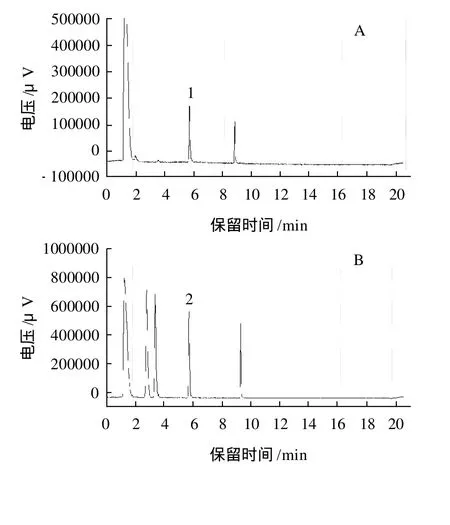
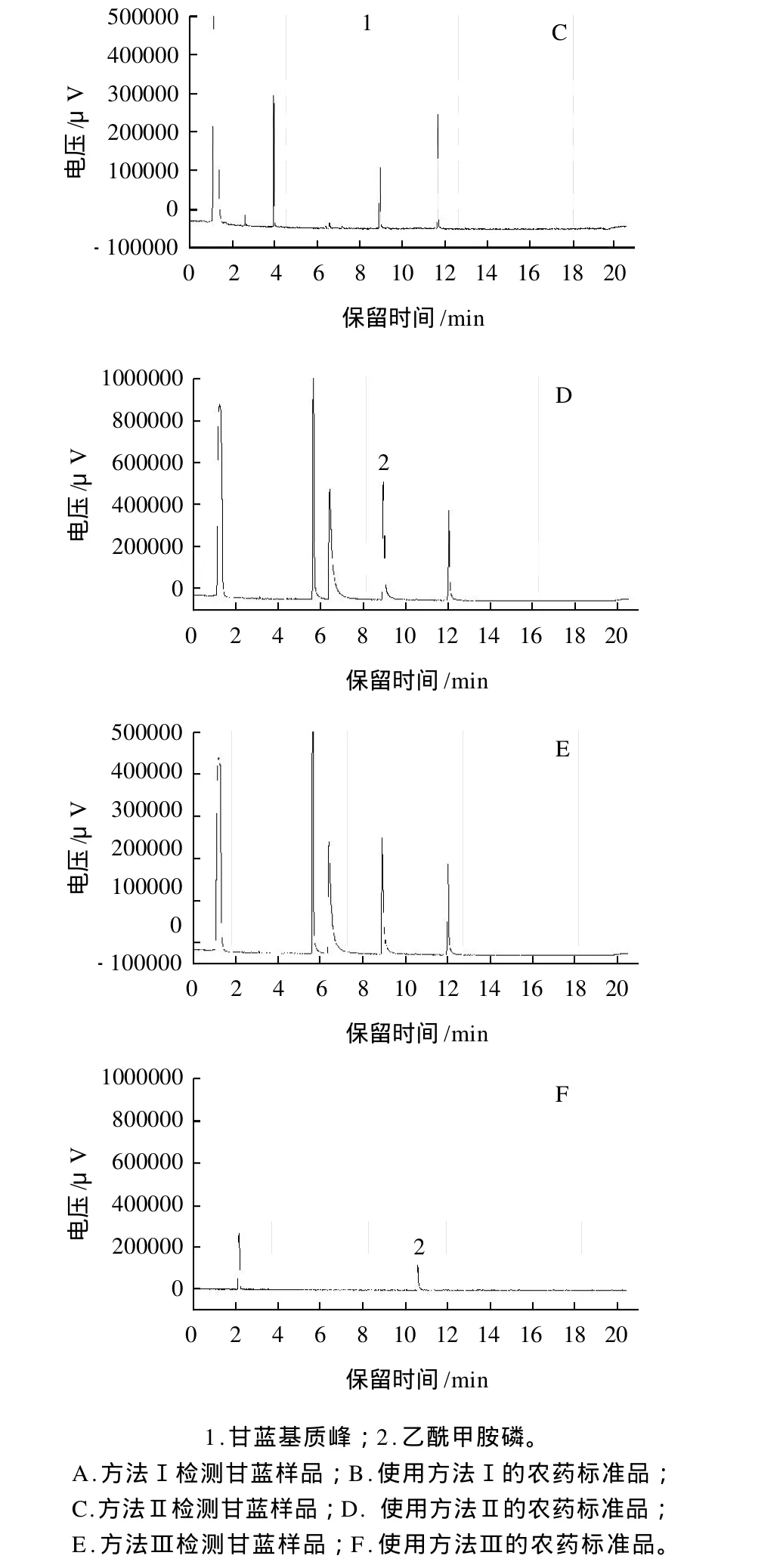
图3 甘蓝基质对乙酰甲胺磷检出影响的色谱图Fig.3 Effect of cabbage matrix on the detection of acephate
此外通过多次检测不同地点采样的上海青和娃娃菜样品,发现上海青和娃娃菜色谱图中均在甲胺磷出峰处出现杂峰,疑似为样品基质峰。通过在基质中加入混标进行检测以判断基质对11种农药检测的影响,结果见图2。将处理娃娃菜和上海青样品通过GC-MS方法进行验证(方法同甘蓝的GC-MS检测),均未出现与甲胺磷的特征离子匹配度高的离子。
韭菜基质有强烈的干扰,严重影响农药的检出,结果见图4。可能是因为韭菜中含有大量的含磷物质,而FPD检测器对含硫磷物质极其灵敏[8],易将此类物质检测出。
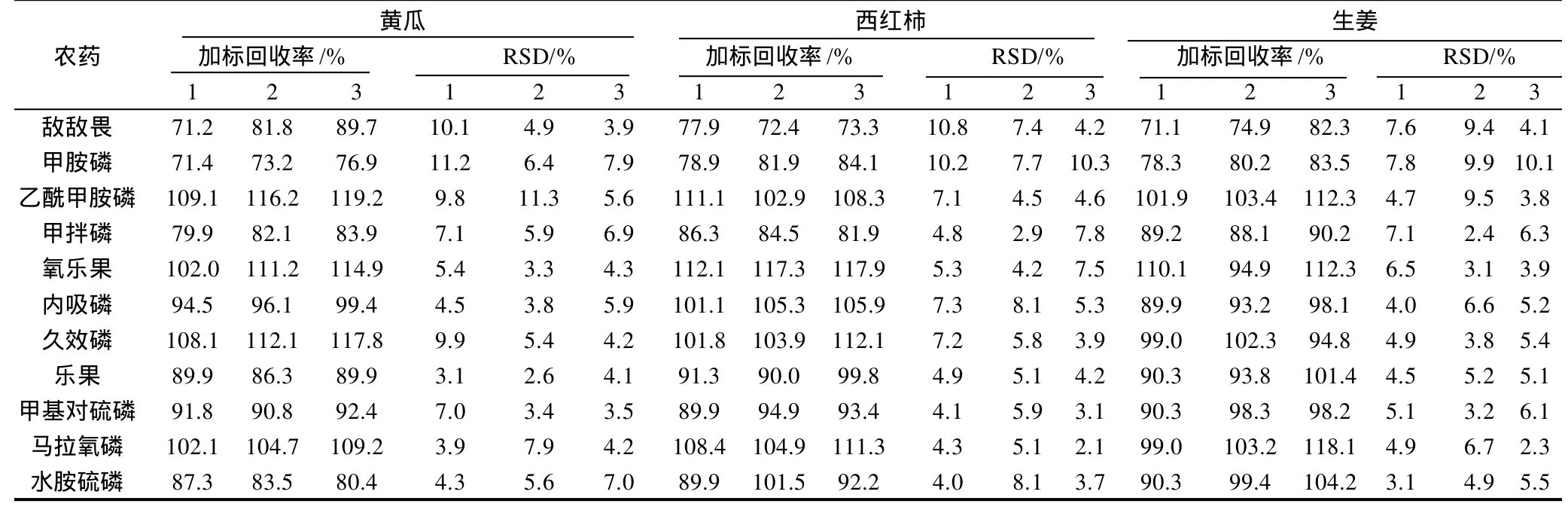
表3 11种有机磷农药的加标回收率及精密度实验Table 3 Recovery rates and relative standard deviations (RSD) of 11 organophosphorus pesticides
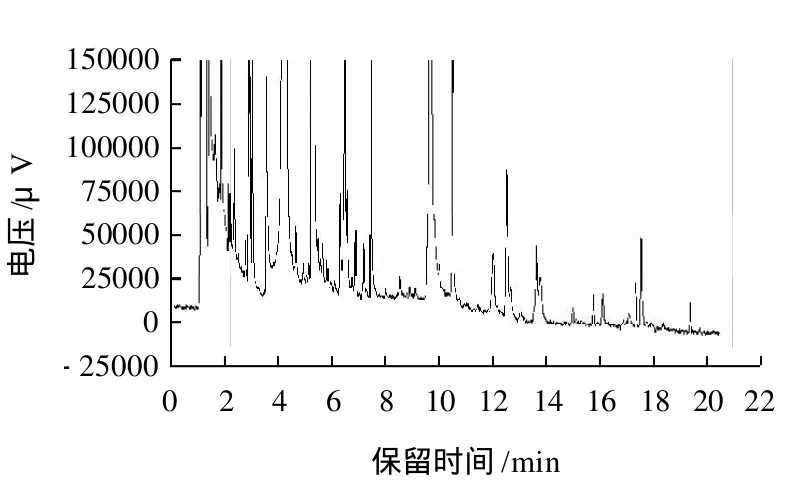
图4 韭菜基质的色谱图Fig.4 Gas chromatogram of garlic chive matrix
2.4 线性范围、标准曲线、检出限和保留时间
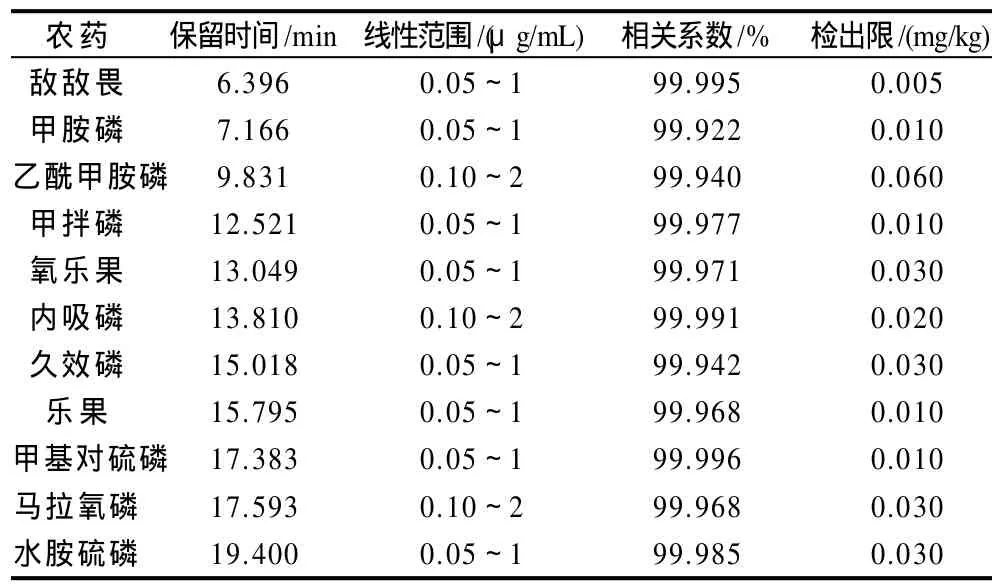
表2 11种有机磷农药的保留时间、检出限、线性范围及相关系数Table 2 Retention time, detection limits, linear ranges and correlation coefficients of 11 organophosphorus pesticides
根据不同农药在同一色谱条件下响应值不同,准确吸取适量的标准溶液,配成不同浓度的混合标准工作液,通过峰面积定量,绘制标准曲线,并计算回归方程及相关系数。同时按信噪比(RSN)=3计算检出限,得到的回归方程等见表2。由表2可知,11种农药在采用本方法进行测定时,其线性范围内相关系数均>99.9%,其检出限范围为0.005~0.060mg/kg,符合农药残留限量检测要求。
2.5 回收率和精密度实验
分别将农药添加水平为1.0、0.5、0.1mg/kg的黄瓜、西红柿、生姜空白蔬菜进行加标回收率的测定。每个质量浓度做3个平行样,每个样在相同的条件下连续测定5次,计算精密度。从表3可知,加标回收率范围为回收率为71.2%~117.9%,RSD为2.1%~11.2%。符合农药检测方法要求[14]。
3 结 论
3.1 本方法同时测定了蔬菜中敌敌畏、甲胺磷、乙酰甲胺磷等11种有机磷农药。使用毛细管DB-17毛细管柱可以将11种农药分离,特别是能很好的分离在非极性柱内难以分离的敌敌畏和甲胺磷。FPD检测器对于含磷物质灵敏度高,方法检出限低。样品前处理方法简单,且仅使用单柱,设备要求简单,节约时间和检测成本。适合于广大基层单位使用。此外,本方法适合于大部分的蔬菜的11种农药同时检出,但是由于FPD检测器对于硫磷元素的高灵敏性,一些富含硫磷物质的蔬菜不适合此方法。此外,本方法在检测甘蓝等样品时会有基质影响,此时可通过双柱法和GC-MS定性,以避免假阳性结果。
3.2 本方法检测的11种农药中包括两种NY/T761中没有涉及的农药——马拉氧磷和内吸磷。马拉氧磷是马拉硫磷的氧化产物,是一种毒性相对不高(大白鼠口服急性LD50为87~90mg/kg)而药效较优的品种,内吸磷是一种禁用高毒农药(大白鼠口服急性LD50为30mg/kg)[12]。此外我国在近年众多有关文献记录中,仅有一篇关于马拉氧磷在水中的检测[15]。本方法用于检测蔬菜中马拉氧磷,为今后的相关检测工作提供一定的依据。
3.3 本方法由于前处理简单,省去净化除色素等杂质的步骤,因此待测样品中含有色素、脂类等成分,易堵塞色谱柱和污染检测器,因此在进行大批量检测时,仪器和色谱柱的日常维护则尤为重要,以免影响检测的准确度和精密度。
[1] 周春梅. 入世与中国农产品农药残留的应对措施[J]. 农业与技术,2001, 21(6): 7-10.
[2] 赵为武. 农产品农药残留问题及治理对策[J] . 植物医生, 2001, 14(3): 10-13.
[3] 张婷, 张虹. 脉冲式火焰光度检测器(PFPD)分析蔬菜中有机磷农药残留[J]. 食品科学, 2008, 29(2): 302-306.
[4] 汪娌娜, 徐军. 气相色谱法测定蔬菜中15种有机磷农药残留[J]. 中国卫生检验杂志, 2009, 19(1): 63-64.
[5] 陈明, 梁春穗, 黄伟雄, 等. 广东省蔬菜水果中有机磷农药残留监测与评价[J]. 中国食品卫生杂志, 2009, 21(2): 117-119.
[6] MOL H, VAN DAM R, STEIJGER O. Determination of polar organophosphorus pesticides in vegetables and fruits using liquid chromatography with tandem mass spectrometry: selection of extraction solvent[J].Journal of Chromatography A, 2003, 1015(1/2): 119-127.
[7] OKIHASHI M, OBANA H, HORI S, et al. Determination of pesticide residues in onion, using a microwave oven[J]. Journal of the Food Hygienic Society of Japan, 1996, 37(1): 43-47.
[8] 王连珠, 游俊, 陈枝华, 等. 固相萃取-气相色谱法快速测定大葱中有机磷农药残留量[J]. 理化检验, 2005, 41(12): 880-883.
[9] 农业部环境质量监督检验测试中心(天津)、农业部环境保护科研监测所. NY/T 761—2008蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定[S]. 北京: 中国农业出版社,2008.
[10] 周芳, 孙成, 钟明, 等. 固相萃取毛细管气相色谱法分析水中有机磷农药残留[J]. 环境污染与防治, 2005, 27(2): 151-153.
[11] 张立言. 有机磷农药[M]. 北京: 燃料化学工业出版社, 1973: 21; 132;194.
[12] 王惠, 吴文君. 农药分析与残留分析[M]. 北京: 化学工业出版社, 2007:111.
[13] 吴岩, 杨长志, 刘永, 等. 气相色谱双柱法和气相色谱质谱法在蔬菜农药多残留检测中的应用[J]. 理化检验, 2007, 43(10): 815-820.
[14] 全国农药残留试验研究协作组. 农药残留量使用检测方法手册: 第一卷[M]. 北京: 化学工业出版社, 2001: 434-435.
[15] 刘淑芬. 水中马拉硫磷及其马拉氧磷的气相色谱分析[J]. 环境化学,1986, 5(1): 26-29.
Determination of 11 Organophosphorus Pesticide Residues in Vegetables by Gas Chromatography and Its Effect on Matrix
WU Hui,ZHU Zhen,FENG Hua-liang,LI Xiao-feng*
(College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
In order to establish a gas chromatography method for 11 kinds of pesticide residues in vegetables, the pre-treatment method for vegetables according to the standard of NY/T 761-2008 entitleetermination of organic phosphorus, organic nitrogen, pyrethroid and carbamate pesticide residues in fruits and vegetablwas modified. Meanwhile, the effect of vegetable matrix on determination efficiency of pesticide residues was explored. During the determination of pesticide residues, DB-17 capillary separation column and flame photometric detector (FPD) were used. The results indicated that 11 organophosphorus pesticide residues could be effectively separated. The recovery rates of 11 pesticides in cucumber, tomato and ginger with three spiked levels were in the range of 71.2%-117.9%. The relative standard deviation (RSD) was in the range of 2.1% to 11.2%.The detection limit of this method was 0.005-0.060 mg/kg for DB-17 column, and the retention time was 6.396-19.400 min.The calibration curves revealed a good linear relationship with correlation coefficients of more than 0.999. Under the heating at 40 ℃ by N2, the recovery rates of dichlorovos and phorate could be enhanced up to 95.00%-103.3%, respectively. A small amount of impure peaks in cabbage, baby vegetables and Shanghai green, and a large number of matrix peaks in garlic chive could interfere with the detection of pesticide residues.
gas chromatography;organophosphorus pesticide residues;vegetable;matrix
O657.7;TS207.5
A
1002-6630(2011)06-0198-06
2010-05-13
教育部“新世纪优秀人才支持计划”项目(NCET-060746);教育部高校博士点基金项目(200805611022);华南理工大学“SRP”项目(Y1090250)
吴晖(1967—),男,教授,博士,研究方向为食品质量与安全。E-mail:fehwu@scut.edu.cn
*通信作者:李晓凤(1977—),女,讲师,博士,研究方向为食品质量与安全。E-mail:xflibio@scut.edu.cn
