鱼皮明胶的超高压辅助提取工艺
2011-10-13张宇昊
张宇昊,马 良,师 萱
(1.西南大学食品科学学院,重庆 400716;2.重庆市特色食品工程技术研究中心,重庆 400716;3.重庆市生物技术研究所有限责任公司,重庆 401121)
鱼皮明胶的超高压辅助提取工艺
张宇昊1,2,马 良1,2,师 萱3
(1.西南大学食品科学学院,重庆 400716;2.重庆市特色食品工程技术研究中心,重庆 400716;3.重庆市生物技术研究所有限责任公司,重庆 401121)
为建立鱼皮明胶清洁生产工艺,对超高压辅助提取鱼皮明胶进行系统研究,考察超高压处理压力、超高压作用时间、提取温度、提取时间对凝胶强度和提取率的影响。结果表明,较优提取工艺为处理压力300MPa、超高压时间10min、提取温度50~60℃、提取时间4h,在此条件下明胶凝胶强度可达274g,得率可达75.03%,溶解温度和凝胶温度分别为23.6℃和16.4℃。
超高压;鱼皮明胶;凝胶强度;得率
明胶是一种重要的生物大分子材料,以其溶胶-凝胶的热可逆性质,广泛应用于食品、医药、感光材料、化工等领域[1]。通常明胶主要以猪、牛等哺乳动物的皮与骨为原料制备而成[2]。近年来,随着疯牛病、口蹄疫等危机的出现,不少国家禁止或减少了猪、牛来源明胶的生产和使用,源于水产类的明胶产品成为了研究的热点。
目前对于鱼皮明胶的研究主要集中在功能特性方面[3-7],在制备工艺方面则主要沿用了哺乳动物明胶的制备工艺。这些传统明胶制备工艺存在着生产周期长、水电资源消耗大、酸碱废液排放量大、环境污染严重等缺点,已经远不能适应当前国家节能减排的要求。
超高压技术是在一定温度下,将食品加压100~1000MPa后保持一段时间,达到杀菌、灭酶和改善食品功能特性的加工技术。超高压处理可以破坏蛋白质的三、四级结构,进而对蛋白质的性质产生影响[8]。研究表明[9]采用100~500MPa的高压作用可增强蛋白的凝胶特性,并能增加凝胶强度;尤其是在热加工前对蛋白进行高压处理可促进热凝胶的形成,增强热凝胶的强度。Gó mez-Guillé n等[10]曾采用超高压制备鱼皮明胶,其研究表明热处理之前采用适当的超高压预处理可增加产品得率,且压力的大小和时间会对明胶结构产生明显影响,进而影响产品性质,其认为高压可诱导蛋白聚合度增加,增加明胶中高相对分子质量组分,进而增加产品的凝胶特性。
以上研究均表明,超高压技术可以破坏蛋白质非共价键结构,而明胶制备过程中采用酸碱前处理的目的之一也是破坏胶原蛋白三、四级结构,因此,采用超高压技术取代传统的酸碱对胶原蛋白进行前处理具有一定可行性。此外,超高压处理可促进蛋白聚合的特性更有利于高凝胶强度明胶的制备。本研究拟建立超高压技术制备高凝胶强度鱼皮明胶生产工艺,并对其凝胶特性进行研究,旨在为改善明胶行业高污染现状,建立鱼皮明胶清洁生产工艺提供参考。
1 材料与方法
1.1 原料与试剂
巴沙鱼皮由重庆禾瑞康动物营养有限公司提供,原料获取后除去杂质,冷藏于冰箱中。
异丙醇、盐酸、氯化钠、对二甲氨基苯甲醛、石油醚(30~60℃) 重庆川东化工(集团)有限公司;高氯酸成都金山化学试剂公司;氯胺T、羟脯氨酸 天津光复精细化工研究所。
1.2 仪器与设备
TA-Xtzi物性测定仪 英国TA公司;HPB.A2超高压生物处理实验机 天津市华泰森淼公司;CS501-SP超级恒温水浴 重庆四达仪器厂;SHZ-D(Ⅲ)循环水式真空泵、800C离心机、85-2恒温磁力搅拌器 重庆市春鑫科技有限公司;DGF3002BN电热恒温鼓风干燥箱 重庆恒达仪器厂;JY-10001电子天平 重庆法兰朵科技发展有限公司;ZX98-1旋转蒸发仪 上海贝凯生物化工设备有限公司;L-8800型全自动氨基酸分析仪 日本日立公司;MCR301旋转流变仪 奥地利Anton Paar公司。
1.3 分析方法
1.3.1 巴沙鱼皮基本成分测定
水分含量:依照GB/T 5009.3—2003《食品中水分的测定》进行测定;脂肪含量:依照GB/T 5009.6—2003《食品中脂肪的测定》进行测定;蛋白质含量:依照GB/T 5009.5—2003《食品中蛋白的测定》进行测定;灰分含量:依照GB/T 5009.4—2003《食品中灰分的测定》进行测定;胶原蛋白测定(以羟脯氨酸计):按照ISO 3496:1978(E)《Meat and meat products: Determination ofL(-)- hydroxyproline content》方法,测定羟脯氨酸。
1.3.2 明胶提取率

1.3.3 凝胶强度测定
质量分数6.67%的明胶溶液在7℃凝冻18h,采用物性测定仪进行测定。测定条件为下压高度4mm、下压速度1mm/s。
1.3.4 明胶氨基酸分析
采用6mol/L盐酸110℃条件下水解22h,稀释、过滤后上样分析,分析条件为(1)分离柱:洗脱液流速0.4mL/min、柱温700℃、柱压9.627MPa;(2)反应柱:茚三酮及茚三酮缓冲液流速0.35mL/min、柱温1350℃、柱压0.982MPa。
1.3.5 明胶溶解温度与凝胶温度测定
分别经冷却(40→5℃)和加热(5→40℃)两个温度变化阶段,温度扫描速率为1.0℃/min,频率1Hz,振荡应力3.0Pa。明胶黏弹性变化以相角(δ)与温度的函数表示。
1.4 鱼皮明胶的提取
1.4.1 明胶提取的工艺
工艺流程:鱼皮→清洗、去杂质、沥干→脱脂→杂蛋白去除→清洗→超高压处理→打浆→提胶→离心→干燥→成品明胶。
脱脂:采用石油醚回流脱脂8h、60℃、30min干燥。
杂蛋白去除:采用质量分数为1% NaCl溶液浸泡搅拌1 h。
1.4.2 单因素试验设计
巴沙鱼皮明胶单因素试验的基本条件定为超高压处理压力300MPa、超高压时间20min、提取温度60℃、提取时间4h。改变其中一个条件,固定其他条件以分析超高压压力、超高压时间、提取温度、提取时间对明胶凝胶强度和得率的影响。各因素梯度分别为超高压压力:0.1、100、200、300、400、500MPa;超高压时间:0、5、10、20、30 min;提取温度:30、4 0、5 0、6 0、7 0℃;提取时间:0.5、1、2、4、6h。每个因素重复实验3次,结果取平均值。
2 结果与分析
2.1 鱼皮组成

表1 巴沙鱼皮主要成分(以干基计)Table 1 Major components of Basa fish skin
从表1可看出,巴沙鱼皮的胶原蛋白含量较高,是提取明胶较为理想的原料。同时鱼皮中含有一定数量的脂肪,如不除去将对明胶的透明度产生影响,进而影响明胶质量。本实验采用石油醚回流12h的方法除去鱼皮中的绝大部分脂肪。
2.2 超高压制备鱼皮明胶工艺条件的确定
2.2.1 超高压压力
由图1可看出,在0~300MPa范围内随着处理压力的升高,凝胶强度呈上升趋势,300MPa时达到282g,极显著高于200MPa(P<0.01)时的凝胶强度。但随着处理压力的继续升高,作用压力对于凝胶强度变化无显著影响(P>0.05)。明胶得率在不同处理压力下无明显变化规律,但超高压作用可增加明胶得率,相对于未经超高压处理的样品,100~500MPa范围内经不同压力处理的样品,明胶提取率增长幅度为10.62%~15.62%。
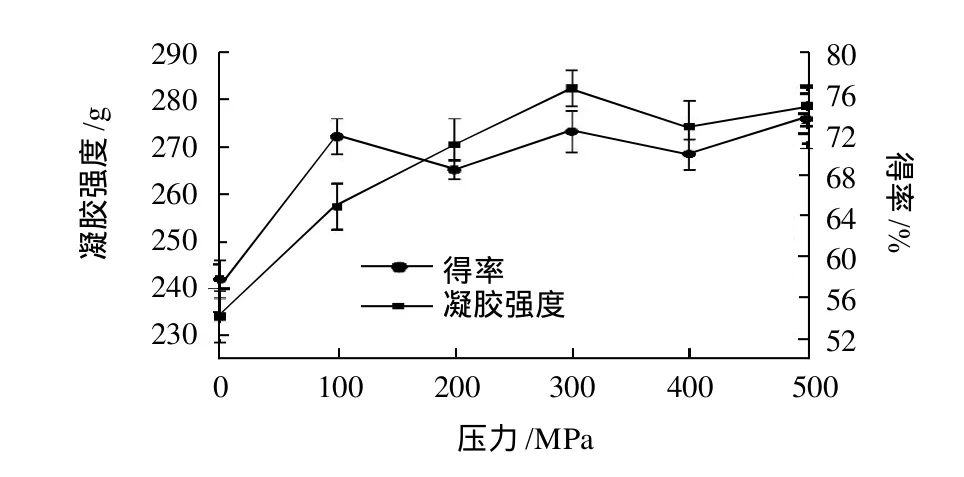
图1 压力对明胶凝胶强度及得率的影响Fig.1 Effect of ultra-high pressure treatment pressure on gel strength and yield of gelatin
许多蛋白质的天然构象是由一些非共价键的相互作用来稳定的,高压处理会破坏其非共价键平衡从而导致蛋白质性质改变[11],这也是超高压可以增加明胶提取率的原因所在。此外,研究[12]表明,对胶原蛋白实施超高压处理可促使其分子聚合,而以此类胶原蛋白作为明胶提取原料,更有利于产品中形成大量的高分子聚合体,较多高分子量组分的存在则是形成高凝胶强度明胶的关键因素。实验结果表明,当压力小于300MPa时,随着压力的增加,胶原蛋白分子聚合度可能逐渐增大,而当压力大于300MPa时,压力的增加对于胶原蛋白分子聚合度的影响已经不显著。因此,确定较适压力水平为300MPa。
2.2.2 超高压时间
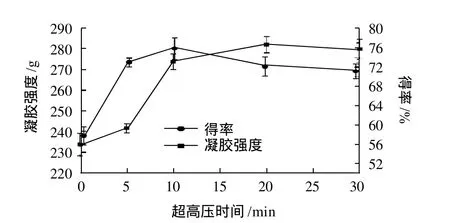
图2 超高压时间对明胶凝胶强度及得率的影响Fig.2 Effect of ultra-high pressure treatment time on gel strength and yield of gelatin
由图2可看出,在0~10min范围内,随着超高压作用时间的延长明胶凝胶强度呈上升趋势,超高压处理10min后提取的样品,凝胶强度可达274.1g。但当超过10min后,超高压作用时间对样品凝胶强度变化无显著影响(P>0.05)。研究[13]表明,超高压作用可以促进蛋白亚基的聚凝,但短时超高压处理利于增进蛋白聚合,但当蛋白聚合达到一定程度时,继续增加超高压处理时间对于增进蛋白聚合贡献已经很小。实验结果表明,超过10min后超高压作用对样品凝胶强度变化无显著影响,原因在于超高压作用超过10min时,其对胶原蛋白的聚合度影响已经很小。
样品在300MPa超高压下作用5~30min可显著增加明胶得率(P<0.05),但明胶得率在超高压10min时出现拐点,超高压作用10min时明胶得率可达75.03%,当超高压时间超过10min后,得率呈下降趋势。Gó mez-Guillé n等研究表明[10],在250MPa压力下,当作用时间从10min延长到20min时,明胶提取率有所下降。这可能是因为在超高压作用一段时间后,胶原蛋白形成了新的价键平衡,从而导致提取率降低。综合研究结果,确定较适超高压作用时间为10min。
2.2.3 提取温度

图3 提取温度对明胶凝胶强度和得率的影响Fig.3 Effect of extraction temperature on gel strength and yield of gelatin
由图3可看出,当提取温度50℃时,明胶凝胶强度达到285.5g,明胶得率为71.15%,两项指标均极显著高于40℃条件下提取的明胶(P<0.01);随着温度的进一步提高,明胶凝胶强度呈下降趋势,尤其是当提取温度达到70℃后,凝胶强度极显著下降(P<0.01);而明胶提取率则随温度升高呈略微提高趋势。
加热可以断开胶原分子三螺旋结构的次级键及部分肽键,使胶原分子的单链、少量聚集体和单链断裂组分进入溶液,溶胶转变为明胶。较低温度提取明胶产率较低、提取时间长;适宜高温提取可加速胶原转化为明胶,但温度过高,不仅不能进一步提高产品得率,还会促使胶原过度降解,使明胶凝胶强度降低[14]。由试验结果可推断,30~40℃范围内明胶凝胶强度较低,这可能是由于超高压促使胶原蛋白聚合,而这一温度范围内其加热强度较低,不足以通过水解并释放这些聚合物,从而导致明胶中高分子组分比例较低,而随着温度上升,聚合物被释放,进而导致明胶凝胶强度增大。由此可见,提取温度较适范围为50~60℃。
2.2.4 提取时间
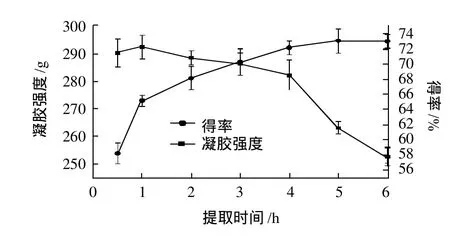
图4 提取时间对明胶凝胶强度和得率的影响Fig.4 Effect of extraction time on gel strength and yield of gelatin
由图4可看出,4h以内,随着提取时间的延长,明胶凝胶强度无显著差异(P>0.05),明胶得率则随提胶时间的延长迅速上升,4h时明胶凝胶强度为282.2g,明胶提取率达到72.15%。随着提胶时间的进一步延长,明胶凝胶强度极显著下降(P<0.01),得率则无显著变化(P>0.05)。明胶提取时间过短,胶液浓度太低,会影响产率;提胶时间过长会引起明胶过度水解,使明胶产品的凝胶强度降低。综合以上因素,明胶较适提取时间在4h左右。
综合以上结果确定超高压法制备鱼皮明胶较适工艺参数为超高压压力300MPa、超高压时间10min、提取温度50~60℃、提取时间4h。在此条件下制备的鱼皮明胶凝胶强度与得率分别达到274g和75.04%。而采用常规法制备的鱼皮明胶以上两指标分别为234g和66.13%[15]。由此可见,适宜的超高压作用可以显著提高鱼皮明胶凝胶强度和得率,尤其是相对于传统酸碱提取工艺,明胶的得率大大提升,几乎达到100%。这是由于传统工艺中鱼皮明胶会在酸碱作用后的清洗过程中大量损失[16],而采用超高压代替酸碱处理,恰恰消除了这一损失。
2.3 明胶溶解温度与凝胶温度测定


图5 鱼皮明胶溶液在加热过程(A)和冷却过程(B)中的相角变化Fig.5 Evolution of phase angle during heating and cooling processes of fish gelatin solution
相角衡量明胶在不同相变的过程中体现的应力和张力的变化,由图5可知,在加热过程中常规工艺制备的鱼皮明胶在22.2℃时溶解,在冷却过程中14.2℃时形成凝胶;而超高压工艺制备的明胶溶溶解和凝胶形成点分别为23.6℃和16.4℃,两项指标均高于常规工艺。研究[17-18]表明,明胶的凝冻温度和溶化温度与其中亚氨基酸(脯氨酸与羟脯氨酸)含量及其平均相对分子质量有关,明胶中亚基氨基酸含量越高,明胶的平均相对分子质量越高,其凝冻温度和溶化温度越高。由表2可见,超高压法和常规法制备的鱼皮明胶亚基氨基酸含量基本相同,分别为18.63%和18.94%。由此可证明,超高压工艺制备的明胶凝冻温度和溶化温度较高的原因在于其比常规法制备的明胶含有更多的高分子组分,这些组分可能是由于超高压导致蛋白聚合的产物。
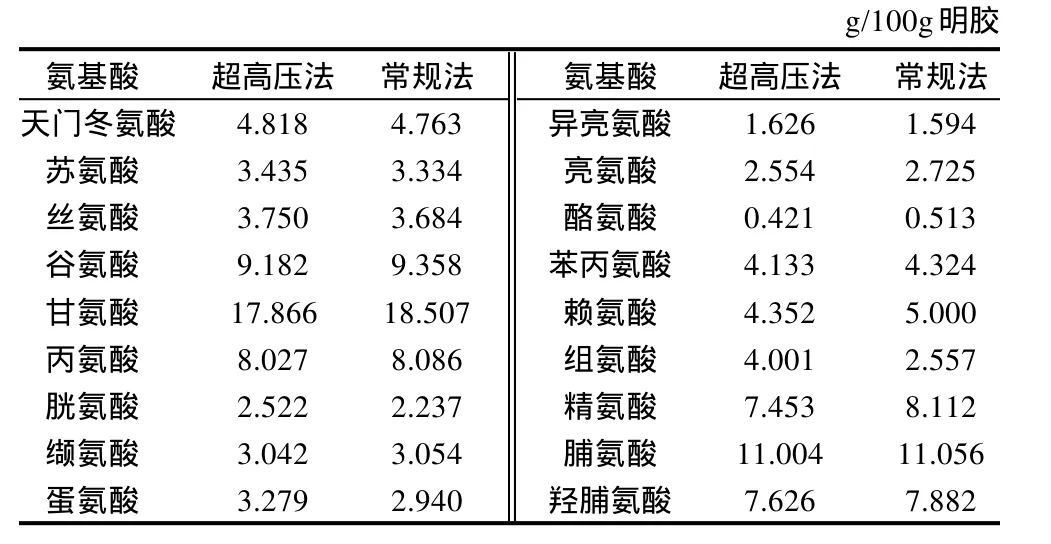
表2 巴沙鱼皮明胶氨基酸组成Table 2 Amino acid composition of gelatin from Basa fish skin
3 结 论
3.1 通过单因素试验分析,得到超高压法制备高凝胶强度鱼皮明胶提取工艺参数为超高压压力300MPa、超高压时间10min、提取温度50~60℃、提取时间4h,在此条件下明胶凝胶强度可达274g,得率可达75.03%。
3.2 性质研究表明,超高压法制备的鱼皮明胶溶解温度和凝胶温度分别为23.6℃和16.4℃,两项指标均高于常规法明胶,其原因可能在于超高压明胶含有更多的高分子组分。
[1] PHILLIPA G O, WILLIAMS P A. Handbook of hydrocolloids[M]. New York: CRC Press, 1992: 64.
[2] VEIS A. The maromolecular chemistry of gelatin[M]. New York: Academic Press, 1964: 81.
[3] HAUG I J, DRAGET K I, SMIDSROD O. Physical and rheological properties of fish gelatin compared to mammalian gelatin[J]. Food Hydrocolloids, 2004, 18(2): 203-213.
[4] FERNNDEZ-DAZ M D, MONTERO P, GOMEZ-GUILLN E. Effect of freezing fish skins on molecular and rheological properties of extracted gelatin[J]. Food Hydrocolloids, 2003, 17(3): 281-286.
[5] GIMENEZ B, GOMEZ-GUILLEN M C, MONTERO P. Storage of dried fish skins on quality characteristics of extracted gelatin[J]. Food Hydrocolloids, 2005, 19(6): 958-963.
[6] MUYONGA J H, COLE C G B, DUODU K G. Extraction and physico-chemical characterisation of Nile perch (Lates niloticus)skin and bone gelatin[J]. Food Hydrocolloids, 2004, 18(4): 581-592.
[7] RAJEEV B, KARIM A A. Ultraviolet irradiation improves gel strength of fish gelatin[J]. Food Chemistry, 2009, 113(4): 1160-1164.
[8] PATEL H A, SINGH H. Effects of high hydrostatic pressure treatments on disulfide bonding interchanges among the proteins in skim milk[J].J Argic Food Chem, 2006, 54(9): 3409-3420.
[9] CHEFTEL J C, CULIOLI J. Effects of high pressure on meat: a review[J]. Meat Science, 1997, 46(3): 211-236.
[10] GOMEZ-GUILLEN M C, GIMENEZ B, MONTERO P. Extraction of gelatin from fish skins by high pressure treatment[J]. Food Hydrocolloids,2005, 19(5): 923-928.
[11] SUZUKI Y, SAZAKI G, MIYASHITA S, et al. Protein crystallization under high pressure[J]. Protein Structure and Molecular Enzymology,2002, 1595(1): 345-356.
[12] KWIATKOWSKA A, JANKOWSKA B, KORZENIOWSKI W. Changes in solubility of the bovine semitendinosus muscle collagen under the influence of high pressure[J]. Polish Journal of Food and Nutrition Sciences, 2001, 51(4): 35-39.
[13] ELENA P, GUADALUPE P, ROSARIO G. High pressure and the enzymatic hydrolysis of soybean whey proteins[J]. Food Chemistry,2005, 85(4): 641-648.
[14] KASANKALA L M, 闫雪, 钱和. 草鱼鱼皮明胶提取工艺优化[J]. 海洋水产研究, 2006, 27(4): 82-89.
[15] 张宇昊, 马良, 谢祥. 巴沙鱼皮明胶提取工艺及性质研究[J]. 食品科学, 2009, 30(24): 88-92.
[16] KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids,2009, 23(3): 563-576.
[17] CHO S H, JAHNCKE M L, CHIN K B et al. The effect of processing conditions on the properties of gelatin from skate (Raja kenojei) skins[J].Food Hydrocolloids, 2006, 20(6): 810-816.
[18] JAMILAH B, HARVINDER K G. Properties of gelatins from skins of fish-black tilapia (Oreochromis mossambicus) and red tilapia (Oreochromis nilotica)[J]. Food Chemistry, 2002, 77(1): 81-84.
Ultra-high Pressure-assisted Extraction of Gelatin from Fish Skin
ZHANG Yu-hao1,2,MA Liang1,2,SHI Xuan3
(1. College of Food Science, Southwest University, Chongqing 400716, China;2. Chongqing Special Food Programme and Technology Research Center, Chongqing 400716, China;3. Chongqing Research Institute of Biotechnology Co. Ltd., Chongqing 401121, China)
In order to establish a clean production process of fish gelatin, the ultra-high pressure-assisted extraction of gelatin from fish skin was investigated to explore the effects of ultra-high pressure treatment pressure, ultra-high pressure treatment time, extraction temperature and extraction time on gel strength and yield of gelatin. Results indicated that the optimal extraction processing conditions were ultra-high pressure treatment pressure of 300 MPa, ultra pressure treatment time of 10 min,extraction temperature of 50-60 ℃ and extraction time of 4 h. Under the optimal extraction conditions, the gel strength and the yield of gelatin were 274 g and 75.03%, respectively. The melting and gelling temperatures were 23.6 ℃ and 16.4 ℃, respectively.
ultra-high pressure;fish gelatin;gel strength;yield
TS254.9
A
1002-6630(2011)06-0099-05
2010-05-24
重庆市科技公关项目(2009AC5182);西南大学博士基金项目(SWUB2007045)
张宇昊(1978—),男,副教授,博士,主要从事蛋白与生物活性肽研究。E-mail:zhy1203@yahoo.com.cn
