蒜头果淉中蛋白质的提取工艺研究
2011-10-09唐婷范刘雄民
唐婷范,刘雄民,凌 敏
(广西大学化学化工学院,广西南宁530004)
蒜头果淉中蛋白质的提取工艺研究
唐婷范,刘雄民*,凌 敏
(广西大学化学化工学院,广西南宁530004)
以提油脂后的蒜头果渣为原料,测定了蒜头果渣中蛋白质含量。通过单因素实验和正交实验优化蛋白质提取的工艺条件。结果表明,蒜头果渣的蛋白质含量为31.07%,蛋白质提取的优化工艺条件为:提取温度为室温,提取溶剂为磷酸盐缓冲液(pH7.5),提取时间为3h,料液比(W/V)为1∶25。在此优化条件下,蛋白质提取率为86.01%。
蒜头果渣,蛋白质,提取,正交设计
蒜头果(Malania oleifera Chun et S.K Lee)为铁青树科马兰木属,又称山桐果,是我国特有的单种属植物,分布在广西西部和云南东南部的狭窄地带[1],已被列为国家二级保护植物[2]。有关蒜头果挥发油、油脂的提取分离及应用研究已有大量文献报道[3-7]。蒜头果仁除含60%左右的油脂外,还含有大量的植物蛋白质。戴晓畅等[8]在不高于4℃下从蒜头果仁中提取纯化得到一种对人体多种癌细胞具有强烈抑制作用的蒜头果蛋白质;袁燕等[9-14]也进行了蒜头果蛋白质的结构、荧光光谱和毒性研究。这些研究的重点是在较低温下提取纯化蒜头果蛋白质,并进行结构表征与生物活性实验。有关从蒜头果仁提取油脂后而蒜头果渣提取蛋白质的工艺研究没有受到重视,影响蒜头果综合利用价值,残渣废弃对环境有影响。本工作利用溶剂提取油脂后的蒜头果渣为原料,进行蒜头果渣蛋白质含量的测定和蛋白质提取工艺的研究,探索具有应用前景的提取方法和技术路线,为综合利用蒜头果渣资源提供基础。
1 材料与方法
1.1 材料与仪器
蒜头果 产于广西巴马县;硫酸铜、酒石酸钾钠、硫酸钾、氢氧化钠等 以上试剂均为国产分析纯;牛血清蛋白标准品(BSA) Promega公司。
721 型分光度仪 上海第三分析仪器;LD5-10型低速离心机 北京医用离心机厂;pHS-3C型精密pH计 上海精密科学仪器有限公司;微型植物粉粹机 天津市泰斯特仪器有限公司;半微量凯氏定氮装置 泉州万达实验仪器设备公司。
1.2 实验方法
1.2.1 蒜头果渣蛋白质含量的测定 采用半微量凯氏定氮法[15]。准确称取0.05g样品,经消化,冷却后稀释至100mL容量瓶中。将冷凝管下端插入2%硼酸液并加5滴混合指示剂(甲基红-次甲基蓝)的容器的液面下,然后取样品消化液25mL于反应室中,再加入50%氢氧化钠溶液4mL,迅速盖塞,通入蒸汽,蒸出50mL左右即可。用0.05mol/L的盐酸标准液滴定至蓝紫色为终点,平行测定三次,同时做空白样。

式中:N-盐酸标准液的浓度(mol/L);V1-样品滴定时消耗盐酸的体积(mL);V0-空白样滴定时消耗盐酸的体积(mL);W-果渣的质量(g);6.25-含氮量换算为蛋白质的换算系数。
1.2.2 蒜头果渣蛋白质的提取 将脱除油脂后的蒜头果渣粉碎,过60目筛。准确称取一定量的原料,加入一定料液比的提取溶剂,于一定温度下提取一定时间,提取液在3000r/min转速下离心20min,取上清液用721型分光光度计测定吸光度,收集上清液(提取液),浓缩,干燥后得粗蛋白。
1.2.3 提取液中蛋白质含量的测定 采用双缩脲法[16]。首先绘制标准曲线:取一系列试管,分别加入0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mL的5mg/mL标准牛血清蛋白溶液,用水补足至1mL,然后加入4mL双缩脲试剂在室温下(15~25℃)放置30min,于540nm波长下用721型分光光度计测定光密度。最后以光密度为纵坐标,牛血清蛋白的含量为横坐标绘制标准曲线,得线性回归方程为:
A=0.0494C-0.0013,相关系数r=0.9996,线性范围为0.50~5.00mg/mL。
式中:A为样品在540nm处的吸光度;C为样品浓度(mg/mL)。
通过测量吸光度计算出提取液中蛋白质含量:
蛋白质提取率(%)=提取液中蛋白质含量×提取液体积/(蒜头果渣蛋白质含量×蒜头果渣取样量)×100%
2 结果与讨论
2.1 蒜头果渣中蛋白质含量
按1.2.1进行实验,测得蒜头果渣蛋白质含量为31.07%。
2.2 提取温度对蛋白质提取率的影响
为确定适宜的提取温度,考察温度对蛋白质提取率的影响。称取5g的果渣,加入料液比为1∶25的磷酸盐缓冲液(pH7.5),于4℃、室温、40℃、55℃和70℃条件下提取3h,按1.2.2进行实验,结果见图1。

图1 不同提取温度对蛋白质提取率的影响
由图1可知,室温以下,随着温度的升高,蛋白质的提取率逐渐增大,室温下提取率达到最高,但随着温度的升高,蛋白质的提取率逐渐降低,说明温度对蛋白质的溶解性和稳定性的影响较大,可能是温度升高引起蛋白质变性,影响了蛋白的溶解性。综合考虑蛋白质提取率、提取成本和稳定性,以室温为宜。
2.3 提取溶剂对蛋白质提取率的影响
为确定适宜的提取溶剂,考察提取溶剂对蛋白质提取率的影响。在室温下,称取5g的果渣,分别以10%乙醇、水、氯化钠溶液(0.15mol/L)、磷酸盐缓冲液(pH7.5)和Tris-HCl缓冲液(pH7.5)为提取溶剂,料液比为1∶25,提取时间为3h,按1.2.2进行实验,结果见图2。

图2 不同浸提液对蛋白质提取率的影响注:1.10%乙醇;2.水;3.氧化钠溶液;4.磷酸盐缓冲液;5.Tris-HCl缓冲液。
由图2可知,蛋白质在五种溶剂中的溶解性为:10%乙醇<水<Tris-HCl缓冲液<氯化钠溶液<磷酸盐缓冲液。说明蛋白质在不同溶剂中的溶解度不同,后三种溶剂对蛋白质的溶出率较高。原因是稀盐溶液和缓冲液对蛋白质的稳定性好,溶解性大。故磷酸盐缓冲液为适宜的提取溶剂。
2.4 提取时间对蛋白质提取率的影响
为确定蛋白提取的适宜时间,考察时间对蛋白质提取率的影响。在室温下,称取5g的果渣,加入料液比为1∶25的磷酸盐缓冲液(pH7.5),分别以1、2、3、4、5h为提取时间,按1.2.2进行实验,结果见图3。
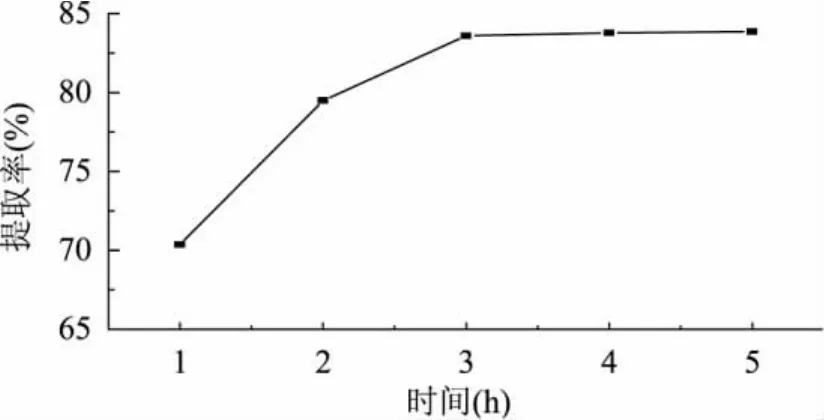
图3 不同提取时间对蛋白质提取率的影响
由图3可知,提取时间在1~3h区间内,提取率升高比较明显,3h之后逐渐趋于平稳。当提取时间低于2h时,提取率偏低,可能是由于蒜头果渣本身需要一定的溶胀时间,但长时间的提取会使部分蛋白变性,综合考虑蛋白质提取率和提取成本各方面因素,一般选提取时间3h为宜。
2.5 料液比对蛋白质提取率的影响
为确定蛋白提取适宜的料液比,考察料液比对蛋白质提取率的影响。在室温下,称取5g的果渣,加入料液比(W/V)分别为1∶10、1∶15、1∶20、1∶25和1∶30的磷酸盐缓冲液(pH7.5),提取3h,按1.2.2进行实验,结果见图4。
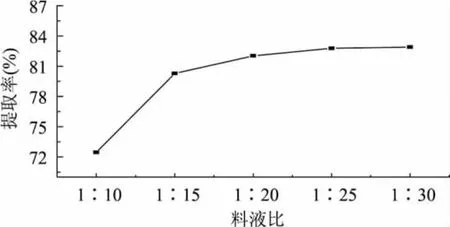
图4 不同料液比对蛋白质提取率的影响
由图4可知,随料液比的增大,蛋白质的溶出率也在增大,在料液比为1∶20后蛋白质溶出增加缓慢。料液比较小时,提取率不是很高,这是因为蒜头果渣蛋白在溶液中具有一定的溶解度,在蛋白质溶解达到饱和时,过量的蛋白质不再溶解,提取率不再提高。考虑到后面离心、蛋白质分离等工序,由此确定适宜的料液比为1∶25。
2.6 提取工艺条件的优化
在单因素实验的基础上,分别选取提取温度4~40℃,提取溶剂:氯化钠溶液(0.15mol/L)、磷酸盐缓冲液(pH7.5)和Tris-HCl缓冲液(pH7.5),提取时间2~4h,料液比(W/V)1∶15~1∶25 4个因素3个水平,采用正交实验L9(34),按1.2.2进行实验,以蒜头果渣蛋白质提取率为评价指标,优化提取蛋白质的工艺条件,实验方案如表1所示。

表1 正交实验的因素水平表
对实验结果进行极差分析,结果如表2所示。
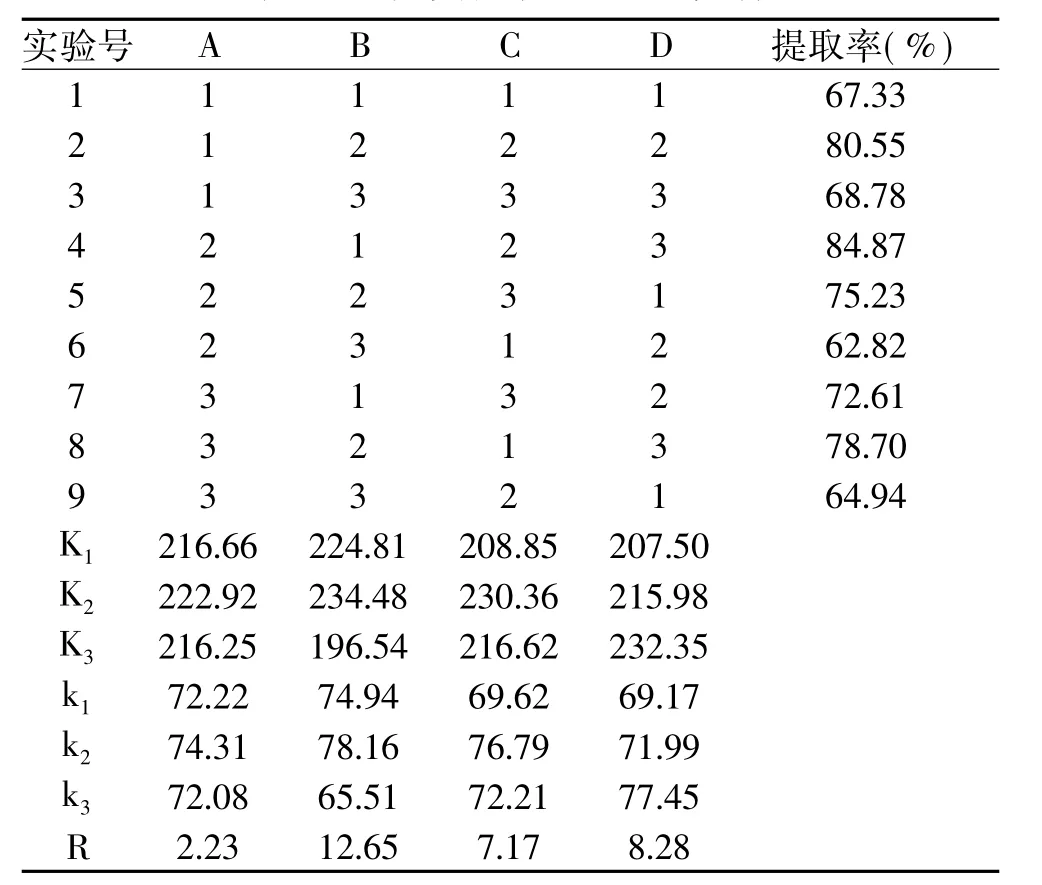
表2 正交实验结果及极差分析
从表2极差分析结果可知,各因素对蛋白提取率的影响顺序为:温度(B)>料液比(D)>时间(C)>提取溶剂(A),蒜头果渣中蛋白最优提取方案为A2B2C2D3。即提取溶剂为磷酸盐缓冲液(pH7.5),温度为室温,提取时间为3h,料液比为1∶25。在此条件下,按1.2.3公式计算蛋白质提取率为86.01%。
3 结论
本文进行了蒜头果渣蛋白质的研究,得出了如下结论:
采用半微量凯氏定氮法测得蒜头果渣的蛋白质含量为31.07%。通过单因素实验和正交优化组合得出蒜头果渣中蛋白提取的最佳工艺为:提取温度为室温,提取溶剂为磷酸盐缓冲液(pH7.5),提取时间为3h,料液比为1∶25。在此优化工艺条件下,用双缩尿法测定提取液中蛋白质的含量,计算蛋白质提取率为86.01%。
本法提取蒜头果渣中蛋白的工艺流程简单,成本较低,提取率较高,可据此进行大规模生产。
[1]许兆然.中国南部和西南部石灰岩植物区系的研究[J].安徽农学院学报,1980(2):88-94.
[2]傅立国.中国植物红皮书-稀有濒危植物[M].北京:科学出版社,1992:480.
[3]黄品鲜,李飘英,李伟光,等.有机溶剂萃取分离蒜头果油的研究[J].广西化工,1998,27(3):1-3.
[4]熊德元,刘雄民,李伟光,等.结晶法分离蒜头果油中神经酸溶剂选择研究[J].广西大学学报:自然科学版,2004,29(1):85-88.
[5]周永红,李伟光,易封萍,等.气相色谱-质谱法测定蒜头果油中的脂肪酸[J].色谱,2001,19(2):147-148.
[6]刘雄民,李伟光,李飘英,等.用蒜头果油脂合成大环内酯的新方法[J].高等学校化学学报,2007,28(5):897-899.
[7]赖芳,刘雄民,李伟光,等.气相色谱外标法测定环十五内酯[J].食品科学,2009,30(10):159-161.
[8]戴晓畅,毛宇,黄晓麒,等.用于人类癌症治疗的蒜头果蛋白质:中国,200510010633.1[P].2006-08-09.
[9]Yan Yuan,Xiaochang Dai,Debin Wang,et al.Purification,characterization and cytotoxicity of malanin,a novel plant toxin from the seeds of Malania oleifera[J].Toxicon,2009,54:121-127.
[10]袁燕,段玲燕,郭丽红,等.BCA法测定新的植物毒素-蒜头果蛋白质量浓度[J].昆明学院学报,2009,31(3):60-61.
[11]袁燕,戴晓畅,郭丽红,等.蒜头果蛋白性质的鉴定及其中性糖含量的测定[J].安徽农业科学,2009,37(31):15097-15098.
[12]袁燕,肖涵,康洪钧,等.新的植物毒素蒜头果蛋白的荧光光谱研究[J].光谱学与光谱分析,2009,29(3):777-780.
[13]袁燕,戴晓畅,王德斌,等.蒜头果蛋白的急性毒性实验[J].安徽农业科学,2009,37(28):13638-13642.
[14]袁燕.新的植物毒蛋白(Malanin)的分离纯化,结构鉴定,生物活性及作用机理研究[D].昆明:云南大学,2008.
[15]黄伟坤.食品检验与分析[M].北京:中国轻工业出版社,1997:51-52.
[16]刘志国.生物化学实验[M].华中科技大学出版社,2007:77-79.
Study on extraction technology of protein from Malania Oleifera Chun residue
TANG Ting-fan,LIU Xiong-min*,LING Min
(College of Chemistry and Chemical Engineering of Guangxi University,Nanning 530004,China)
The content of protein was measured,and single factor experiment and orthogonal factor experiment were carried out to optimize the extraction technology,which was used to extract the protein from Malania oleifera Chun residue.The results showed that the content of protein in Malania oleifera Chun residue was 31.07%,the optimum conditions were as follows:the extraction temperature was room-temperature,the extraction solvent was phosphate buffer solution,and pH7.5,the extraction time was 3 hours and the ratio of material to liquid was 1∶25.Under this condition,the extraction rate reached 86.01%.
Malania Oleifera Chun residue;protein;extraction;orthogonal design
TS201.21
B
1002-0306(2011)06-0323-03+
2010-07-06 *通讯联系人
唐婷范(1988-),女,博士研究生,研究方向:天然产物化工。
广西科学基金项目(桂科基0832002)。
