灵芝原生质体制备与融合条件的研究
2011-10-09苗敬芝吕兆启董玉玮
苗敬芝,吕兆启,董玉玮
(徐州工程学院食品工程学院,江苏徐州221008)
灵芝原生质体制备与融合条件的研究
苗敬芝,吕兆启,董玉玮
(徐州工程学院食品工程学院,江苏徐州221008)
以美国大灵芝和信州灵芝为起始菌株,对其原生质体制备和融合条件进行研究。结果表明:美国大灵芝原生质体制备最佳条件:摇瓶培养4d的菌丝球,复合酶液酶解,温度31℃,时间3h,原生质体制备率为5.80×106个/mL,再生率为0.32‰;信州灵芝原生质体制备最佳条件:摇瓶培养5d的菌丝球,复合酶液酶解,温度31℃,时间2.5h,原生质体制备率为4.71×106个/mL,再生率为0.24‰。两种原生质体最佳融合条件:促融剂PEG浓度30%,Ca2+浓度0.03mol/L,时间30min,温度35℃,融合率0.47%。
美国大灵芝,信州灵芝,原生质体融合,融合子
灵芝素有“仙草”之称,是一种名贵的药用真菌,含有多种对人体有益的活性物质,包括灵芝多糖、三萜类化合物、蛋白质、氨基酸、生物碱、微量元素等,对人体具有多种生理作用,能防治肿瘤、降血糖、降血脂、清除体内自由基、增强机体免疫力等[1-2]。随着人们对灵芝医疗保健作用认识的加深,对其需求日益增加,加强新品种选育研究成为灵芝产业化开发的重要内容。普通灵芝菌种存在有效成分含量低、稳定性差等缺点,但是自然选育费时费力。利用原生质体融合技术选育优良菌种是一种较好的方法,但目前用此技术选育灵芝菌种的报道很少。本文以美国大灵芝和信州灵芝为亲本菌株,对灵芝原生质体制备和融合条件进行探讨[3]。通过原生质体融合提高灵芝有效成分的含量,为选育高产、优质和稳定的灵芝菌株提供技术参考。
1 材料与方法
1.1 材料与仪器
美国大灵芝、信州灵芝 北京吉蕈园科技有限公司;液体摇瓶培养基(%) 可溶性淀粉3、酵母膏1、葡萄糖1.2、磷酸二氢钾0.3、硫酸镁0.15;完全再生培养基(%) 蛋白胨0.1、牛肉膏0.05、葡萄糖2、硫酸镁0.05、磷酸二氢钾0.046、磷酸氢二钾0.1、VB20.05、VB60.01、琼脂2;溶壁酶、蜗牛酶、纤维素酶 广东省微生物研究所;甘露醇、巯基乙醇、聚乙二醇、无水氯化钙、正丁醇等 分析纯试剂。
SW-CJ-1F无菌操作台 苏州安泰空气技术有限公司;150b生化培养箱 常州国华电器有限公司;HZ150L恒温培养摇床 武汉瑞华仪器设备有限责任公司;TGL-16G高速台式离心机 上海安亭科学仪器厂;YXQ-SG46-028A手提式压力蒸汽灭菌锅上海博讯实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 灵芝原生质体的制备与再生 灵芝菌种活化→摇瓶培养→过滤收集菌丝球,无菌水冲洗→稳渗剂甘露醇冲洗→菌丝体转入巯基乙醇中,振荡处理→过滤收集菌丝体,甘露醇冲洗→离心,弃上清液取沉淀→1g菌丝体以1∶10比例加入复合酶液,酶解→过滤→滤液离心→沉淀即为原生质体。将沉淀经甘露醇溶解、稀释,用血球计数板计数,计算原生质体的制备率[4-5]。
将制得的原生质体液接种到完全再生培养基上,在28℃下于恒温培养箱中静置培养,记录下培养皿上生长出的再生菌落的数目。
原生质体再生率(%)=再生培养基上长出的菌落总数/制备的原生质体总数×100%
1.2.2 原生质体融合与融合子的再生 将制得的美国大灵芝和信州灵芝的原生质体用甘露醇调节到相同浓度,等量混合,置于无菌带塞的离心管内,离心。沉淀加入PEG(聚乙二醇溶液),促进原生质体融合,加入稳渗剂甘露醇,离心,弃上清液,用甘露醇洗涤,调原生质体浓度,接种到完全再生培养基中,培养,记录下再生融合菌落的数目,计算融合率[6-7]。
原生质体融合率(%)=再生的融合菌落总数/用于融合的两亲株原生质体再生总数×100%
2 结果与讨论
2.1 原生质体的制备和再生影响因素
2.1.1 菌龄对原生质体制备的影响 分别取摇瓶培养3、4、5、6、7d的美国大灵芝和信州灵芝的菌丝球在31℃下酶解3h制备原生质体,原生质体制备率见表1。
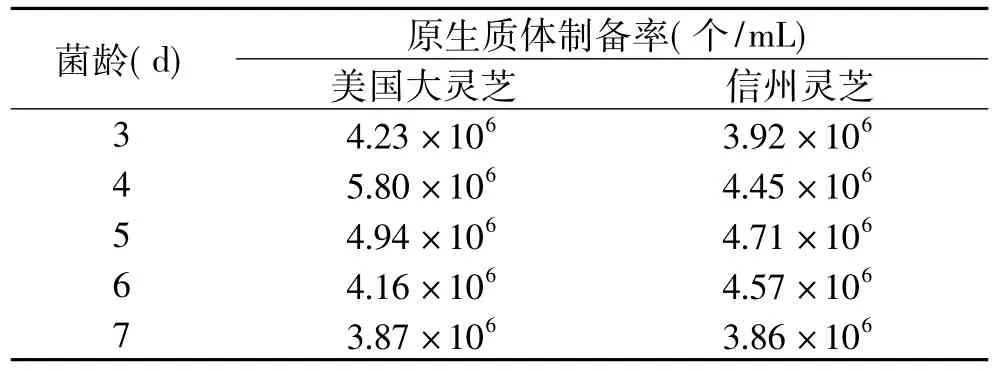
表1 菌龄对原生质体制备率的影响
由表1可以看出,美国大灵芝原生质体制备率最高时的菌丝体对应菌龄是4d,信州灵芝原生质体制备率最高时菌丝体对应的菌龄是5d。
细胞壁是酶底物,培养时间过短,菌丝体生长量不够,不易制得较多原生质体;培养时间过长,菌体老化,细胞壁加厚而变得结实,不易被酶解。因此选择细胞壁不太结实而菌丝体生长量又足够的对数生长中期。2.1.2 酶解时间对原生质体制备的影响 美国大灵芝和信州灵芝的菌丝球在31℃下酶解制备原生质体,分别取不同的酶解时间1.5、2、2.5、3、3.5h,原生质体制备率见表2。
由表2可以看出,美国大灵芝原生质体制备率最高时对应的酶解时间为3h,信州灵芝原生质体制备率最高时对应的酶解时间为2.5h。
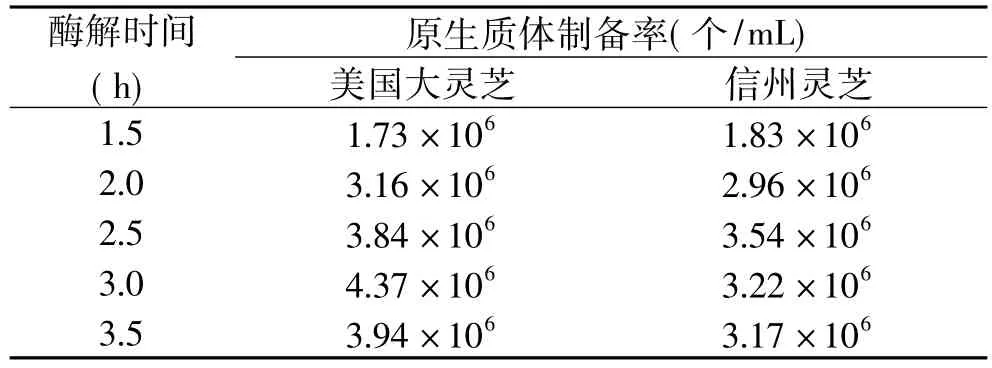
表2 酶解时间对原生质体制备率的影响
在起始阶段,随着酶解时间增加,原生质体制备率增加,到达一定值时,继续增加酶解时间,原生质体制备率下降。这是因为充分酶解后,继续增加酶解时间,由于酶对部分原生质体的进一步降解而导致原生质体破裂,也有部分原生质体自然破裂。
2.1.3 酶解温度对原生质体制备的影响 美国大灵芝和信州灵芝的菌丝球,分别采用不同的酶解温度25、28、31、34、37℃,酶解3h,原生质体制备率见表3。
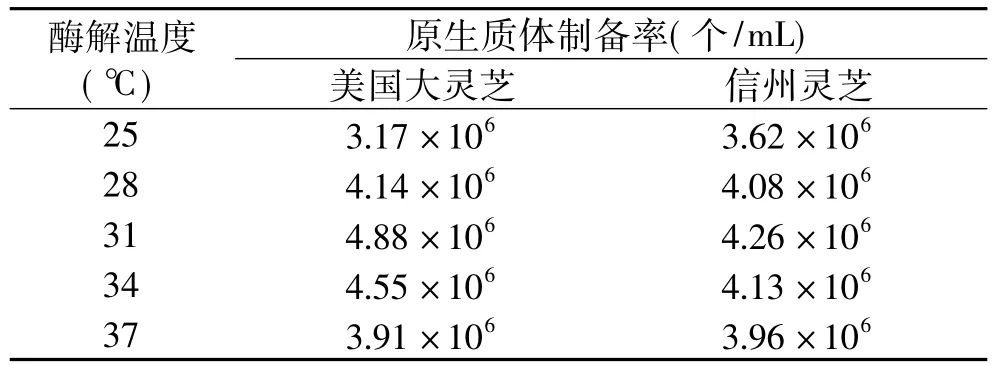
表3 酶解温度对原生质体制备率的影响
由表3可以看出,美国大灵芝原生质体制备率最高时对应的的酶解温度为31℃,信州灵芝原生质体制备率最高时对应的酶解温度也是31℃。
酶解温度太低,酶的活力也低,不利于细胞壁的去除;温度太高,酶容易失去活力,且细胞容易破碎或失去活性,影响再生。因此要选择适宜的酶解温度。
2.1.4 原生质体的再生及再生率 原生质体的再生选择完全再生培养基,在最适生长温度28℃下于恒温培养箱中静置培养,观察其生长情况并记录下培养皿上生长出的再生菌落的数目。结果表明,美国大灵芝原生质体的再生率为0.32‰,信州灵芝原生质体的再生率为0.24‰。
2.2 原生质体的融合和再生影响因素
2.2.1 PEG浓度对原生质体融合率的影响 美国大灵芝和信州灵芝原生质体融合时,分别采用不同的PEG浓度:20%、25%、30%、35%、40%,Ca2+浓度0.03mol/L,温度35℃,时间30min。结果见表4。
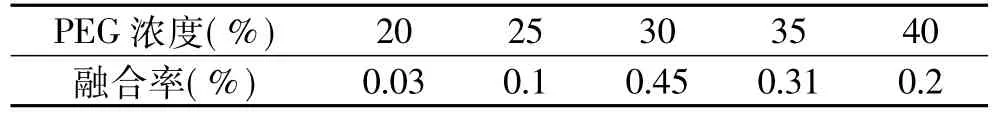
表4 PEG浓度对原生质体融合率的影响
由表4可以看出,美国大灵芝和信州灵芝融合时,PEG的浓度为30%能够使融合率达到最高。
在起始阶段,随着PEG的浓度增加,融合率增加,当融合率达到一定值时继续增大PEG浓度,融合率反而下降。这是因为PEG既是诱导剂又是稳定剂,当浓度过低时会使原生质体破裂而失去稳定性,浓度过高又会引起原生质体失水收缩,且浓度过高,PEG还会有一定毒性,影响融合子的再生。因此要选择适宜PEG浓度。
2.2.2 Ca2+浓度对原生质体融合率的影响 美国大灵芝和信州灵芝融合时融合剂中加入不同浓度的Ca2+:0.01、0.02、0.03、0.04、0.05mol/L,PEG 浓 度30%,温度35℃,时间30min。结果见表5。
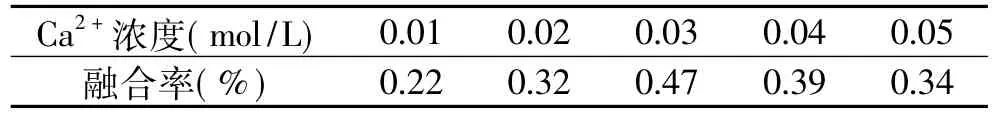
表5 Ca2+浓度对原生质体融合率的影响
由表5可以看出,美国大灵芝和信州灵芝融合时,Ca2+浓度为0.03mol/L能够使融合率达到最高。
Ca2+对原生质体融合有促进作用,这是因为带负电荷的PEG和带正电荷的钙离子因细胞膜表面分子相互作用,使原生质体表面形成电极性,致使原生质体之间相互易于吸附而发生融合。因此适宜的Ca2+浓度对原生质体融合起着重要作用。
2.2.3 温度对原生质体融合率的影响 美国大灵芝和信州灵芝融合时采用不同的温度:25、30、35、40、45℃,PEG浓度30%,Ca2+浓度为0.03mol/L,时间30min。结果见表6。
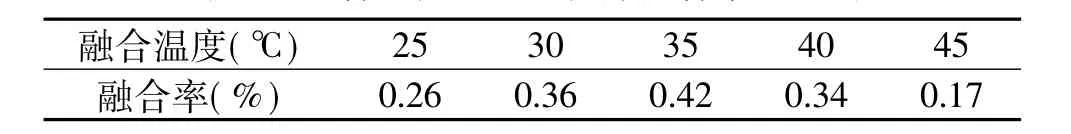
表6 融合温度对原生质体融合率的影响
由表6可以看出,美国大灵芝和信州灵芝融合时,温度为35℃可以使融合率达到最高。
适当的融合温度一方面可以降低PEG溶液的黏度,使原生质体比表面增加,增加原生质体相互之间的接触面积,另一方面也能够使细胞膜的流动性增加,使之有利于原生质体的融合。
2.2.4 时间对原生质体融合率的影响 美国大灵芝和信州灵芝融合时采用不同的时间:25、30、35、40、45min,PEG浓度30%,Ca2+浓度为0.03mol/L,温度35℃。结果见表7。
由表7可以看出,美国大灵芝和信州灵芝融合时的融合时间为30min可以使融合率达到最高。
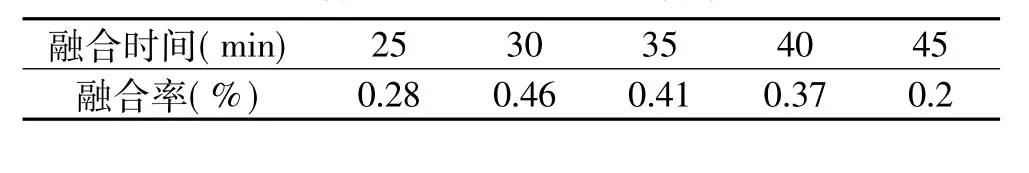
表7 融合时间对原生质体融合率的影响
融合时间过短,则原生质体之间不能得到充分融合,融合率低;时间过长,由于PEG对原生质体有一定毒性,影响原生质体的活性,融合率降低。因此要选择适宜的融合时间。
2.2.5 融合子的再生及融合率 融合子再生选择完全再生培养基,在最适生长温度28℃下,于恒温培养箱中静置培养,观察生长情况并记录培养皿上生长出的融合菌落数目。由此得出,美国大灵芝和信州灵芝在最佳融合条件下的融合率为0.47%。
3 结论
3.1 美国大灵芝原生质体制备的最佳条件:培养4d的菌丝球,复合酶液酶解3h,酶解温度31℃,原生质体制备率为5.80×106个/mL,再生率为0.32‰。
3.2 信州灵芝原生质体制备的最佳条件:培养5d的菌丝球,复合酶液酶解2.5h,酶解温度31℃,原生质体制备率为4.71×106个/mL,再生率为0.24‰。
3.3 两种原生质体融合的最佳条件为:PEG浓度30%,Ca2+浓度 0.03mol/L,温度为 35℃,时间为30min,融合率为0.47%。
[1]张晓云,杨春清.灵芝的化学成分和药理作用[J].国外医药:植物药分册,2006,21(4):152-155.
[2]程星烨,石钺.灵芝活性成分的提取与检测[J].食品研究与开发,2007,28(5):170-173.
[3]肖信发.微生物原生质体融合与菌种选育[J].抗生素,1983,8(4):261-265.
[4]徐新丽,谢必峰.深黄被孢霉3.3410原生质体的制备和再生研究[J].生物技术,2009,19(2):46-48.
[5]李蕤,马守能,刘群,等.香菇菌丝原生质体制备及融合条件的研究[J].安徽大学学报:自然科学版,2001,25(3):99-103.
[6]贺建超,霍奕.侧耳属种间原生质体融合的研究[J].食品科学,2004(2):11-12.
[7]曹文芩,郭顺星,徐锦堂,等.灵芝原生质体融合子多糖成分的研究[J].中国中药杂志,1998,23(7):396-397.
Research on preparation and fusion of Ganoderma lucidum protoplasts
MIAO Jing-zhi,LV Zhao-qi,DONG Yu-wei
(College of Food Biology Engineering,Xuzhou Institute of Technology,Xuzhou 221008,China)
The time and the temperature of treatment of enzyme were studied to find out the effects on formation and regeneration of protoplasts of big Ganoderma lucidum of America and Ganoderma lucidum of Shinshu.The following conclusions were obtained:The optimum conditions for formation and regeneration of protoplasts of big Ganoderma lucidum of America were obtained by using 4-day-cultured mycelia,the enzyme mixed with 2%lywallzyme,1%snailase and 1%cellulase,temperature of treatment of enzyme was 31℃,time of treatment of enzyme was 3h,regenerated by CYM,the rate of formation was 5.80×106/mL,the rate of regeneration was 0.32‰.The optimum conditions for formation and regeneration of protoplasts of Ganoderma lucidum of Shinshu were obtained by using 5-day-cultured mycelia,the enzyme mixed with 2%lywallzyme,1%snailase and 1%cellulase,temperature of treatment of enzyme was 31℃,time of treatment of enzyme was 2.5h,regenerated by CYM,the rate of formation was 4.71×106/mL,the rate of regeneration was 0.24‰.The suspension of protoplasts were regulated into same concentration and being mixed,using different concentrations of PEG 4000,changing different concentrations of Ca2+,using different time and temperature on fusion.The optimum conditions on fusion were:concentration of PEG was 30%,concentration of Ca2+was 0.03mol/L,time on fusion was 30min,temperature on fusion was 35℃,and the fusion frequency was 0.47%.
big Ganoderma lucidum of America;Ganoderma lucidum of Shinshu;protoplast fusion;fusant
TS201.1
A
1002-0306(2011)06-0198-03
2010-04-16
苗敬芝(1964-),女,副教授,研究方向:食品生物技术。
江苏省教育厅高校自然科学研究计划指导项目(08KJD18002)。
