锌精矿酸浸液H2O2法净化除铁试验研究
2011-09-27龙小艺罗六保饶春华
龙小艺,罗六保,饶春华
(1.江西农业大学理学院,江西南昌 330045;2.江西应用技术职业学院应用化学系,江西赣州 341000;3.江西宁冈中学,江西井冈山 343500)
锌精矿酸浸液H2O2法净化除铁试验研究
龙小艺1,罗六保2,饶春华3
(1.江西农业大学理学院,江西南昌 330045;2.江西应用技术职业学院应用化学系,江西赣州 341000;3.江西宁冈中学,江西井冈山 343500)
研究了用H2O2从锌精矿酸浸液中除铁。锌精矿酸浸液除铁工艺条件为:温度控制在90℃,溶液p H控制在3.0~4.0之间,H2O2体积分数25%,连续反应2.5 h后过滤。结果表明,滤液中铁离子质量浓度降至0.08 g/L左右,达到净化要求。
锌精矿;过氧化氢;铁离子;净化
我国锌产品产量及其年均递增率连续多年居世界首位[1]。近年来,全湿法处理锌精矿工艺获得快速发展,但涉及分离净化的工艺研究较少。目前,锌精矿浸出液的主要净化方法有黄钾铁矾法[2]、针铁矿法[3]、赤铁矿法[4]、高锰酸钾法[5]等。针铁矿法利用空气将Fe2+氧化成Fe3+,其氧化速率相对较小。若采用KMnO4法净化,KMnO4加入量较难准确控制,且当KMnO4过量时,由于KMnO4易被还原会导致引入新的杂质离子Mn2+;而KMnO4加入量不足时,酸浸液中的铁离子浓度将难以达到净化除铁要求。H2O2净化剂可避免引入任何新的杂质离子,且生成的还原产物H2O不会产生任何干扰,因此,H2O2净化锌精矿浸出液工艺较为环保。
1 试验部分
1.1 试验原料
试验所用锌精矿取自湖南某大型国有矿企,其酸浸液主要化学成分为(g/L):Zn 79.74,Fe 12.83,Cu 1.64,Cd 0.96,Ni 0.56,Co 0.68。
1.2 试验方法
取少量过滤后的锌精矿酸浸液,调整p H在3.0~4.0之间,加入足量过氧化氢溶液,快速搅拌,待反应一定时间后过滤,以分光光度法测定滤液中铁离子浓度。
加入过氧化氢将溶液中的Fe2+氧化为Fe3+,Fe3+在p H3.0~4.0条件下发生水解,形成FeOOH沉淀,过滤后即可除去。反应如下:
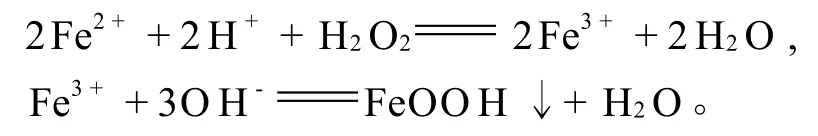
1.3 试验试剂及仪器
试验所用试剂:EDTA(分析纯),H2O2(分析纯)。所用仪器:玻璃烧杯,恒温电热套,真空抽滤泵,p Hs-3C精密酸度计,722型分光光度计。
2 结果与讨论
2.1 反应温度对过氧化氢除铁的影响
准确调整锌精矿酸浸液p H值在3~4范围内,在不同温度下将体积分数25%的H2O2溶液分批加入酸浸液中,反应90 min,考察温度对H2O2除铁的影响。结果如图1所示。
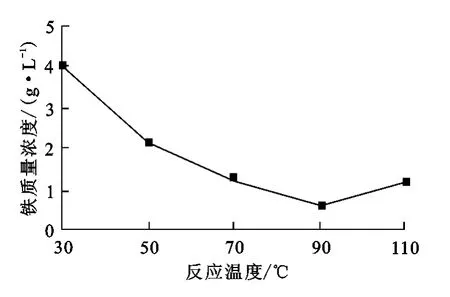
图1 反应温度对H2O2除铁的影响
从图1看出:反应温度越高,越有利于除铁;但温度超过90℃时,浸出液中铁离子质量浓度反而增大,这可能是H2O2分解造成自身浓度降低所致。
2.2 酸浸液pH对过氧化氢除铁的影响
将体积分数25%的H2O2溶液分批加入酸浸液中,反应时间90 min,反应温度恒定为90℃,考察酸浸液p H值对H2O2除铁的影响。试验结果如图2所示。

图2 浸出液pH对H2O2除铁的影响
由图2可看出:浸出液p H值较小时,有利于Fe2+氧化为Fe3+,但不利于Fe3+转化生成针铁矿沉淀;p H值在3~4范围内,浸出液中铁离子质量浓度趋于相对稳定,表明在此p H条件下有利于除铁。
2.3 反应时间对过氧化氢除铁的影响
将体积分数25%的H2O2溶液分批加入酸浸液中,控制酸浸液p H值为3.0~4.0,反应温度恒定为90℃,考察反应时间对H2O2除铁的影响。试验结果如图3所示。
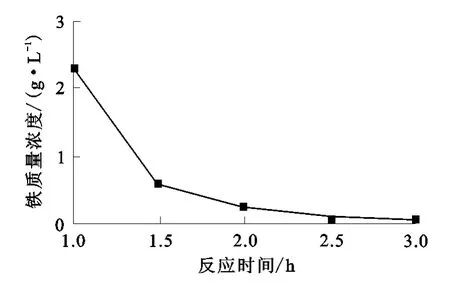
图3 反应时间对H2O2除铁的影响
由图3可看出:反应时间越长,沉淀越完全;反应进行至2.5 h,浸出液中铁离子质量浓度仅为0.12 g/L,之后变化很小。因此,反应时间定为2.5 h较为合理。
2.4 过氧化氢体积分数对除铁的影响
将不同体积分数的H2O2溶液分批加入酸浸液中,酸浸液p H值控制在3.0~4.0之间,反应温度90℃,反应时间2.5 h,考察H2O2体积分数对除铁的影响。试验结果如图4所示。
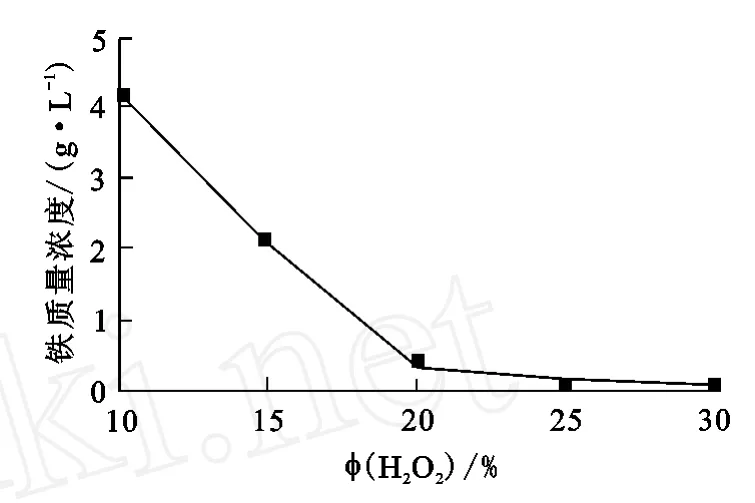
图4 H2O2体积分数对除铁的影响
从图4可看出:随H2O2溶液体积分数的升高,浸出液中铁离子浓度不断下降;当H2O2体积分数提高至25%时,溶液中铁离子浓度降至0.08 g/L,基本达到要求。
3 结论
综上所述,H2O2法净化除铁工艺具有一些优点:还原产物H2O不干扰除铁;除铁效果较好;反应条件易于控制;不引入其他杂质离子。锌精矿酸浸液合理的除铁工艺条件为:确定反应温度90℃,浸出液p H 3.0~4.0,氧化时间2.5 h,H2O2体积分数为25%。在此条件下,酸浸液中铁离子浓度可降至0.08 g/L左右,除铁后的溶液可转入下一工序操作。
[1] 《铅锌冶金学》编委会.铅锌冶金学[M].北京:科学出版社,2003:14.
[2]宋焕笔,胡业藏.用黄钾铁钒法从某铀矿浓酸浸出液中除铁的研究[J].铀矿冶,1997,16(1):13-18.
[3]陈松,安然,李继洲,等.镍精矿氯气浸出液净化除铁工艺[J].中南工业大学学报,2000,31(5):419-421.
[4] 马荣骏.热酸浸出针铁矿除铁湿法炼锌中萃取法回收铟[J].湿法冶金,1997,16(2):58-61.
[5] 吴建宁,蔡会武,郭红梅,等.从含铁硫酸铝中除铁[J].湿法冶金,2005,24(3):155-158.
Abstract:Removing of iron ion from acidic leaching solution of zinc ores with hydrogen peroxide has been studied.The test results show that at the optimum conditions of reaction temperature of 90℃,p H value of 3.0 to 4.0,reaction time of 2.5 h and volume fraction of 25%for hydrogen peroxide,iron ion mass concentration in filtration liquid falls to 0.08 g/L and conforms to the requirement.
Key words:zinc ore concentrate;hydrogen peroxide;iron ion;depuration
Experiments on Removing of Iron Ion From Acidic Leaching Solution of Zinc Ores With Hydrogen Peroxide
LON G Xiao-yi1,LUO Liu-bao2,RAO Chun-hua3
(1.School of Sciences,J iangxi A gricultural University,N anchang,J iangxi 330045,China;2.A pplied Chemistry Department,Jiangxi College of A pplied Technology,Ganzhou,Jiangxi 341000,China;3.N inggang High School,J inggangshan,J iangxi 343500,China)
TF803.25
A
1009-2617(2011)01-0068-03
2010-05-04
龙小艺(1972-),男,江西吉安人,硕士,讲师,主要从事材料化学教研工作,在核心期刊已发表论文5篇。
