甘蔗渣纤维素降解菌的筛选及鉴定
2011-09-25贺军军罗萍陈永辉易润华李勤奋戴小红
贺军军,罗萍,陈永辉,易润华,李勤奋,戴小红
(1.中国热带农业科学院湛江实验站,广东湛江524013;2.广东海洋大学,广东湛江524088; 3.中国热带农业科学院环境与植物保护研究所,海南儋州571737)
甘蔗渣纤维素降解菌的筛选及鉴定
贺军军1,罗萍1,陈永辉1,易润华2,李勤奋3*,戴小红1
(1.中国热带农业科学院湛江实验站,广东湛江524013;2.广东海洋大学,广东湛江524088; 3.中国热带农业科学院环境与植物保护研究所,海南儋州571737)
通过利用多种选择性培养基,从自然发酵不同阶段的甘蔗渣中分离到多种纤维素分解菌,经过初筛和复筛,获得了降解纤维素的功能菌株c1g3-3及其最适功能培养基蛋白胨纤维素培养基(PCS),并通过形态、生理生化和分子综合鉴定得出c1g3-3鉴定为木糖氧化无色杆菌(Achromobacter xylosoxidans)。
甘蔗渣;纤维素;功能降解菌
甘蔗是我国大宗的糖料经济作物,在我国热区的经济中占有重要地位,是广西和云南的主要产业。甘蔗渣是甘蔗榨糖后的主要副产品,属于农业固体废弃物,主要组分:干物质90%~92%,粗蛋白质2.0%,粗纤维44%~46%,粗脂肪0.7%,无氮浸出物42%,粗灰分2%~3%[1],如果不加以处理或利用会造成环境污染和资源浪费。因此,甘蔗渣的利用一直受到重视[2-8]。近几年,随着生物有机肥的快速发展,甘蔗渣成为生物有机肥堆制原料而受到重视,并配置成有机肥在农业上得到应用[9]。然而,由于甘蔗渣中纤维素、半纤维素和木质素含量高(占90%以上),降解速度慢、堆肥时间长,造成严重环境污染,成为肥料化利用的制约因素和研究重点。本文从甘蔗渣资源化利用的角度出发,通过对多种分离源的微生物进行分离、纯化和筛选,得到了快速降解甘蔗渣纤维素功能降解菌株,并对其生理特性及其培养条件进行探讨,以期为工厂化应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 分离材料采集用于分离的甘蔗渣采自广东省丰收糖业发展有限公司堆积场中。
1.1.2 供试分离和筛选培养基①样品分离采用4种培养基,具体如下:赫奇逊CMC培养基(C1):NaCl 0.1 g,KH2PO41 g,MgSO4·7H2O 0.3 g,FeCl30.01 g,CaCl20.1 g,NaNO32.5 g,CMC 10 g,琼脂20 g,蒸馏水1 L,pH 7.2~7.4;赫奇逊CMC-Na培养基(C2):NaCl 0.1 g,KH2PO41 g,MgSO4·7H2O 0.3 g,FeCl30.01 g,CaCl20.1 g,NaNO32.5 g,CMC-Na 10 g,琼脂20 g,蒸馏水1 L,pH 7.2~7.4;纤维素刚果红平板培养基(C3): (NH4)2SO42 g,MgSO4·7H2O 0.5 g,KH2PO41 g,NaCl 0.5 g,CMC-Na 10 g,琼脂20 g,刚果红0.2 g,蒸馏水1 L,pH值自然;纤维素刚果红平板培养基(C4):(NH4)2SO42 g,MgSO4·7H2O 0.5 g,KH2PO41 g,NaCl 0.5 g,CMC 10 g,琼脂20 g,刚果红0.2 g,蒸馏水1 L,pH值自然;②功能菌株筛选培养基,具体如下:Dubos纤维素培养基: NaNO30.5 g,K2HPO41 g,Fe2(SO4)3·7H2O 0.001 g,CMC 5 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,蒸馏水1 L,pH 7.5;Hutchison培养基:NaNO32.5 g,NaCl 0.1 g,KH2PO41 g,MgSO4·7H2O 0.3 g,FeCl30.01 g,CaCl20.1 g,CMC 5 g,蒸馏水1 L,pH 7.2~7.4;磷酸铵钠培养基:Na(NH4)HPO42 g,CaCO35 g,KH2PO41 g,CaCl2·6H2O 0.3 g,MgSO4·7H2O 0.5 g,蛋白胨1 g,蒸馏水1 L,纤维素5 g;蛋白胨纤维素培养基:NaCl 5 g,CaCO32 g,K2HPO40.5 g,MgSO40.5 g,刚果红0.1 g,蛋白胨5 g、酵母膏5 g,纤维素5 g,微量元素溶液0.5 mL(微量元素液成分(g/L):ZnSO40.30,CaCl20.25,CuSO40.25,FeSO40.20),蒸馏水1 L,50℃静置培养;改良纤维素刚果红培养基(g/L):NaCl 0.5,(NH4)2SO42,MgSO4·7H2O 0.5,KH2PO41,纤维素粉5,蛋白胨1,蒸馏水1 L,pH值自然; CMC培养基:(NH4)2SO44 g,KH2PO42 g,CMCNa 5 g,MgSO4·7H2O 0.5 g,蛋白胨1 g,蒸馏水1 L,pH 7.0~7.4。
1.2 方法
1.2.1 纤维素降解菌的分离采用平板稀释法进行分离。称取甘蔗渣样品1.00 g,加入无菌水10 mL,在振荡机上振荡10 min,形成悬液,吸取1 mL悬液依10倍法稀释到10-6,取10-6稀释液0.1 mL涂布于分离培养基中,每处理重复3次,28℃培养72~96 h,计算菌落数。根据菌落形态、颜色等挑取单菌落,按常规方法纯化后保存。
1.2.2 纤维素功能降解菌的筛选菌株初筛采用滤纸分解法,将滤纸剪成小条,放入试管中,使其略露出液面。将各菌株接种到以滤纸为唯一碳源的Dubos液体培养基中,然后于30℃、110 r/ min振荡培养5 d,观察滤纸的崩解效果;在初筛的基础上,以FPA酶(3.5-乙硝基水杨酸比色法测定)为评价指标进一步筛选得出纤维素功能降解菌株。
1.2.3 培养基筛选将筛选得到的功能菌株分别接种到菌株筛选培养基中,进行功能培养基的筛选,每个处理3个重复。
1.2.4 菌株鉴定对筛选出的纤维素降解菌进行种的鉴定:①形态学特征鉴定:将筛选出的纤维素降解菌接种于PDA平板中,28℃恒温培养2~3 d,观察其菌落的生长情况、外观形态;②生理生化特征:主要包括过氧化氢酶、苯丙氨酸脱氨酶、卵磷脂酶试验,糖、醇类分解试验,V-P测定,明胶液化,淀粉水解,丙二酸利用,吲哚产生及生长pH值和温度的测定等,方法参考东秀珠《常见细菌系统鉴定手册》[10];③分子鉴定:细菌的16S rRNA分析:经改良的SDS法提取菌株降解微生物的基因组DNA。PCR引物为细菌鉴定通用引物:16(+)5-AGA GTT TGA TCC TGG CTC AG-3,16(-)5-ACG GCT ACC TTG TTA CGA CT-3。25 μL扩增体系:模板2 μL,上游引物1 μL,下游引物1 μL,10×buffer 2.5 μL,MgCl2(25 mmol/L) 2.5 μL,DNTP(2 mmol/L)2.5 μL,Taq(3 U/μL) 0.35 μL,ddH2O 13.15 μL。
将提取的基因组DNA作为模板进行PCR扩增。反应程序:94℃预变性4 min,94℃变性1 min,50℃复性30 s,72℃延伸30 s,进行35个循环,72℃延伸10 min。PCR产物在1%琼脂糖凝胶电泳标准条件下检测,回收目标DNA片段,由生工生物工程(上海)有限公司完成测序,测序结果用BLAST软件在GenBank进行同源性比较,以Clustal X进行多序列比对后,用MEGA4.0的Neighbor-Joining法构建系统发育树,并进行1000次Bootstraps检验。
2 结果与分析
2.1 功能菌株分离
由表1可见,培养基C1最适合分离纤维素降解菌,在样品稀释到10-6时,每个平板可以得到菌落数5.20 cfu/g;其次是C3和C2分离效果较好,分离菌落数分别为3.20和2.80 cfu/g;而C4的分离效果较差。
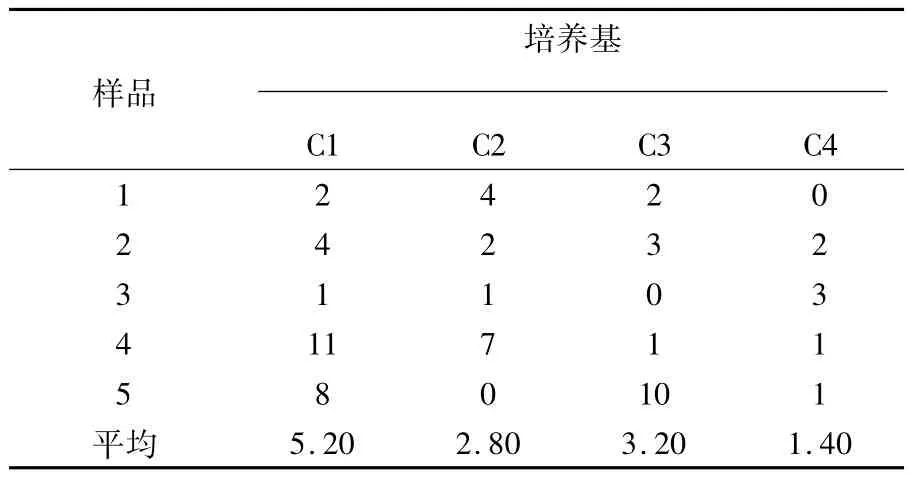
表1 不同培养基纤维素降解菌株分离效果(单位:cfu/g)Table 1Effect of cellulose degradation strains in different mediums(Unit:cfu/g)
2.2 功能菌株初筛
采用滤纸分解法对纤维素降解菌进行初筛,由表2可见,从甘蔗渣中共分离出27个菌株,其中降解能力强的有5个菌株,中度降解能力的有5个菌株,轻微降解能力的有13个菌株及没有任何降解能力的4个菌株。
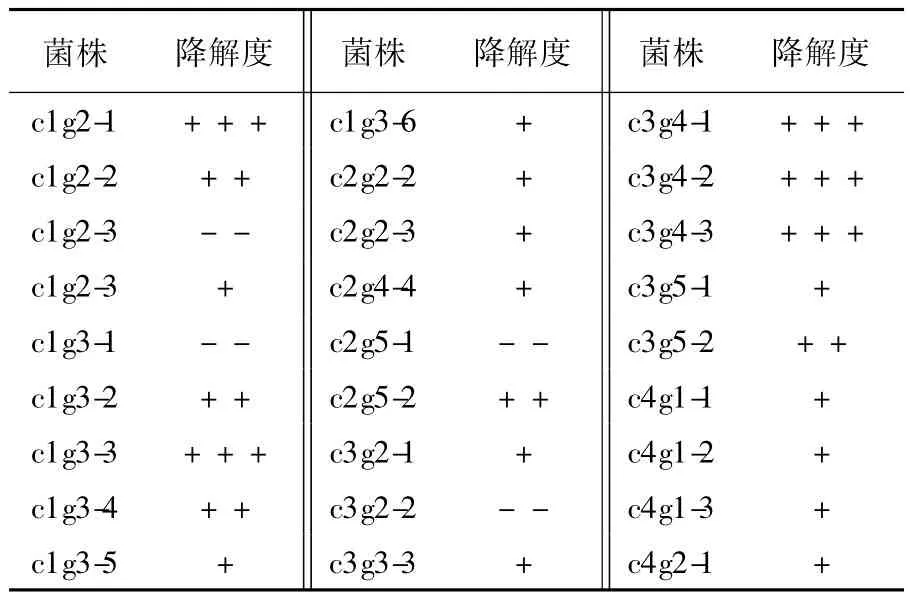
表2 纤维素降解功能菌株初筛Table 2First screening of cellulose degrading-bacteria
2.3 功能菌株复筛
滤纸中的纤维素含量较高,FPA酶水解滤纸中的纤维素,释放出的还原糖与3,5-乙硝基水杨酸(DNS)反应,产生颜色变化,这种颜色变化与释放的还原糖量成正比关系,即与酶样品的酶活性成正比关系。通过对FPA酶活性来评价初筛菌株对纤维素降解能力的大小,从而确定纤维素降解高效菌株。通过实验表明:c1g3-3菌株的FPA酶活性最好,为4.83 μg/(mL·h),被确定为纤维素功能降解菌株(表3)。

表3 纤维素降解功能菌株复筛(单位:μg/(mL·h))Table 3Second screening of cellulose degrading-bacteria (Unit:μg/(mL·h))
2.4 功能培养基筛选
利用功能菌株在不同培养基上的FPA酶活性来评价菌株功能发挥的最适培养基。由表4可知:c1g3-3 FPA酶活性在6种不同培养基表现不一,在蛋白胨纤维素培养基(PCS)上活性最高为54.85 μg/(mL·h)。因此,c1g3-3菌株最适功能培养基为蛋白胨纤维素培养基(PCS)。

表4 功能菌株在不同培养基上FPA酶活(单位:μg/(mL·h))Table 4FPA enzyme activity of degrading-bacteria in different mediums(Unit:μg/(mLl·h))
2.5 高效菌株鉴定
2.5.1 表面形态特征及生理生化指标c1g3-3菌株菌落颜色黄白色,表面湿润、光滑,边缘不整齐;杆菌,革兰染色显阴性,周生鞭毛,轻微弯曲的杆状,大小为0.55 μm×1.58 μm,菌株生理生化测定结果见表5。
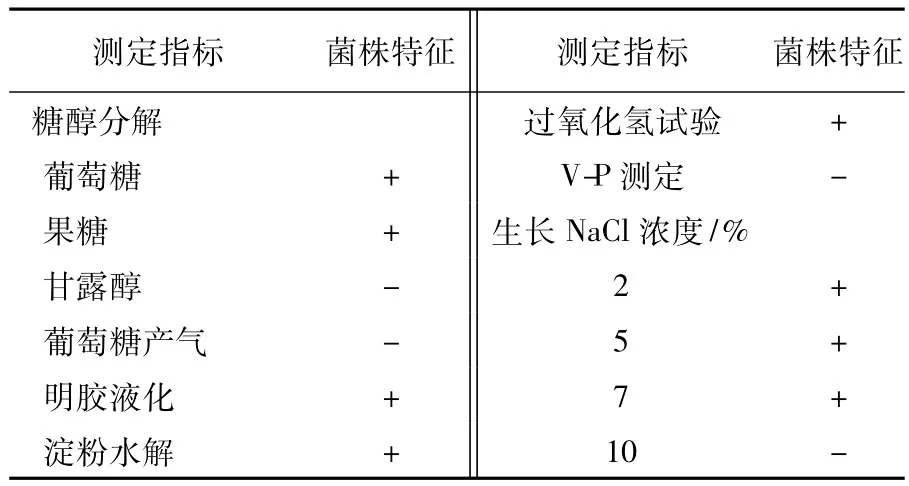
表5 c1g3-3菌株的生理生化特征Table 5Physiological and biochemical characteristics of c1g3-3 strain

续表
2.5.2 分子鉴定c1g3-316S rDNA碱基长度为1.5 bp左右,将菌株的16S rDNA全序列输入GenBank核酸序列数据库进行比对,发现与无色杆菌属(Achromobacter xylosoxidans)之间的同源性达到99%。选取近缘的菌株序列通过N-J算法构建系统进化树(图1),将其初步定为木糖氧化无色杆菌(Achromobacter xylosoxidans)。
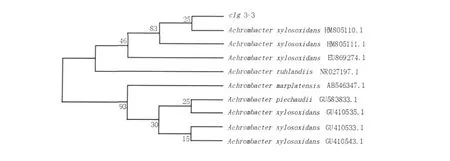
图1 c1g3-3菌株16S rDNA序列系统发育树Fig.1Phytogenetic tree based on the 16S rDNA sequence of c1g3-3 strain
3 小结与讨论
本文以甘蔗渣堆肥所需菌剂的开发为主,通过对多种分离源的纤维素降解菌进行分离、纯化和筛选,从甘蔗渣中获得了2株纤维素降解功能菌,并对其进行了最佳培养基的筛选与鉴定。通过试验得出以下结论:①利用多种选择培养基,经过初筛和复筛,从自然发酵不同阶段的甘蔗渣中获得了纤维素功能降解菌株c1g3-3;②c1g3-3菌株最适功能培养基为蛋白胨纤维素培养基(PCS);③通过形态、生理生化和分子综合鉴定得出c1g3-3鉴定为木糖氧化无色杆菌(Achromobacter xylosoxidans)。
[1]聂艳丽,刘永国,李娅,等.甘蔗渣资源利用现状及开发前景[J].林业经济,2007,(5):61-63.
[2]邹君,凌秀琴,梁丽明,等.甘蔗渣制备废水处理剂纤维素黄原酸酯的研究[J].广西纺织科技,2005,34(2):21-23.
[3]黄钟,陈中豪,党酉胜.蔗渣喷淋废水处理研究[J].工业用水与废水,2003,34(5):25-28.
[4]周林,郭祀远,蔡妙颜.蔗渣的生物利用[J].中国糖料,2004,(2):40-42.
[5]Syna N,Valix M.Modelling of gold(I)cyanide adsorption based on the properties of activated bagasse[J].Minerals Engineering,2003,16(5):421-427.
[6]崔志敏,罗儒显,朱锦瞻.甘蔗渣纤维素磷酸酯的合成与应用研究[J].精细化工,2001,18(12):609-702.
[7]涂启梁,付时雨,詹怀宇.甘蔗渣综合利用的研究进展[J].中国资源综合利用,2006,24(11):13-16.
[8]高星超,盛家荣,赵星华.甘蔗渣的研究进展[J].广西师范学院学报(自然科学版),2007,24(4):100-105.
[9]韦建玉,曾祥姬,王军.甘蔗渣在烤烟漂浮育苗中的应用研究[J].中国烟草科学,2006,27(1):42-44.
[10]东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001:62.
Screening and Identification of Cellulose Degrading-Bacteria from Fermented Bagasse
HE Jun-jun1,LUO Ping1,CHEN Yong-hui1,YI Run-hua2,LI Qin-fen3,DAI Xiao-hong1
(1.Zhanjiang Res.Sta.,CATAS,Zhanjiang 524013;2.Guangdong Ocean Uni.,Zhanjiang 524088; 3.Inst.of Envir.&Plant Prot.,CATAS,Danzhou Hainan,571737)
Several cellulose degrading-bacteria were isolated form naturally fermented bagasse at different stages using multiple selective media.Strain c1g3-3,which had the capability of degrading cellulose of bagasse,was obtained through preliminary and secondary screenings,as well as the optimal PCS medium.Strain c1g3-3 was identified as Achromobacter xylosoxidans according to its morphology,physiology,bio-chemical and molecular characteristics.
bagasse;cellulose;functional degrading-bacteria
Q939.97
A
1005-7021(2011)01-0039-04
中央级公益性科研院所基本科研业务费专项(2008hzslJ021,2009hzs1J033)
贺军军男,研究实习员。研究方向为资源开发与利用。Tel:0759-2192696,E-mail:hbj46@163.com
*通讯作者。Tel:0759-2192696,E-mail:qinfenli@sina.com
2010-12-15;
2011-01-25
