壳聚糖缓释微球的制备与表征
2011-09-24赵书言周浩然
赵书言,周浩然,赵 蕊
(哈尔滨理工大学 材料科学与工程学院,黑龙江 哈尔滨150040)
壳聚糖缓释微球的制备与表征
赵书言,周浩然,赵 蕊
(哈尔滨理工大学 材料科学与工程学院,黑龙江 哈尔滨150040)
以壳聚糖(Chitosan)、戊二醛(Glutaraldehyde)、尿素(Urea)为主要原料,采用乳化—化学交联法制备尿素—壳聚糖缓释微球。通过红外光谱测试,分析缓释微球的结构特征;通过扫描电镜测试,观察微球的微观形貌;通过交联度测试确定戊二醛的最佳用量;通过缓释测试,测定壳聚糖微球的缓释效果。结果表明:采用乳化—化学交联法成功制备尿素—壳聚糖缓释微球;交联剂最佳用量为1mL;缓释微球中尿素在48h后基本缓释完全,表明制备的缓释微球有良好的缓释效果。
壳聚糖;微球;缓释
Abstract:The urea-chitosan sustained release microspheres are prepared with using chitosan,glutaraldehyde and urea as the main raw materials by emulsification-chemical crosslinking method.The structural characteristics of sustained release microspheres are studied by infrared spectra.The micro-morphology of microspheres is observed by scanning electron microscopy.The optimum dosage of glutaraldehyde is determined by the test of cross-linking degree.The sustained release effect is measured by sustained release measurement.The results showed that the chitosan sustainedrelease microspheres were successfully prepared by emulsification-chemical crosslinking method,the optimum dosage of crosslinking agent was 1mL.Urea in sustained release microspheres released completely after 48h.It indicated that the sustained release microspheres had good sustained release effect.
Key words:Chitosan;microspheres;sustained release
引 言
随着我国农业的发展,化肥需求量不断增多,目前使用的化肥以速效肥料为主,虽然肥效快,但利用率较低,同时会造成环境污染[1]。缓释型肥料,可以较好控制肥料养分的释放速度,提高肥料利用率,有效防止肥料养分流失,从而达到减少施肥次数,延长肥效期,提高肥效的作用,因而该种肥料在农业中应用前景广阔[2,3]。壳聚糖(chitosan)是由自然界中广泛存在的几丁质(chitin)经过脱乙酰作用得到的,化学名称为聚葡萄糖胺[(1-4)-2-氨基-B-D葡萄糖][4]。壳聚糖具有可降解、安全无毒、可抑菌抗菌、良好的透过性等诸多的优点,目前人们已视它为一种良好的缓释材料,并且广泛应用于医药、化工、农业等各个领域。本文以壳聚糖和尿素为主要原料制备尿素—壳聚糖缓释微球,并对微球进行结构表征及缓释效果测试。
1 实验部分
1.1 实验主要药品及仪器
壳聚糖,化学纯,上海化学试剂厂;戊二醛,分析纯,天津瑞金特化学品有限公司。尿素,分析纯,天津市石英钟厂霸州市化工分厂;对二甲氨基苯甲醛(PDAB),分析纯,天津光复精细化工研究所。
721型分光光度计,上海精密科学仪器厂;EQUINOX-55型傅立叶变换红外光谱,德国布鲁克公司;FEI Sirion200型扫描电子显微镜,荷兰菲利普公司。
1.2 壳聚糖微球的制备
本实验采用乳液聚合的方法制备壳聚糖微球:首先,用浓度为2%(体积比)的冰乙酸溶液溶解壳聚糖,配制成一定浓度的壳聚糖溶液。其次,合成乳化体系,量取20mL壳聚糖溶液,向其中加入占壳聚糖质量20%的尿素,混合均匀待用;将一定量Span-80加入100mL液体石蜡中,搅拌均匀后将备用壳聚糖溶液缓慢加入其中(约30min加完),在40℃恒温水浴中搅拌30min,整个乳化过程中搅拌速度保持在800~1000r/min,以使体系均匀。然后,向乳化体系中加入一定量交联剂戊二醛,保持40℃,搅拌反应3h。交联反应结束后,静置30min,待完全分层后除去上层液。下层物质分别用石油醚和异丙醇洗涤3次,然后在50℃下烘干,即得黄色壳聚糖微球。
壳聚糖与戊二醛发生交联反应的原理如下:

1.3 壳聚糖微球的表征与测试
采用红外、扫描电镜、交联度测试及缓释测试对壳聚糖微球进行表征。
1.3.1 红外光谱表征
采用KBr压片法制样,用红外光谱仪对壳聚糖微球进行红外测试,分辨率:8cm-1。
1.3.2 扫描电镜表征
将待测微球均匀分散于贴有导电胶的铅块上,使用扫描电子显微镜观察微球的形貌。
1.3.3 交联度测试
准确称取一定质量W1微球,置于索氏萃取器的萃取管中,用浓度为0.5%的冰乙酸溶液萃取24h后,烘干至恒重后质量W2。交联度可由以下公式算出:C=W2/W1×100%
1.3.4 缓释测试
(1)显色剂的配制
准确称取7.250gPDAB,溶于300mLH2SO4溶液(C=4.0mol/L)中,定容至500mL,摇匀,贮存于棕色瓶中,放于暗处保存,备用。
(2)尿素标准试液的配制
准确称取0.500g尿素,溶于去离子水中,定容至250mL。用移液管分别移取 2.5mL、5.0mL、10.0mL、15.0mL、20.0mL、25.0mL至50mL容量瓶中,分别加入10mL配置好的PDAB溶液,用去离子水定容至50mL,配制六个标准尿素溶液,浓度分别为0.1g/L、0.2g/L、0.4g/L、0.6g/L、0.8g/L、1.0g/L。再单独取 10mL的显色剂稀释至50mL作为参比物。用721型分光光度计在420nm处测定其吸光度,作线性回归分析。
(3)尿素缓释量的测定
将待测微球用筛网包裹好置于容器中,并向其中加入去离子水。每隔一段时间从去离子水中取出10mL移入50mL容量瓶中,加入10mL显色剂,定容。并在容器中补加10mL去离子水。
用721型分光光度计在波长420nm处测定吸光度,由标准线性回归方程求得未知液浓度[5]。
2 结果与讨论
2.1 红外光谱测试
图1分别为壳聚糖微球、尿素—壳聚糖微球、纯壳聚糖和尿素在4000~400cm-1区域的FTIR谱图。尿素的特征峰:3300~3500cm-1处的双峰为N-H伸缩振动,1618cm-1处的峰是为C=O键伸缩振动,如图1 中 d。由图 1 中 a、b 可见,2930cm-1、2860cm-1、1460 cm-1的吸收峰有明显增强,说明产物中有较多的C-H生成,尤其在2930 cm-1处最为明显;与纯壳聚糖光谱c比较可知,由于交联剂戊二醛的加入,削弱了壳聚糖在1645 cm-1和1578 cm-1处的酰胺峰,在1640 cm-1左右出现C=N的伸缩振动峰,此峰是戊二醛与壳聚糖交联后所形成的Schiff碱的特征峰[6]。在500cm-1后,比较图中b与a、c、d可知,尿素包埋于微球中。通过FTIR分析可知,戊二醛与壳聚糖发生交联反应,且尿素成功包埋于壳聚糖中。
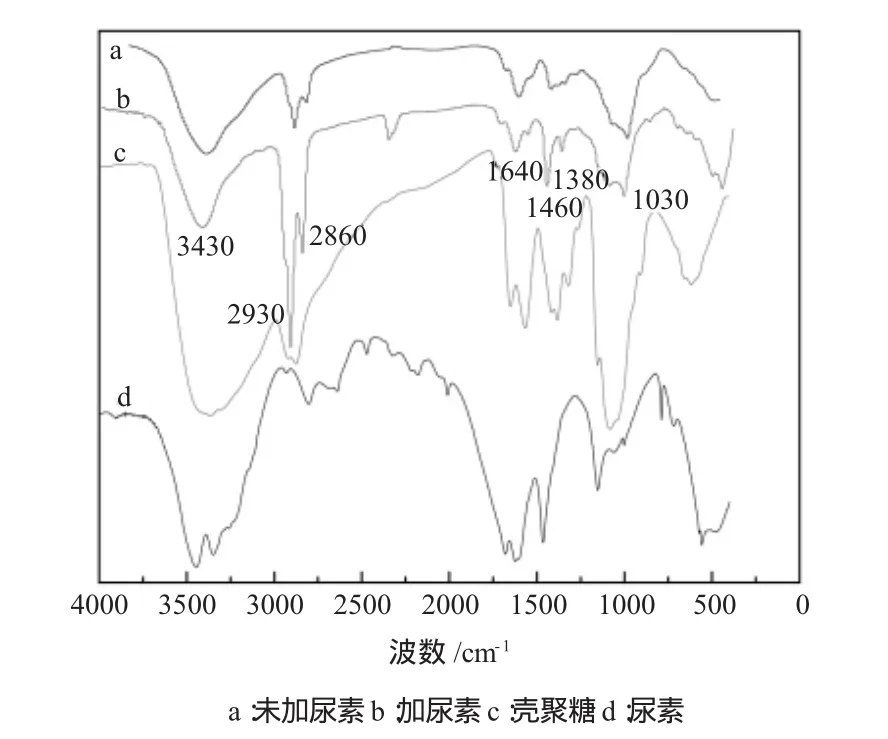
图1 戊二醛交联壳聚糖微球红外光谱Fig.1 FTIR spectra of chitosan microspheres with glutaraldehyde cross-linking
2.2 扫描电镜测试
图2是放大5000倍的壳聚糖微球扫描电镜图。

图2 交联壳聚糖微球扫描电镜图样Fig.2 SEM image of cross-linking chitosan microspheres
由图2看出,壳聚糖经过交联后形成微球结构。图a微球直径约为1μm;图b微球直径约为1.5μm。由此可见,加入尿素后,由于微球中包裹了尿素,壳聚糖微球的体积有明显的增加。未加入尿素的壳聚糖微球,球形较规整,只有少量的团聚现象。加入尿素后,其球状结构稍有变形,有粘连现象产生,同时团聚现象明显。尿素分子进入壳聚糖分子内,使分子链增长分子体积增大,致使交联反应后微球体积增大。微球表面的粘连现象,可能是由于微球表面的静电吸附作用,或者是干燥过程中分子间的团聚造成。
2.3 交联度测试
滤纸经0.5%乙酸溶液萃取后,其质量减少率为1.30%。经计算得出加入不同体积戊二醛的壳聚糖微球的交联度,得出戊二醛加入量与交联度的关系如图3所示。
由图3可知,壳聚糖微球交联度随着戊二醛用量的增加而增大,戊二醛用量在0.7~1.3mL之间变化时,曲线平稳上升。当戊二醛用量从1.3mL开始增加时,曲线斜率变大,交联度急剧增加,当戊二醛用量为1.6mL时,交联度最大。戊二醛结构中存在着两个活泼的醛基,有很高的反应活性,易与壳聚糖分子中的自由氨基反应,形成交联的网状结构。交联程度越大,说明戊二醛与壳聚糖之间的反应越充分,效果最好。但若交联度过大,整个微球分子中空间网状结构越多,交联孔径越小,对尿素的包裹越紧密,不利于缓释。所以确定戊二醛用量为1.0mL为最佳用量。

图3 戊二醛用量与交联度关系图Fig.3 The relationship between the dosage of glutaraldehyde and crosslinking degree
2.3 缓释测试
2.3.1 标准曲线绘制
经线性拟合所得氮元素标准曲线见图4:

图4 氮元素的标准曲线Fig.4 The standard curve of nitrogen element
由图4得氮元素标准曲线为:A=0.20886C+4.56201×10-4
式中 A—吸光度;
C—尿素浓度(g/L)。
2.3.2壳聚糖微球缓释结果
缓释测试结果如图5所示:
由图5可知,缓释溶液中尿素的含量随着缓释时间的增加而增大,时间在0~24h,缓释微球中尿素快速释放,氮元素释放量急剧增大,产生明显的突释效应。当24h后曲线变化较为平缓,微球中尿素均匀扩散。在释放初期,尿素的释放主要是受扩散作用的控制。由于微球表面存在大量的微孔,水分子大量进入微孔溶解尿素,使其快速释放,故微球在初期有着明显的突释效应[7]。随着壳聚糖吸水溶胀,在微球的表面形成了亲水的凝胶层,关闭了尿素释放的通道,尿素只能通过骨架缓慢扩散或者通过壳聚糖的缓慢降解而释放;随着缓释时间的延长,微球表面的亲水凝胶层逐渐增厚,微球能缓释尿素的面积逐渐减小,所以此时缓释平稳,尿素继续缓慢释放,直至缓释完全。

图5 壳聚糖微球中氮元素累计释放量随缓释时间的变化曲线Fig.5 The effect of sustained release time on cumulate releasing volume of nitrogen element
3 结论
采用乳化—化学交联法制备尿素—壳聚糖微球,其直径为1.5μm球形较规整的微球结构;IR结果表明壳聚糖与交联剂戊二醛的产生交联反应,交联剂最佳用量为1mL;对壳聚糖缓释微球释放动力学进行初步探讨,尿素—壳聚糖微球的缓释效果良好。由于壳聚糖无毒、易降解、抑菌抗菌和来源广泛等特点,使其作为缓释肥料材料有着广阔应用前景。因此,深入的开展此项研究尤为重要。
[1]陈强,吕伟娇,张文清,等.壳聚糖缓释肥料包膜的制备和结构表征[J].高分子材料科学与工程,2005,21(4):216~209.
[2]李浙江,王金信,连玉朱,等.壳聚糖在农药领域中的应用和前景[J].农药研究,2005,26(6):28~31.
[3]许秀成,李镯萍,王好斌.包裹型缓释/控制释放肥料专题报告[J].磷肥与复肥,2001,16(4):4~6.
[4]蒋挺大.壳聚糖[M].北京:化学工业出版,2006:347~348.
[5]欧阳钊.包膜型缓释尿素用膜材的制备及透肥性研究[D].南京理工大学,2008:26~28.
[6]N R KILDEEVA,P A PERMINOV.About Mechanism of Chitosan Cross-Linking with Glutaraldehyde [J].Russian Journal of Bioorganic Chemistry,2009,35(3):360~369.
[7]王增寿,胡伟,张华,等.多柔比星壳聚糖微球的制备及其特性研究[J].医药导报,2007,26(7):720~723.
The Preparation and Characterization of Chitosan Sustained Release Microspheres
ZHAO Shu-yan,ZHOU Hao-ran and ZHAO Rui
(College of Materials Science and Engineering,Harbin University of Science and Technology,Harbin 150080,China)
TQ 322.94
A
1001-0017(2011)02-0035-04
2010-11-18
赵书言(1985-),女,黑龙江哈尔滨人,硕士生,主要研究方向为改性壳聚糖缓释肥料材料研究。
