水飞蓟素与牛血清白蛋白相互作用的荧光光谱研究
2011-09-24尚永辉孙家娟
尚永辉,孙家娟,刘 静
(咸阳师范学院化学与化工系,陕西咸阳 712000)
水飞蓟素与牛血清白蛋白相互作用的荧光光谱研究
尚永辉*,孙家娟,刘 静
(咸阳师范学院化学与化工系,陕西咸阳 712000)
采用同步荧光光谱技术研究了p H=7.40的 Tris-HCl缓冲体系中水飞蓟素与牛血清白蛋白(BSA)的相互作用以及水飞蓟素对BSA构象的影响.结果表明,水飞蓟素对BSA的荧光猝灭过程为静态猝灭,结合热力学参数△rHm= -45.21 kJ·mol-1,△rSm= -61.61 J·K-1·mol-1;据此可以推断,水飞蓟素与BSA之间主要靠氢键和范德华力相结合,其结合过程为自发反应过程.
水飞蓟素;牛血清白蛋白;相互作用;荧光光谱
Abstract:The interaction between silymarin and bovine serum albumin(BSA)in physiological buffer solution(p H =7.40)as well as the effect of silymarin on the conformation of BSA were studied by means of synchronous fluorescence spectrometry.It was found that silymarin quenched the fluorescence of BSA via a static quenching process,with thermodynamic parameters including enthalpy change(△rHm)and entropy change(△rSm)being-45.21 kJ·mol-1and-61.61 J·K-1·mol-1,respectively.Thus it could be inferred that the interaction between silymarin and BSA was driven mainly by hydrogen bonding and Van der Waals forces,and the binding process was a spontaneous process.
Keywords:silymarin;bovine serum albumin;interaction;fluorescence spectrometry
血清白蛋白是人和动物血清中含量最丰富的一种蛋白质,各种药物进入人体首先与血清白蛋白结合,通过血浆的存储和运输,到达受体部位产生药理作用[1].从不同角度研究蛋白质与具有生物活性小分子间的相互作用对于了解药物的作用机制具有非常重要的意义[2].荧光光谱法是目前研究生物大分子与各种小分子以及离子相互作用的重要手段之一.
水飞蓟素(silymarin)属黄酮类化合物,临床上主要用于肝中毒,肝功能障碍的治疗.近期的研究表明,水飞蓟素具有抗辐射、降血脂的作用,并对8-羟基鸟噪吟造成DNA损伤而引起的肿瘤具有一定的预防和治疗作用;实验在p H=7.40的 Tris-HCl缓冲介质中运用荧光光谱技术研究了水飞蓟素与BSA的相互作用,并对其作用机理进行了初步分析.
1 实验部分
1.1 试剂与仪器
RF-5301型荧光分光光度计 (日本,岛津公司);TB-85型恒温水浴(日本,岛津公司);p HSJ-4A p H计(上海雷磁仪器厂).
牛血清白蛋白(Amresco 0930,分子量65 000),水飞蓟素(中国药品生物制品检定所),p H=7.40的Tris-HCl缓冲溶液.Tris、HCl为分析纯,水为双重蒸馏水.
以 Tris-HCl缓冲溶液为溶剂分别配制浓度均为1.0×10-3mol·L-1的BSA标准溶液和水飞蓟素标准溶液,两种标准溶液都在0~4℃的冰箱中保存.实验所需浓度的溶液由此标准溶液稀释而得.
1.2 实验方法
在10 mL比色管中依次加入p H=7.40的 Tris-HCl缓冲溶液2.0 mL、1.0×10-3mol·L-1BSA溶液0.1 mL以及一定量的水飞蓟素溶液,采用双重蒸馏水稀释至刻线,摇匀,在实验温度下恒温1 h.采用1 cm石英比色皿,以285 nm为激发波长,绘制300~500 nm的荧光光谱和Δ λ=60 nm,Δ λ=15 nm的同步荧光光谱,测定中入射狭缝,出射狭缝宽度均为3 nm.
2 结果与讨论
2.1 荧光猝灭光谱
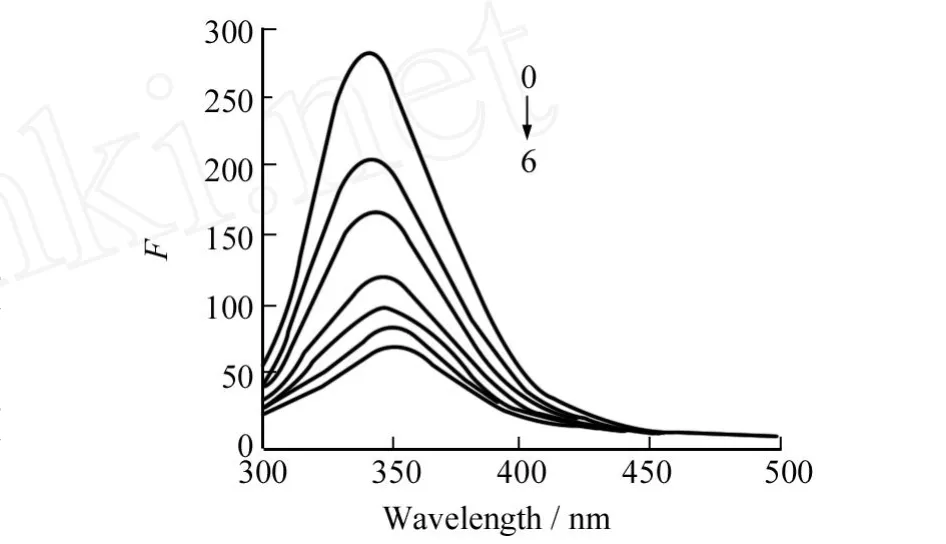
图1 水飞蓟素对BSA荧光光谱的影响Fig.1 Fluorescence spectra of silymarin-BSA
按照1.2方法分别研究了295 K,303 K,310 K,315 K温度下水飞蓟素对BSA的荧光猝灭光谱.310 K的荧光光谱见图1.
由图1可知:随着水飞蓟素浓度的增加,BSA的荧光强度逐渐降低,荧光发射峰逐渐红移(由340 nm红移至352 nm).这是由于BSA中存在的色氨酸和酪氨酸残基,使其具有一定的内源荧光,加入的水飞蓟素与BSA之间的相互作用导致BSA内源荧光强度有规律地降低.
2.2 荧光猝灭机理及猝灭常数的测定
引起BSA荧光猝灭的原因有动态猝灭和静态猝灭两种.二种猝灭过程均遵从Stern-Volmer方程[2],随温度的升高动态猝灭常数逐渐增大,静态猝灭常数逐渐减小,可由此判断荧光猝灭的类型.不同温度下水飞蓟素对BSA荧光猝灭的Stern-Volmer方程及猝灭常数见表1.

表1 不同温度下水飞蓟素对BSA的Stern-Volmer方程及猝灭常数Table 1 Stern-Volmer quenching constant at different temperatures
由表1可知,随温度升高猝灭常数 Kq逐渐减小,表明水飞蓟素对BSA的荧光猝灭过程属于静态猝灭过程.此外,各类猝灭剂对生物大分子的最大动态猝灭速率常数 Kq为2×1010L·mol-1·s-1[3],实验中的四个温度下水飞蓟素对BSA的 Kq大于该值,进一步判断水飞蓟素对BSA的荧光猝灭过程是以静态猝灭为主.
2.3 牛血清白蛋白与水飞蓟素结合反应的热力学性质及作用力
分子间的作用力包括氢键,范德华力,静电引力,疏水作用力等,根据文献[3]计算得到水飞蓟素与BSA结合作用的热力学参数:焓变△rHm为-45.21 kJ·mol-1,熵变△rSm为-61.61 J·K-1·mol-1,自由能变△rGm为-26.11 kJ·mol-1(310 K)和-25.80 kJ·mol-1(315 K).根据Ross[4]等总结出的判断生物大分子与小分子结合力性质的热力学规律,由△rHm<0和△rSm<0推断水飞蓟素与BSA之间结合过程以氢键和范德华力为主.自由能变△rGm<0表明该过程为自发过程.
2.4 水飞蓟素与BSA的表观结合常数 Kb以及结合位点数n
当小分子与大分子结合时其表观结合常数 Kb与结合位点数n由下式求出[5]:
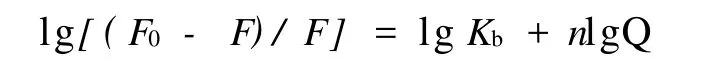
分别绘制不同温度下水飞蓟素与BSA的lg(F0-F)/F~lgQ的双对数图,根据截距和斜率求得相应的Kb和 n,见表 2.
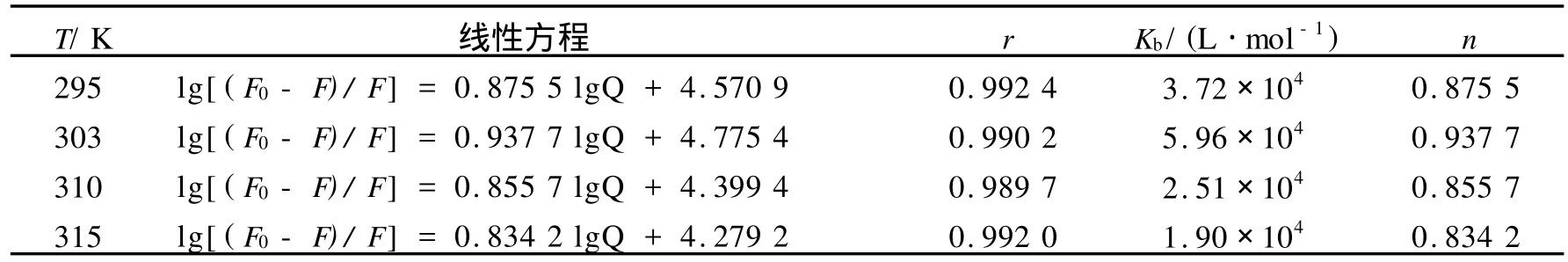
表2 水飞蓟素与BSA的表观结合常数 Kb以及结合位点数 nTable 2 The binding constantsKband the binding numbersnof silymarin-BSA at different temperatures
由表2可知,水飞蓟素与BSA的结合位点数 n接近1,表明水飞蓟素与BSA可形成一个结合位点,结合常数 Kb值在104数量级以上,表明水飞蓟素与BSA之间有较强的结合作用,水飞蓟素可以被蛋白质运输和储存.
2.5 同步荧光光谱
Δ λ=15 nm和Δ λ=60 nm的同步荧光光谱分别显示酪氨酸残基和色氨酸残基的光谱特征[6].芳香氨基酸残基的最大发射波长与其所处环境极性有关,由发射波长的改变可判断BSA中芳香氨基酸残基所处微环境的变化.固定BSA浓度为0.1×10-4mol·L-1,逐步改变水飞蓟素的浓度,绘制Δ λ=15 nm和Δ λ=60 nm的同步荧光光谱,发现:酪氨酸残基和色氨酸残基的荧光强度均随水飞蓟素浓度的增加而产生猝灭,酪氨酸残基的荧光发射峰蓝移,色氨酸荧光发射峰红移,表明酪氨酸残基所处的微环境疏水性增加,亲水性降低;而色氨酸残基所处的微环境疏水性降低,亲水性增加[6].
3 结论
在p H为7.40的Tris-HCl缓冲体系中采用荧光光谱技术研究了水飞蓟素与BSA的相互作用.结果表明:水飞蓟素对BSA的荧光猝灭过程属静态猝灭,结合过程是靠氢键和范德华力相结合的自发反应过程,应用同步荧光光谱考察了水飞蓟素对BSA构象的影响.
[1]胡艳军,刘义,侯安新.稀土杂多酸盐EuHSiMo10W2O40·25H2O与BSA相互作用的研究[J].化学学报,2004,62(16):1519-1523.
[2]安道利,李建晴,智慧.灿烂绿与牛血清白蛋白相互作用的研究[J].分析科学学报,2008,24(3):311-314.
[3]CYRIL L,EARL J K,SPERRY W M.Biochemists Handbook[M].London:Epon Led Press,1961:84.
[4]ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[5]LAKOWICZJ R,WEBER G.Quenching of fluorescence by oxygen.Probe for structural fluctuations in macromolecules[J].Biochemistry,1973,12(21):4161-4170.
[6]杜秀莲,李荣昌,王夔.用同步荧光光谱法研究铽(Ⅲ)与脱铁运铁蛋白的作用[J].科学通报,2001,46(5):394-396.
Fluorescence spectrometric study of interaction between silymarin and bovine serum albumin
SHANG Yong-hui*,SUN Jia-juan,LIU Jing
(Department of Chemistry&Chemical Engineering,Xianyang Normal College,Xianyang712000,Shaanxi,China)
O 657.39
A
1008-1011(2011)02-0001-03
2010-11-13.
国家自然科学基金项目(20975081),西北大学研究生交叉学科资助项目(07YJC09),陕西省教育厅科研计划项目(2010J K899).
尚永辉(1978-),男,博士生,讲师,研究方向为药物分析.
