双金属催化剂体系催化过氧化氢分解反应
2011-09-24李云平王保玉
张 俊,李云平,王保玉
(洛阳师范学院化学化工系,河南洛阳 471022)
双金属催化剂体系催化过氧化氢分解反应
张 俊,李云平,王保玉
(洛阳师范学院化学化工系,河南洛阳 471022)
研究了双金属催化剂体系催化过氧化氢分解反应,测量了不同催化剂体系的活化能.结果表明,双金属催化剂对过氧化氢分解反应具有良好的催化性能,且双金属催化剂存在协同催化作用;而酸性环境对过氧化氢催化分解有明显的抑制作用.
双金属催化剂;过氧化氢;分解反应
Abstract:The decomposition reaction of hydrogen peroxide catalyzed by dual-metal catalyst systems was investigated,and the activation energy for various catalyst systems was measured.Results show that dual-metal catalysts have good catalytic performance for the decomposition reaction of hydrogen peroxide,and there exists synergistic catalytic function for the dual-metal catalyst systems.However,acidic environment significantly retarded the catalyzed decomposition of hydrogen peroxide.
Keywords:dual-metal catalyst;hydrogen peroxide;decomposition reaction
作为一种“绿色”试剂,H2O2广泛用于化工、纺织、造纸、军工、电子、航天、医药、食品、建筑及环境保护等行业,可扮演氧化剂、漂白剂、消毒剂、脱氧剂、聚合物引发剂和齐联剂等角色,同时过氧化氢能加速人体的衰老过程,缩短人的寿命,具有致癌危险性等.纯净的过氧化氢是比较稳定的,在30℃时,纯的 H2O2一年的分解率仅为1%.催化分解过氧化氢的研究对于进一步研究消除生物体代谢过程中的伴生物HO-,延缓衰老、防止癌变及其他疾病具有重要作用[1].目前,对 H2O2催化分解的研究主要集中在新型催化剂的开发上[2].
双金属催化剂是过去几十年来催化领域的研究热点之一,第二种金属(即使本身无活性)的加入能够改变反应的活性和选择性,特别是能够改善催化剂的稳定性,它在许多催化反应中表现出不同寻常的活性,通过两种金属的协同作用,可以取得单金属所没有的高活性和高选择性[3].由于双金属催化剂存在着各种各样的组合,加入的第二种金属可以是贵金属或轻过渡金属,所以双金属催化剂具有很大的开发潜力[4-5].本文作者以双金属催化剂来催化分解 H2O2,以研究其动力学性质,既具有一定的理论意义,又具有一定的应用价值.
1 实验部分
1.1 仪器和试剂
501超级恒温槽,上海市实验仪器厂;恒温恒压量气装置,自制;H2O2,质量分数30%,分析纯;其余试剂均为市售分析纯试剂.
1.2 实验原理
过氧化氢的分解反应式为:H2O2→H2O+1/2O2,为一级反应,实验采用量气法测量 t时刻的Vt,以ln(V∞-Vt)/V∞对t作图得一直线,斜率的数值即为速率常数 k.
1.3 实验步骤
1.3.1 双金属催化剂的配制
称取0.02 mol FeCl3,0.002 mol CuCl2,加蒸馏水定容至100 mL,得到双金属催化剂 FeCl3-CuCl2;n(Fe)∶n(Cu)=10∶1.其他双金属催化剂体系用相同方法配制.
称取0.02 mol FeCl3,0.002 mol CuCl2,4 mol/L HCl溶液10 mL,加蒸馏水定容至100 mL,得到双金属催化剂FeCl3-CuCl2-HCl.
1.3.2 活化能的测定
依次调节恒温槽温度为25℃,30℃,35℃,40℃,45℃.测量不同温度下的过氧化氢分解反应的速率常数k,根据阿伦尼乌斯公式:lnk= -Ea/RT+B,求出反应的活化能.
2 结果与讨论
2.1 不同催化剂体系对过氧化氢分解反应的影响
由表1可见:30℃时,用FeCl3和CuCl2作为催化剂催化分解过氧化氢,两种催化剂都催化过氧化氢的分解(Run 1,2);但与Run 3,4比较发现,双金属催化剂比单金属催化剂有着更好的催化性能,其速率常数大于两种单金属催化剂速率常数的加和,可见通过两种金属的协同作用,可以取得单金属催化剂所没有的高活性,能显著加速过氧化氢的分解.比较Run 3,4还可以发现,对于第二金属组分,起催化作用的主要为金属离子,阴离子(Cl-,SO2-4)对反应没有明显的影响.
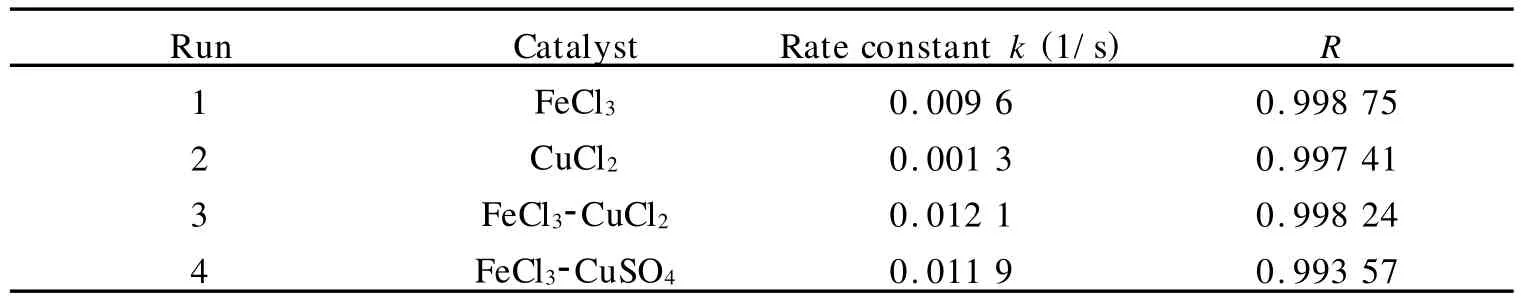
表1 不同催化剂体系对过氧化氢分解反应的影响Table 1 Effect of different catalyst systems on decomposition reaction of hydrogen peroxide
2.2 第二金属组分对过氧化氢分解反应的影响
如表2所示:在催化过氧化氢分解过程中,双金属协同催化作用是一种普遍存在的现象.不仅Cu2+,其他主族金属离子如 K+,Ca2+,过渡金属离子如Mn2+,Ni2+,Zn2+,都能显著加速过氧化氢的分解.
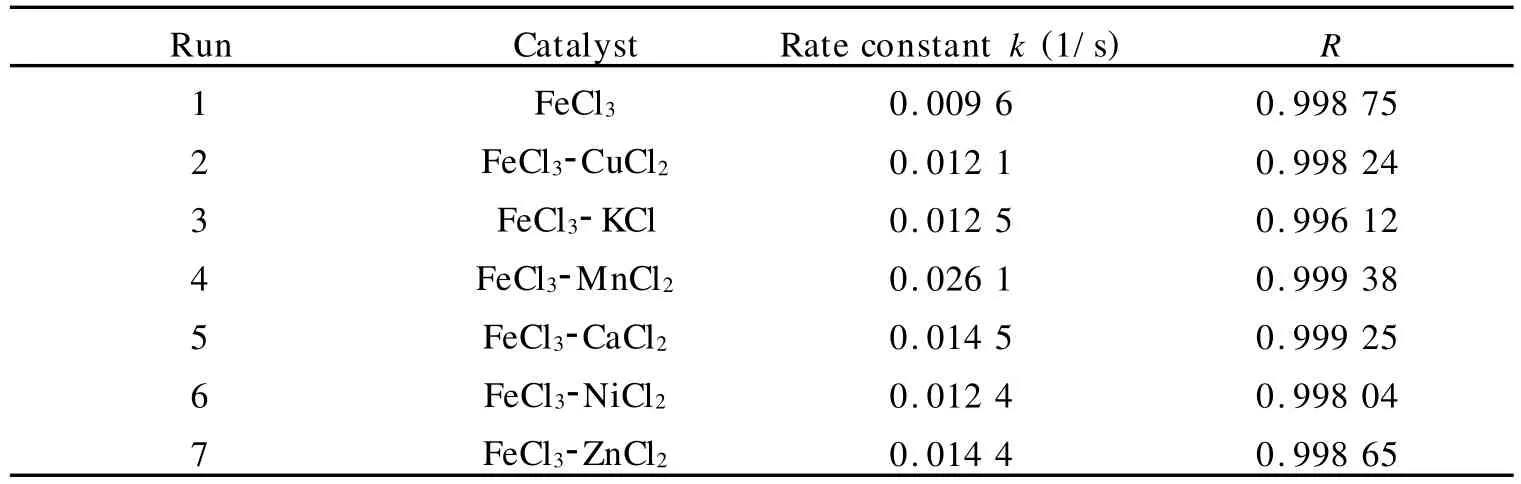
表2 第二金属组分对过氧化氢分解反应的影响Table 2 Effect of the second metal on decomposition reaction of hydrogen peroxide
2.3 酸性环境对过氧化氢分解反应的影响
如表3所示:酸性环境对催化过氧化氢分解有明显的抑制作用,无论是单金属体系(Run 1、2),还是双金属体系(Run 3、4),这种抑制作用都非常明显.
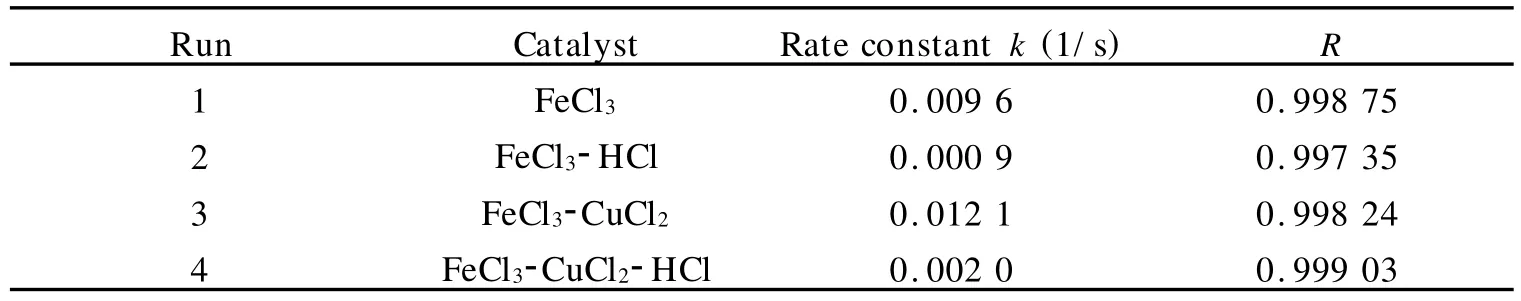
表3 酸性环境对过氧化氢分解反应的影响Table 3 Effect of sour environment on decomposition reaction of hydrogen peroxide
2.4 不同催化剂体系催化过氧化氢分解反应的活化能
分别在 25 ℃、30 ℃、35 ℃、40 ℃、45 ℃,测量并计算 CuCl2、FeCl3、FeCl3-HCl、FeCl3-CuCl2、FeCl3-CuCl2-HCl五种催化剂体系的速率常数,以lnk对1/T作图,由阿伦尼乌斯经验公式得图1.由图1可以看到,在25℃到45℃的温度范围内,催化剂的活性随温度的升高而增加,五种催化剂体系的速率常数都很好的符合阿伦尼乌斯经验公式.
由图1计算出五种催化剂体系的活化能.如表4所示,在催化剂的催化作用下,过氧化氢分解反应的活化能都有明显降低.

图1 不同催化剂体系催化过氧化氢分解的阿伦尼乌斯曲线Fig.1 Arrhenius’s curve of different catalyst systems
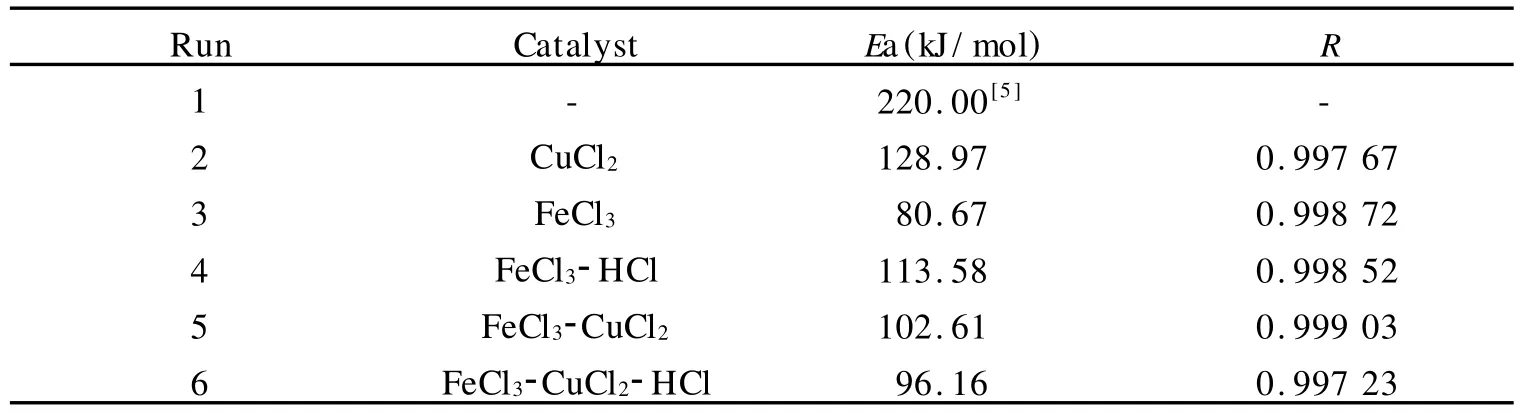
表4 不同催化剂体系的活化能Table 4 Activation energy of different catalyst systems
3 小结
双金属催化剂比单金属催化剂有着更好的催化性能,其速率常数大于两种单金属催化剂速率常数的加和.不论主族金属离子,还是过渡金属离子在催化过氧化氢分解过程中,都体现出明显的双金属协同催化作用.无论是单金属体系,还是双金属体系,酸性环境对催化过氧化氢分解都有明显的抑制作用.在25℃到45℃的温度范围内,催化剂的活性随温度的升高而增加,五种催化剂体系的速率常数都很好地符合阿伦尼乌斯经验公式.
[1]张丽霞,庞承新,谭延光.影响过氧化氢催化分解速率的因素[J].广西师范学院学报:自然科学版,2008,(4):52-56.
[2]姜成春,庞素艳,江进,等.Fe(Ⅲ)催化过氧化氢分解影响因素分析[J].环境科学学报,2007(7):1197-1202.
[3]WANGJian Wei,CAO Guo Ya,HU Xia Qi.The study of hydrogenations of olefins catalyzed by polymer-supported palladium-lanthanoid bimetallic catalysts[J].Chin J Catal,2002,23(4):349-351.
[4]ZHANG Qiang,QIN Yi,CHANGLun.Synergic effect of palladium-based bimetallic catalysts for the hydrogenation of nitroaromatics[J].Apply Catal,1991,70:1-8.
[5]吴洪达,黄映恒.过氧化氢的分解反应[J].河池师专学报:自然科学版,2002(2):27-30.
Decomposition reaction of hydrogen peroxide catalyzed by dual-metal catalyst systems
ZHANGJun,LI Yun-ping,WANGBao-yu
(Department of Chemistry and Chemical Engineering,L uoyang Teachers College,L uoyang471022,Henan,China)
O 643.13
A
1008-1011(2011)01-0058-03
2010-09-28.
张 俊(1977-),男,副教授,博士.研究方向:工业催化.E-mail:zhjosso@sina.com.
