血清雌孕激素及输卵管组织白血病抑制因子及其受体表达与输卵管妊娠的关系
2011-09-20赵丹梅欧阳俊马文琴吴超英史文忠唐正华
李 咏,赵丹梅,欧阳俊,向 梅,马文琴,吴超英,史文忠,唐正华
(南京医科大学附属常州市妇幼保健院,1.普妇科,2病理科,江苏常州,213003)
在正常月经周期中,输卵管的腺上皮和子宫内膜一样在雌孕激素的作用下会发生周期性变化。在子宫内膜的种植窗期,有许多因子和激素参与胚胎的种植,其中雌二醇(E2)和孕酮(P)是胚胎植入过程中起主导作用的激素。而输卵管妊娠的发病机制目前还未明确。本实验研究E2、P和白血病抑制因子(LIF)及其受体(LIFR)与输卵管妊娠(TP)的关系,以揭示发生输卵管妊娠的分子水平机制。
1 实验方法和评价指标
1.1 病例选择
从2008年至2010年在江苏省常州市妇幼保健院收集了57例病例,其中非孕组:健康的未孕妇女(对照组)11例,年龄 16~46岁,平均(39.3±8.5)岁,均自愿行绝育手术;宫内妊娠组:正常的宫内妊娠(NIUP)12例,27~40岁,平均(34.5±4.1)岁,均自愿行人工流产或者孕足月剖宫产时绝育,既往均无自然流产、异位妊娠或激素治疗史;TP组:输卵管妊娠(TP)者 36例,22~43岁,平均(33.9±5.6)岁,每例患者均经手术和病理切片检验证实,术前均未行药物保守治疗。3组均选用种植部位的组织切片,种植部位的组织切片评定标准为:①有锚定绒毛移行穿入输卵管筋膜层;②有与锚定绒毛穿入相连的正常输卵管勃膜上皮。同时收集32例正常宫内孕孕妇[孕25~57 d,平均(42±1.6)d]、40例异位妊娠孕妇[孕35~72 d,平均(49.9±1.5)d]血清以检测E2、P(两者孕周差异无统计学意义,P>0.05)。所有患者均签署知情同意书并且通过本院伦理委员会批准。各组年龄差异无统计学意义(P>0.05)。
1.2 标本来源
①外周血的获取:于手术当天抽取空腹肘静脉血3 mL,分离血清,检测E2、P。②3组妇女输卵管组织均在手术时(输卵管妊娠手术和输卵管结扎手术)收集,生理盐水冲洗后,10%甲醛固定,石蜡包埋,切片(4 μ m),以备免疫组化分析。
1.3 实验试剂
雌二醇和孕酮诊断试剂盒(德国罗氏诊断产品有限公司);羊抗人LIF多克隆抗体[LIF(N-18):Sc-1336]和兔抗人LIFR多克隆抗体[LIFR(C-19):Sc-659](美国 Santa Cruz公司);过氧化物酶标记的链酶卵白索(SP)染色试剂盒(北京中杉金桥生物技术有限公司)。
1.4 实验方法
①采用电化学发光法检测患者外周血血清E2、P;②免疫组化半定量分析(IRS):采用链霉素亲和素-生物素复合物方法(SABC)。阴性对照均采用磷酸缓冲液(PBC)代替一抗,严格按试剂盒说明书操作。
1.5 评价指标
免疫组化结果判定综合考虑切片中阳性细胞占所观察同类的细胞数的百分比和阳性细胞着色强度两项指标,半定量判定结果。①根据显色程度判断阳性程度:标本无色为0分,淡黄色1分,棕黄色2分,棕褐色3分;②根据阳性细胞在观察细胞中所占的比例:阳性细胞数≤10%为1分,阳性细胞数11%~50%为2分,阳性细胞数51%~75%为3分,阳性细胞数>75%为4分。
2 结 果
2.1 宫内妊娠组和输卵管妊娠组血清E2、P比较
用电化学发光法检测32例正常宫内孕组、40例异位妊娠组血清E2、P,结果显示输卵管异位妊娠组血清E2低于正常宫内妊娠组,差异有统计学意义(P<0.05,图1A);输卵管异位妊娠组血清P低于正常宫内妊娠组,差异有统计学意义(P<0.01,图1B)。
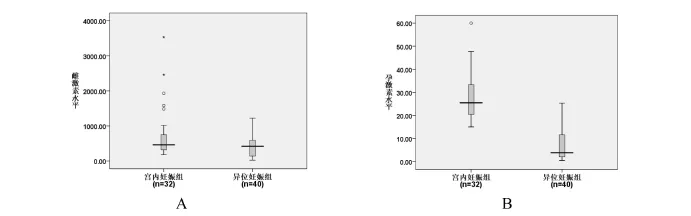
图1 电化学发光法检测正常早期宫内妊娠组和输卵管异位妊娠组雌二醇和孕酮的差异
2.2 免疫组化检测LIF和LIFR在正常对照组、宫内妊娠组及异位妊娠组输卵管组织的表达率和定位
免疫组化检测11例非孕组、12例宫内妊娠组及36例异位妊娠组其输卵管组织LIF和LIFR的表达。结果显示,LIF和LIFR在输卵管腺上皮细胞表达较强,在间质细胞表达较弱,且主要定位于腺上皮细胞胞浆(图2)。
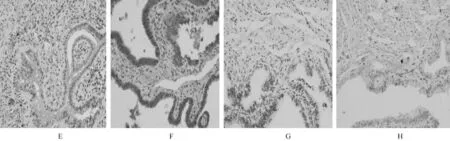
图2 LIF和LIFR在输卵管组织LIF和LIFR阳性表达SP法 (400倍)
2.3 半定量分析LIF和LIFR在正常对照组、宫内妊娠组及异位妊娠组输卵管组织的表达差异
半定量分析发现,虽然LIF在异位妊娠组的表达略高于正常对照组和宫内妊娠组,但各组间差异无统计学意义(图3A,P>0.05);LIFR在异位妊娠组的表达明显高于前两组,差异有统计学意义(图3B,P<0.05),正常对照组和宫内妊娠组间无明显差异(图3B,P>0.05);但是在间质中,LIFR的表达在输卵管妊娠组明显低于其他两组(P<0.01),而非孕组和宫内妊娠组上皮间其表达无明显差异(图3C,P>0.05)。

图3 半定量分析LIF和 LIFR在各组输卵管组织的表达差异
2.4 血清E2、P与输卵管 LIF、LIFR相关性分析
分析表明输卵管妊娠时血清E2与输卵管腺上皮和间质LIFR均有显著相关性。血清E2与腺上皮LIFR之间正相关(r=0.354,P<0.05),血清E2与间质LIFR之间负相关(r=-0.397,P<0.01);而血清P与输卵管妊娠腺上皮和间质的LIF、LIFR的表达无显著相关性;血清E2与腺上皮和间质的LIF表达无显著相关性。
3 讨 论
95%的异位妊娠发生在输卵管,虽然输卵管炎症、局部解剖结构的改变是发病的主要原因,但是55%的输卵管妊娠患者经肉眼检查输卵管是正常的,因此异位种植的基础分子机制仍不明确[1]。本研究应用免疫组化方法检测LIF及其受体LIFR在输卵管中的表达,检测患者血清E2、P,探讨血清 E2、P与 LIF及LIFR与TP的关系。
在雌激素的作用下,输卵管黏膜上皮纤毛细胞生长,体积增大,雌激素还促进输卵管发育及输卵管肌层节律性收缩的振幅。而孕激素则能增加输卵管的收缩速度,减少输卵管的收缩频率、振幅。雌、孕激素的协调作用,使输卵管上皮适应月经周期变化并保证宫内受孕的成功[2]。排卵后子宫内膜随之发生的复杂改变,依赖于体内包括甾体激素在内的多种因素的调节,最终使内膜与胚胎发育同步化,以利于胚泡着床和进一步发育[3-4]。Pulkkinen等[5]对输卵管肌层电生理进行研究,发现低孕酮水平下,输卵管呈现功能障碍的特征。这些基本特征包括:①输卵管伞端倾向子宫的肌电活动低下,向子宫的推进力较弱,可导致不孕或宫外孕(不过在运输卵子方面伞端黏膜纤毛的摆动可能比肌层的机械作用扮演更重要的角色);②输卵管肌电爆发波的产生率低(推进力弱);③无推进作用的正弦波和静止波的发生率高,不能维持良好的输卵管机械推进力,可致卵子、受精卵停留。这一研究结果与一些学者的流行病学发现相吻合,即黄体功能低下与高异位妊娠发病率之间有一定关联。他们研究发现[5],异位妊娠患者外周血孕激素水平普遍较正常妊娠者为低,两者共同作用使得输卵管蠕动异常,受精卵容易在此发生滞留。这些资料揭示,血清低孕酮水平,输卵管局部肌层孕激素受体含量低下,使输卵管输送受精卵功能障碍,导致桑葚胚异位植入,是输卵管妊娠的可能因素。我们的研究也提示异位妊娠组的血清E2、P明显低于正常宫内妊娠组(P<0.05,P<0.01)。异位妊娠患者体内雌二醇和孕酮水平低,导致输卵管平滑肌收缩节律下降、纤毛向宫腔方向摆动减慢、输卵管峡部无法放松,孕卵运行受阻,使胚泡异位种植。
胚胎着床是一种复杂的生理过程,同时受诸多因素调节。其中 LIF是一种多功能多生物学性细胞因子,LIF表达峰值与着床窗时间一致,是着床的关键因子[6]。一些研究表明[7],LIF对妊娠的维持有重要作用。LIF可以启动胚泡着床和促进胚泡的发育,且其作用呈时间和剂量依赖关系。
LIF是Tomida等[8]在1984年首次从白血病细胞中分离鉴定的,已证实LIF的异常表达与多种疾病密切相关,如异位妊娠、肿瘤等[9-10]。LIF受体复合物由一个低亲和性受体(LIFR)及一个高亲和性受体(gpl30)组成,LIFR还有LIFRα及LIFRβ两条链。LIF先以较低亲和力与受体α结合,然后与gpl30相互作用形成亲和力高的复合物,二聚体形成后gpl30磷酸化,激活Janus酶,磷酸化下游的信号传导子及转录激活子(stat)蛋白,从而进入核内激活下游转录因子,产生一系列的生物效应[11]。同时 LIF是唯一能够激活体内stat3的因子,而一些相关因子如 IL-6、CNTF等虽共用LIFR及gp130受体,却无此功能[12]。小鼠子宫内膜LIFR在分泌期及妊娠早期表达量高,而gpl30在妊娠早期(3~4 d)表达量最高。人LIFR及gpl30在整个月经周期内均表达,LIFR主要分布于子宫内膜腔上皮,gpl30则在腔上皮和腺上皮中均有发现[13]。这些结果显示,表达于子宫内膜中的LIF及其受体于围着床期表达升高,LIF可能通过某种途径为子宫接受胚胎着床作好准备。作者的研究结果显示LIF主要在输卵腺上皮表达,间质几乎不表达,这与Keltz等[14]的研究结果一致。
有趣的是,虽然作者的研究结果表明LIF在各组间无明显差异,但是其受体LIFR在异位妊娠组输卵管的腺上皮表达水平明显高于宫内妊娠组和非孕组(P<0.05),而宫内妊娠组和非孕组间无明显差异(P>0.05)。同时作者还发现在输卵管间质LIFR表达在异位妊娠组明显低于与宫内孕组和非孕组,差异有显著统计学意义(P<0.01);宫内孕组略高于非孕组,但是两者之间差异无统计学意义(P>0.05)。作者的实验结果提示LIFR同样存在于输卵管的腺上皮和间质中,LIFR在异位妊娠组输卵管腺上皮的表达水平明显高于宫内妊娠组和非孕组,而宫内妊娠组和非孕组间无明显差异。这些结果表明,宫内孕组和非孕组输卵管间质LIFR高表达提示LIFR在正常状态时为储备状态,而在输卵管妊娠状态时大量LIFR游离至输卵管腺上皮,与LIF一起参与母胎界面生化反应。这说明,输卵管组织 LIFR的异常表达可能与异位妊娠的发生密切相关。从一个侧面也说明,异位妊娠的发生不仅需要LIF的表达,同时也需要LIFR的协同高表达。因此,本实验证明LIF和LIFR是输卵管妊娠植入的关键因子,同时检测 LIF和LIFR的表达可能成为预测异位妊娠发生倾向性的一组潜在指标,比单独检测LIF更有临床意义。
作者通过血清雌二醇、孕酮和LIF及其受体LIFR的相关性分析发现:输卵管妊娠时血清E2与输卵管腺上皮和间质的LIFR表达均有显著相关性。血清E2与腺上皮LIFR之间正相关(r=0.354,P<0.05),血清E2与间质LIFR之间负相关(r=-0.397,P<0.01);而血清P与输卵管妊娠腺上皮和间质的LIF、LIFR的表达无显著相关性;血清E2与腺上皮和间质的LIF表达无显著相关性。提示E2能上调输卵管腺上皮的LIFR表达,下调输卵管间质LIFR的表达。
[1]Salih S M,Taylor S H.HOXA10 gene expression in human fallopian tube and ectopic pregnancy[J].Am J Obstet Gynecol,2004,190(5):1404.
[2]乐 杰.妇产科学[M].北京:人民卫生出版社,2004:20.
[3]Bersing N A,Brandenberger A,Berger E,et al.Serum pregnancy-specificβ-glycoprotein before embryo transfer is related to endometrialthickness and to outcome prognosis in women undergoing in vitro fertilization treatment[J].Hum Reprod,1998,13(7):1962.
[4]Hambartsoumian E.Human endometria1 leukemiainhibitory factor(LIF)secretion and its relationship to sonographic endometrial appeaarance[J].Am J Reprod Immunol,1997,37(4):320.
[5]Pulkkinen M O,Jaakkola U M.Low serum progesterone levels and tubal dysfunction--a possible cause of ectopic pregnancy[J].Am J Obstet Gynecol,1989,161(4):934.
[6]Sherwin J R,Freeman T C,Stephens R J,et al.Identification of genes regulated by leukemia inhibitoty factor in the mouse uterus at the time of implantation[J].Mol Endocrinol,2004,18(9):2185.
[7]Mitchell M H,Swanson R J,Oehninger S.In vivo effecct of leukemia inhvicaibitory factor(LIF)and an anti-LIF polyclonal antibody on murine embryo and fetal development following exposure at the time of transcervical blastocyst transfer[J].Biol Reprod,2002,67(2):460.
[8]Tomida M,Yamamoto-Yamaguchi Y,Hozumi M.Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells[J].J Biol Chem,1984,259:10978.
[9]Ji Y F,Chen L Y,Xu K H,et al.Locally elevated leukemia inhibitory factor in the inflamed fallopian tube resembles that found in tubal pregnancy[J].Fertil Steril,2009,91(6):2308.
[10]Shin J E,Park S H,Jang Y K.Epigenetic up-regulation of leukemia inhibitory factor(LIF)gene during the progression to breast cancer[J].Mol Cell,2011,31(2):181.
[11]Ernst M,Inglese M,Waring P,et al.Defective gp130-mediated signal transducer and activator of transcription(STAT)signalingResultsin degenerative joint disease,gastrointestinal ulceration,and failure of uterineimplantation[J].J Exp Med,2001,194(2):189.
[12]Sherer D M,Abulafia O.Angiogenesis during implantation,and placental and early embryonic development[J].Placenta,2001,22(1):1.
[13]Culinan E B,Abbondanzo S J,Anderson P S,et al.Leukemia inhibitory factor(LIF)and LIF receptor expression in human endometrium suggests a potentialautocrine/paracrine function in regulating embryo implantation[J].Proc Natl Acad Sci,1996,93(7):3115.
[14]Keltz M D,Attar E,Buradagunta S,et al.Modulation of leukemia inhibitory factor gene expression and protein biosynthesis in the human fallopian tube[J].Am J Obstet Gynecol,1996,175(6):1611.
