正电子发射断层成像与计算机断层扫描的异机三维融合影像分析
2011-09-18彭鳒侨PENGJianqiaoMatthew
彭鳒侨 PENG Jianqiao Matthew
丘红英2 QIU Hongying
董伟强1 DONG Weiqiang
刘襄平3 LIU Xiangping
晏 颖4 YAN Ying
卢伟杰1 LU Weijie
广州医学院第一附属医院 1.骨外科2.放射科CT室 3.核医学科PET/CT中心4.放射科MR室 广东广州 510182
计算机断层扫描(computed tomography, CT)对刚体病灶成像清晰[1],但对软组织的显像不及磁共振(magnetic resonance imaging, MRI或MR)[2];正电子发射断层成像(positron emission tomography,PET)图像的解剖定位欠佳,但可无创性地获取细胞代谢过程的功能定位信息[3]。因此,将CT的解剖图像和PET的代谢图像融合,可以实现高代谢区域的准确定位[4]。图像融合分为异机融合(异源图像的扫描在不同时段且发生在不同的影像设备上)和同机融合(异源图像的扫描同时发生在同一台影像设备上)两种方式。虽然[PET+CT]联机设备的二维(two-dimension, 2D)同机融合问世已有10年,但[PET+CT]的三维(three-dimension, 3D)融合功用至今还未实现,预示着核医学影像未来的主攻方向。
1 资料与方法
1.1 一般资料 从2010~2011年入住广州医学院第一附属医院的200个以肿瘤为主要诊断的患者中以随机数字表抽出20例,其中男性14例,女性6例;年龄21~80岁,平均60.5±15.4岁。其中4例获得融合效果比较显著,患者1,女性,54岁,右乳腺癌双肺癌转移;患者2,男性,38岁,右肺中央型肺癌;患者3,男性,53岁,左上肺癌右股骨转移;患者4,男性,57岁,左肺癌。PET(型号GE Discover-ST8)扫描前 40min 注射 5.5mbq/kg 正电子核素氟标记脱氧葡萄糖(fl uoro D-glucose,18FFDG或FDG)为示踪剂,CT(型号Toshiba Aquilion TSX-101A)操作前在选定的框位以铅点作荧光标记,定位框的选择通常是体表标志点,既可大致提醒扫描范围,又可为下一步成像后的配准提供定位参考。扫描时患者取仰卧位,以人体真空垫塑模固定双下肢、专用线圈固定头部,使体位保持统一,减少定位框架在不同时段逐一施行PET、CT扫描时位置的偏差,按常规扫描获得横断扫描图像,经多平面重建(multi-plane reformation, MPR)获得矢状位、冠状位图像[5]。
1.2 数据处理
1.2.1 [PET+CT]的二维配准 在成像工作站Mimics-14平台上导入PET和CT图像数据,来自不同设备不同切层厚度的异源影像经过DICOM通用格式的数据传递、转换、生成初步重建的单模3D(PET“箭”体或CT“靶”体)后,实行“3面9点”配准,包括:①“3面”原则。在三维箭图上,根据人体特殊结构(其中以骨性标志为首选)确立3个外部特征点,在穿越该“特征点”的3簇平面中,经过点选、(虚拟)“切割”,依次从第1簇中分离出冠状面,从第2簇中分离出矢状面,从第3簇中分离出横断面,共获3个二维特征面;同理,在三维靶图上点选、(虚拟)“切割”出横断、矢状及冠状3个2D薄层。②“9点”原则。参照3.2所述的具体操作步骤在每个“特征面”上确立3个混合特征点,即从3×3=9个“对焦点”出发,让来自此机的3个“此层”与来自彼机的3个“彼层”彼此一一“咬合”。
1.2.2 [PET+CT]的二维融合 在以上“9点3面”立体对准的基础上将PET图像关联映射到CT图像上。在Mimics-14融合界面下对定位图像进行融合选择,影像讯号的叠加有加、减、乘、除、差异、最大、最小、平均等12种方法,本研究按照早期发现的临床需要选择了加法(针对讯号结果而言,不管源于何种组织,其算法与声学、光学上各类不同频率、波长的正弦、余弦波相遇时的量值叠加原理相似,以便把早期出现的细微异常讯号“放大”),按信息交互自动融合(叠加值的即时显像)模式进行图像融合。
1.2.3 [PET + CT]的三维重建 把 1.2.2 融合出来的二维图像输入逆向软件Mimics,输出三角网格和点云,在实时工作站经反求工程对网格进行光顺、填充、压缩、删除等编辑,再经布尔差运算组建计算机辅助设计(computer aided design, CAD)模型,重构出非均匀有理B样条(non-uniform rational B-splines, NURBS)内外曲面,然后将多个曲面缝合成实体模型。其中数据处理次序 1.2.2、1.2.3 可以倒置,即先经1.2.3重建PET和CT的三维图,然后参照1.2.2的操作把这两幅立体图融合成[PET+CT]三维图。
1.3 统计学方法 采用SPSS 16.0软件进行分析,用双组、多组配对样本资料的Fridman(非参数)检验法,P<0.05为差异有统计学意义。
2 结果
2.1 显像效果
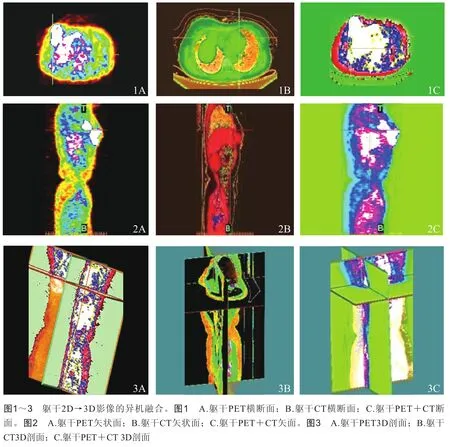
2.1.1 异机融合 根据成像系统各自的特长(PET长于定性而短于定位,CT长于定位而短于定性),[PET+CT]的影像融合被赋予了两重意义:了解PET所发现的异常代谢组织的明确位置;了解CT所发现的异常病灶的代谢情况。这种融合后的二模综合图像包含着来自CT和PET各自的讯号特征,携带着互补的医学信息,例如,清晰的代谢区域如图1A、2A、3A,明亮的骨质显像如图1B、2B、3B,融合图像吸取了CT和PET的优点,生成了同时体现躯干结构和代谢状况的影像如图1C、2C、3C,为放射诊断提供更加充分的依据。
2.1.2 同机融合 异机融合时,有时用于对位的解剖结构信息不多,导致体表轮廓、病变摄取显映不够,可以通过添加“伪彩”来突显,这一流程由同机融合来完成的效果比异机融合更加鲜明(图4)。患者2,男性,38岁,因咳嗽伴咯血2个月余就诊。躯干CT扫描如图4A中的左上图所示:右肺门2.9cm×2.7cm结节状高密度影,注入对比剂增强后可见结节呈片状不均匀强化,初步诊断“右肺中央型肺癌”;进一步躯干PET扫描如图4A中的右上图所示:右肺下叶基底2.9cm×2.7cm团块,放射性摄取SUV最大值为9.0,高度浓聚,隆突下可见1.5cm×1.3cm肿大淋巴结,异常摄取增高灶SUV=4.5,获得比CT更详细的诊断“右肺中央型肺癌、隆突下淋巴结转移”;更深入的躯干[PET+CT]同机融合影像如图4A中的左下图所示:(在以上2图所见的基础上)右肺门可见0.9cm×1.0cm淋巴结,异常放射性摄取增高灶SUV=3.7,右后下胸膜增厚,放射性浓集SUV=4.1,至此获得比PET更明确的最终诊断“右肺中央型肺癌右后下胸膜转移、右肺门淋巴结转移、隆突下淋巴结转移”;在稍后的检查中,如图4B的上半图所示,相继发现癌肿腹部转移。另外2个病例分别以[PET+CT]同机融合为依据确诊出其他影像学检查所漏诊的“(左肺上叶前段肺癌)右股骨下内踝转移”(图4B),和“(左肺癌)颅脑转移”(图4C)。
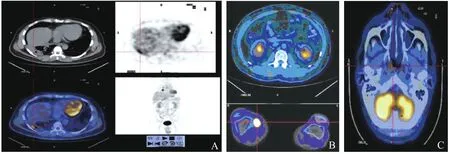
图4 胸部、腹部、膝部、头部2D[PET+CT]二模同机融合。A.胸部横断面;B.腹膝横断面;C.头部横断面
2.2 影像分析 在视觉层面上,从以上例证可以归纳出PET/CT及其各种组合的融合显像特征,见表1。
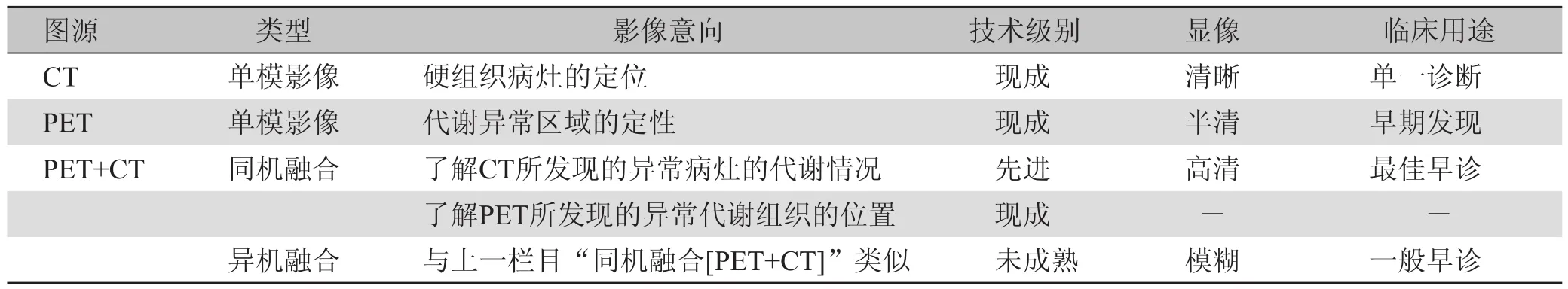
表1 多模显像的技术特征对照
在统计学层面上,挑选3名放射科副主任医师和2名核医学科副主任医师组成资历相仿、水平相近的5人专业团队,采用盲法(隐去临床资料,各自阅片,互不交流),对这20例中PET/CT及其各类融合的影像效果进行分析。每位医师对每幅图像的评估将统一从“肯定阳性、可疑阳性、肯定阴性、可疑阴性、不能识别”等5种论断中选择一个,这样,每一类图源的效果都被专业评分而集成20×5=100份估值,见表2。把显像的识别程度分别归结为“不能识别”=“难辨”、“可疑阳性+可疑阴性”=“可疑”、“肯定阳性+肯定阴性”=“确切”3类将其所属的份数相加见表3。
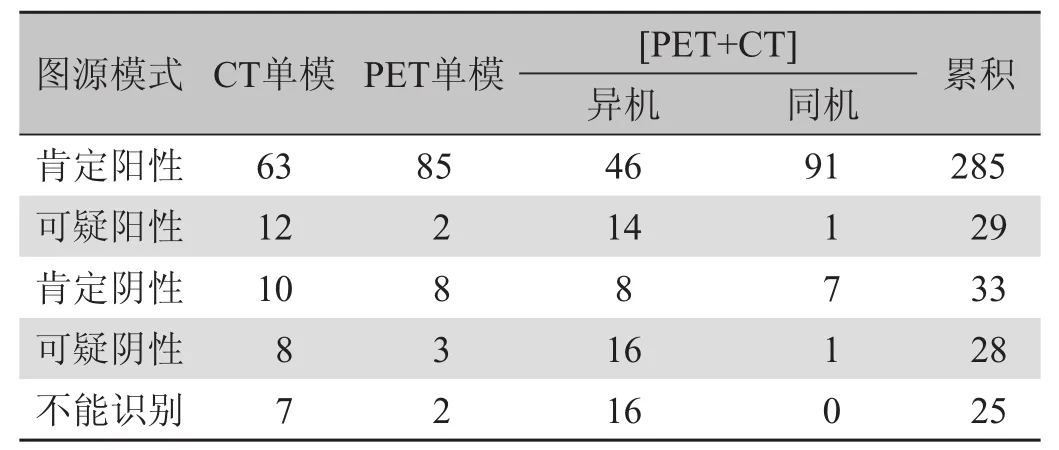
表2 多模显像的识别效果评估(份次)

表3 多模显像的识别程度归宗(份次)
至于特异性、灵敏度、正确率等真实性指标,由于三种设备的影像原理不同,人体头、胸、腹、膝内部所纳并非同一(软、硬)组织,临床取向各异的设备(PET/CT)针对各类实验对象(器官)而提供的信息侧重不同的(结构、代谢)“倾向”,其以融合图像检测病种的特异性也各异,不易比较,所以实验检测的设计仅限于粗略统计(难辨、可疑、确切等)可靠性指标,即至显像指标“符合率”为止。以上调查结果以更鲜明的曲线表达见图5。

图5 单模、多模影像融合结果的难易度鉴辨
多组配对样本资料的Fridman(非参数)检验显示,鉴辨单模、多模融合结果的“难易度”不尽相同(P< 0.001)。
对图5中的异机[PET+CT]显像模式需要进一步两两比较,从表4~6中可发现3个P值均大于检验水准,配对检验比较结果无区别。

表4 异机[PET+CT]与单模PET的配对检验[n(%)]
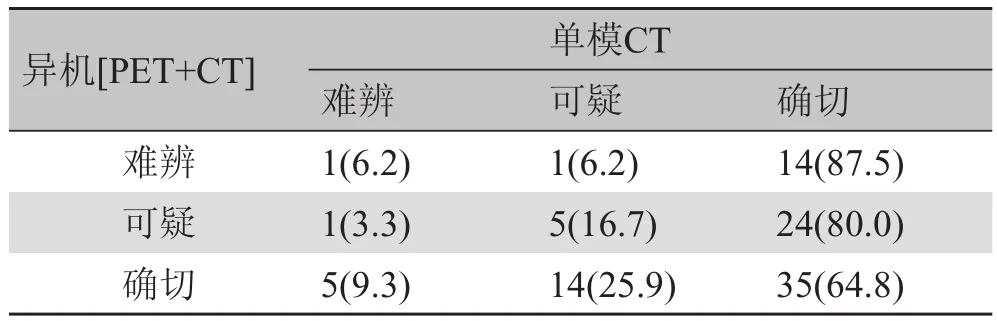
表5 异机[PET+CT]与单模CT的配对检验[n(%)]

表6 同机[PET+CT]与异机[PET+CT]的配对检验[n(%)]
结果表明,异机[PET+CT]的“检出率”(54%)远远落后于同机[PET+CT](98%),甚至不如单模影像。
3 讨论
3.1 影像融合的现状 从同源单模融合到异源多模融合,从二维融合到高维融合,从黑白到彩色融合,从形态图像到功能图像融合,国内外涌现出的算法越来越丰富[6~8],融合级数越来越高,有基于像素级[9]、特征级、决策级等融合[10]。例如,朱朝晖等[11]以“MPItool”软件操作,通过调整PET的三维容积图像寻找与CT、MRI匹配的PET断面,融合的[PET+CT]稍清晰但[PET+MR]较模糊;杨星等[12]以Syntegra软件手动配准工具进行细微调整,不足之处是由于该“软件只接受轴位图像的融合,而冠状位和矢状位图像是基于轴位的重建图像,因此后两者的解剖图像欠清晰”;张锦翔等[13]通过Chamfer Matching软件以图像边缘为配准内特征,无论选择多少个对准点,其边缘都属于同一个平面,对位的精确度也不会超越“9点3面立体对准”,因而融合结果清晰度也受限;与张祥松等[14]所实验的[PET+MR]一样,以上都只是通过“三维容积”调整[15],最终合成的是二维图像而非三维图像;李坤成等[16]通过三维配准融合,但其10年前的旧式SGI/SPM图形工作站实际应用图像存在着不同程度的失真模糊、容量过大、运算缓慢、流程繁琐、操作不便等问题。
3.2 配准融合的体会 阮春等[17]、Brown[18]总结出图像转换、图像定位等配准“两步曲”:①图像转换通过平移、旋转、定标、反射等方式确保异源性图像的每个像/体素表达同样大小的实际空间区域,转换算法通常有:刚性转换;仿射转换;多项式转换(polynominal transformation)(本文选择后者)。②至于图像定位,本文兼用基于外部特征(总体包括定标架法、面膜法、皮肤标记法)和基于内部特征[18](总体包括基于标记、基于分割、基于体素相似性)两大方式[17],遵循特征提取、图像对位的步骤,从标记、分割内部特征入手提取特征(由于Mimics的自动化程度和斜面匹配技术在计算距离变换上的优势,这种分割配准法具有免除像素变换的特色),并实施“循点择面、循面分割”。
定位配准是图像融合的先决条件,是通过空间浮动让一幅图像与另一幅图像在空间上一一对应,最后达成人体某一解剖点在两幅匹配的图像上具备相同的坐标位置的过程,其操作步骤是:在由每个人体“特征点”所选择的平面上,通过平移、旋转使两幅图像的质心和主轴对齐,并在切面(该平面与体表结构线交汇绌合之内的区域)自动生成(类坐标)轴线,延长该轴线使之与切面边缘或脏器边缘相交,至少存在4个交叉点(内部“特征点”),加上被平面穿越的那个原有的人体外部“特征点”,(内外)混合“对焦点”便可至少5(4+1=5)中选3。就定位精确度而言,已完成“选面”使命的人工化外部“特征点”此时较数字化“交叉点”相形见拙,对焦选点时对它可选可不选。这样一共获得由3个外部“特征点”所决定的3个特征面,又在每个特征面上选择3个对焦点作为配准点,当成像工作站精准预判到3×3=9个对焦点的坐标偏差平方和为最小值得时,九九对应的2个3D被全部锁定。立体几何学上的物体甲(如CT像)以及相对应的物体乙(如PET像)的互动关系有:若简单地对某1个方向的每层(如横断水平面)固定,甲乙出现一前一后或一左一右(或同时并存);若沿某2个方向的每层(如矢、冠面的前后左右)添维“加固”,甲乙仍然出现一上一下。这样,两者都造成甲乙朝开放性空间游走,使PET/CT两像无缘吻合。由此可见:首先,“3面9点”方案较其他配准方法的优势在“3点锁面、3面锁体”的科学定理中获得确立;其次,人体解剖学上的“横、矢、冠”3面,成90°相交成3线1点,对人体组织达到最大限度的贯穿,比任何非90°的3面相交涵盖更广,因而虚拟“切割”、三维重建、(PET/CT)二“体”吻合时更具生理效果。融合集成的方式有两种:将一幅图像的信息提取出来,融合到另一幅图像中去;两幅图像的信息提取出来后,同时映射到一个新的图像空间中去。本文预选前者,以提供解剖结构主要信息的CT图作为目标“靶”图,以提供代谢功能辅助信息的PET图作为参考“箭”图,PET像中的异常区域被提取并投射到以CT像为背景的基图上。匹配以后的融合创建方式可分两类:基于图像像素的融合,基于图像特征的融合[17],本文选择后者,即依靠特征提取与边缘检测而不依赖像素变换来实现。本研究在立体对准的基础上按照临床需要选用了特征信息叠加法,在融合的12种方法中,以图像叠加来完成融合(叠加值的即时显像)的技术最为成熟。
3.3 异机融合的展望 相互融合不仅使PET和CT两者的共通信息在同一图像上方便地显示出来,确定病灶的位置及与组织的性质,而且融合过程中可能出现的新发现往往使得诊断更加明确、治疗更加具体:首先在治疗前期为放射治疗靶区、手术切除范围提供精准的量值,其次在治疗中期及时了解肿瘤对治疗的反应而帮助治疗方案的调整,最后在治疗后期还能为疗效评估和复发检测提供统计依据。在[PET+CT]联机设备尚未普及,尤其是[PET+CT]3D融合仍未实现的情况下,这种[PET+CT]异机3D融合是[PET+CT]同机2D融合技术功用的必要补充。
[1]郑加贺, 郭启勇, 卢再呜, 等. CT灌注成像评价肝细胞癌TACE前后血供的初步经验. 中国医学影像学杂志,2007, 18(1): 5-7.
[2]王娜娜, 吕飙, 黄小勇, 等. 磁共振成像对肺动脉栓塞血流动力学的评价. 中国医学影像学杂志, 2011, 19(1):26-30.
[3]赵周社, 辛军, 郭启勇, 等. MRI弥散加权成像和PET/CT扫描在肿瘤检查应用的进展. 中国临床医学影像杂志, 2010, 21(6): 413-418.
[4]王昌军. 异机图像融合技术在临床中的应用. 临床影像技术, 2010, 25(4): 112-114.
[5]乞文旭, 潘诗农, 郭启勇, 等. 256层螺旋CT诊断肋软骨骨折: 窗宽、窗位优化分析. 中国医学影像技术,2010, 26(2): 355-357.
[6]余霞, 葛红, 李彬,等.医学图像融合的并行实现.计算机工程与应用, 2008, 44(34): 172-174.
[7]冯晓源, 张家文. 功能磁共振成像在脑肿瘤术前的应用研究. 中华放射学杂志, 2008, 88 (23): 1585-1588.
[8]于春水, 李坤成, 秦文, 等. 多发性硬化弥散加权成像.中国医学影像技术, 2005, 21(5): 687-689.
[9]杨立才, 刘延梅, 刘欣, 等. 基于小波包变换的医学图像融合方法. 中国生物医学工程学报, 2009, 28(1): 11-13.
[10]王静云, 李绍林. 医学影像图像融合技术的新进展. 第四军医大学学报, 2004, 25(20): 1918-1919.
[11]朱朝晖, 周前, 崔瑞雪. PET图像与CT、MRI图像比较与融合的研究. 中华核医学杂志, 2001, 21(5):261-262.
[12]杨星, 张林.PET 与 CT、MRI图像融合的临床应用.中华核医学杂志, 2005, 25(5): 290.
[13]张锦翔, 李林, 宋志坚. 人脑MRI和PET图像的融合方法.解剖学杂志,2005, 28(2): 131-134.
[14]张祥松, 何作祥. PET发射和透射扫描三维图像融合显示技术的建立. 中华核医学志, 2004, 24(3): 41-43.
[15]管一晖, 左传涛, 赵军, 等. PET/CT在肿瘤三维适形放疗中的方法学建立和应用. 中华核医学杂志, 2006,26(6): 31-33.
[16]李坤成, 刘景文, 赵欣, 等. MRI与正电子发射体层摄影图像配准和融合技术在Alzhermer病诊断中的初步应用. 中华核医学杂志, 2001, 35(1): 51-53.
[17]阮春, 李月卿, 王昌元. 医学图像融合技术及其应用研究概况. 医学影像学杂志, 2001, 11(6): 408-410.
[18]Brown LG. A survey of image registration techniques.Assoc Comput Mach, 1992, 24(4): 325-376.
