重组纤维连接蛋白诱导自体CIK联合IFN-α治疗晚期肝癌疗效*
2011-09-18徐本玲高全立范瑞华张成娟宋永平
徐本玲,袁 龙,高全立,范瑞华,张成娟,宋永平
1)郑州大学附属肿瘤医院中心实验室郑州450008 2)郑州大学附属肿瘤医院普外科郑州450008 3)郑州大学附属肿瘤医院生物治疗科郑州450008
(2010-12-23收稿 责任编辑 赵秋民)
肝癌在我国是一种常见的恶性肿瘤,占恶性肿瘤死亡率的第二位,其预后差,非切除的姑息性治疗5 a生存率不到10%[1-2]。细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK)的抗肿瘤效果已经在许多动物实验和临床试验中得到证实[1,3]。郑州大学附属肿瘤医院采用重组纤维连接蛋白(retronectin,RN)诱导自体CIK联合干扰素-α(interferon-α,IFN-α)治疗晚期肝癌,并评价此方法的可行性及临床应用效果,现报道如下。
1 对象与方法
1.1 一般资料 收集2009年1月至2010年12月就诊于郑州大学附属肿瘤医院的复发难治的Ⅲ、Ⅳ期肝癌患者14例,中位年龄55(41~78)岁,男10例,女4例。所有患者均被组织病理学明确诊断为肝癌,乙肝表面抗原阳性,均有可测量病灶,预计生存期≥3个月;Karnofsky评分≥60,血常规正常(白细胞计数≥4.0×109L-1,淋巴细胞计数≥0.8×109L-1,血红蛋白≥100 g/L,血小板计数≥100 ×109L-1),心、肺、肝、肾功能正常,无严重伴随疾病。该研究得到郑州大学附属肿瘤医院伦理委员会的批准,所有患者均签署知情同意书。
1.2 自体CIK的制备 抽取患者外周血50 mL,经人淋巴细胞分离液密度梯度离心获得外周血单个核细胞(PBMC),悬浮于含体积分数为2%自体血浆的GTT-551(TaKaRa公司)无血清培养基,培养当天加入重组人IFN-γ(1 000 U/mL),24 h后转入经5 mg/L RN和抗CD3单克隆抗体(mAb)包被过的培养瓶中,加入IL-2(500 U/mL),在37℃、体积分数为5%CO2培养箱中培养。第4天将刺激后的细胞转入GTT610培养袋中,同时补充体积分数为2%自体血浆的无血清培养基,以后每3 d补加新鲜培养基,同时补加IL-2(500 U/mL)。培养第10、15和20 d分别测定细胞表型并行细胞计数。细胞回输前5 d抽取20 mL培养液进行细菌真菌检测,回输当天进行内毒素检测和细胞表型分析。
1.3 治疗方法 所有患者接受4~6次自体RN诱导的CIK细胞治疗,每周1次,每次回输后如无不良反应则继续完成以后的治疗。每次回输的CIK细胞不少于5×109,CD3+CD56+的细胞比例不低于20%。14例患者均同时接受1周3次的3×106IU/次的IFN-α的治疗。此外,有9例患者在回输CIK的同时接受IL-2(1×106IU/d,共5 d)和胸腺肽α1(1.6 mg/d,共 5 d)治疗。
1.4 观察指标 ①监测治疗中和治疗后局部或全身的毒副反应,毒副反应分级按照世界卫生组织标准评估。②检测治疗前后患者外周血AFP,用流式细胞术检测免疫功能变化情况。③采用BDTM-CBA Human Th1/Th2型细胞因子试剂盒(美国BD公司)检测治疗前及疗程结束后7 d外周血IFN-γ、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)和 IL-4的变化。④治疗结束后1个月,以后每3个月行CT、超声及MRI等进行疗效评估。参照 WHO实体瘤疗效判定标准,以完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)进行疗效评定,临床获益=CR+PR+SD。
1.5 统计学处理 采用SPSS 13.0进行分析,应用配对t检验比较培养前后细胞的免疫表型特征、治疗前后患者外周血淋巴细胞亚群、临床获益和无反应患者治疗前后外周血细胞因子的变化,检验水准α=0.05。
2 结果
2.1 CIK细胞的体外分析 经过15 d的培养,细胞处于对数生长期,细胞活性均在97%以上,CD3+CD56+的细胞占 15.9%(14.8% ~ 17.3%),CD3+CD8+的细胞占 74.5%(61.5% ~79.6%),故取培养15 d的CIK细胞用于回输。
2.2 毒副作用 所有患者均很好耐受,1例首次回输CIK后3 h出现发热(38℃),未经处理,5 h后体温恢复正常。应用IFN-α和IL-2后8例患者出现2度发热,给予消炎痛栓后得以控制。治疗中及随访过程中均未见局部和全身明显毒副作用,患者肝肾功能治疗前后未见明显变化,未见骨髓抑制。
2.3 疗效评价 14例患者共接受64次CIK细胞的回输,回输细胞数平均25.6×109(21.6×109~31.8×109)。AFP下降3例,无明显变化4例,升高7例。14例患者中无CR病例,1例PR,4例SD(其中2例患者的AFP水平有明显下降),9例PD,临床获益率达35.7%。4例SD患者分别在随访到7、8、10、10个月时病情进展。
2.4 CIK治疗前后患者外周血中的细胞亚群和细胞因子分析 不管是临床获益的患者还是无反应患者,淋巴细胞数均有明显升高(表1、2)。治疗后临床获益患者血清IFN-γ和TNF-α水平较治疗前升高(表3),而在无反应患者细胞因子的分泌则无明显变化(表4)。

表1 临床获益患者治疗前后外周血淋巴细胞亚群分析(n=5) ×106 L-1
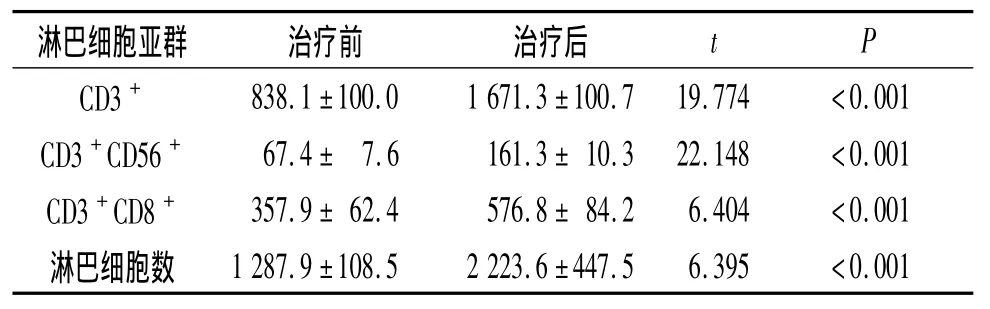
表2 无反应患者治疗前后外周血淋巴细胞亚群分析(n=9) ×106 L-1
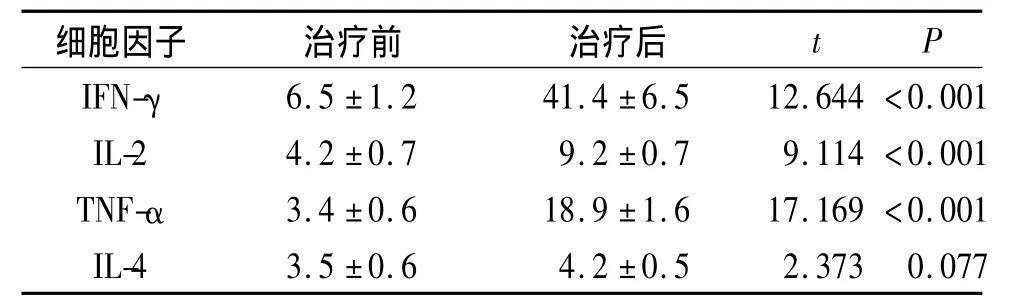
表3 临床获益患者治疗前后外周血细胞因子的变化(n=5) ng/L

表4 无反应患者治疗前后外周血细胞因子的变化(n=9) ng/L
3 讨论
CIK是一群增殖率髙并具有抗肿瘤活性的异质细胞,通过穿孔素/颗粒酶杀伤肿瘤细胞,此外,自然杀伤细胞表面受体NKG2D和淋巴细胞功能相关抗原1黏附受体(lymphocyte function-associated antigen-1,LFA-1)的激活也有助于CIK识别和杀伤肿瘤细胞[4-6]。
为了保证受者和公众的安全,防止感染性试剂(异体血清等)通过细胞治疗产品进行传染是非常重要的,同时也为了尽量保证CIK的一致性,无血清培养是一种理想的制备细胞治疗产品的方法,但却又面临制备的细胞数量不足的障碍。作者选用RN参与诱导CIK,获得的CIK一致性较好,培养到第15天左右时CIK的主要效应细胞CD3+CD56+细胞所占比例均在15%以上,CD3+CD8+细胞所占比例均在60%以上,细胞活性在96%以上,细胞数量均可达到5×109,可以满足临床需要。CIK回输后,所有患者均耐受性好,未见明显不良反应。
Olioso等[7]将CIK用于复发难治的霍奇金淋巴瘤、非霍奇金淋巴瘤、肝癌及肾癌等的治疗,均取得了令人鼓舞的效果。在该研究中也观察到,采用RN刺激的自体CIK联合IFN-α治疗晚期肝癌,1例获PR,4例SD,临床获益率达35.7%。临床获益患者和临床无反应患者回输的CIK的数目和次数均无明显差异,但在治疗后临床获益患者外周血中Th1类细胞因子(IFN-γ,TNF-α)明显高于治疗前,而治疗无反应患者治疗前后细胞因子的分泌无明显变化。
总之,RN诱导的自体CIK联合IFN-α治疗晚期肝癌取得了较好的疗效,也对其他实体瘤的临床治疗有一定的借鉴作用。
[1] Ma H,Zhang Y,Wang Q,et al.Therapeutic safety and effects of adjuvant autologous RetroNectin activated killer cell immunotherapy for patients with primary hepatocellular carcinoma after radiofrequency ablation[J].Cancer Biol Ther,2010,9(11):903
[2]孙燕,石远凯.临床肿瘤内科手册[M].5版.北京:人民卫生出版社,2007:7
[3] Linn YC,Hui KM.Cytokine-induced NK-like T cells:from bench to bedside[J].J Biomed Biotechnol,2010,2010:435745.Epub 2010 Mar 30.
[4]段秀梅,谭岩,宋燕,等.流式细胞术检测CIK的免疫表型和体外杀伤活性[J].吉林大学学报:医学版,2006,32(4):639
[5]刘桂举,梅家转,栗敏,等.细胞因子诱导的杀伤细胞免疫表型及其对EC9706细胞杀伤活性的影响[J].郑州大学学报:医学版,2010,45(1):24
[6] Kuci S,Rettinger E,Voss B,et al.Efficient lysis of rhabdomyosarcoma cells by cytokine-induced killer cells:implications for adoptive immunotherapy after allogeneic stem cell transplantation[J].Haematologica,2010,95(9):1579
[7] Olioso P,Giancola R,Contento A,et al.Immunotherapy with cytokine induced killer cells in solid and hematopoietic tumours:a pilot clinical trial[J].Hematol Oncol,2009,27(3):130