氯化锂-紫外-离子束复合诱变红霉素高产菌株研究
2011-09-18龚文静
虞 龙,张 宇,龚文静,安 肖,徐 翔
(1.南京工业大学 生物与制药工程学院,江苏 南京 210009;2.中国兽医药品监察所,北京 100081)
红霉素是1952年问世的第1个由放线菌产生的14元环大环内酯类抗生素,抗菌谱与青霉素相似,主要是对革兰氏阳性菌如金葡菌、溶血性链球菌、肺炎球菌、白喉杆菌、炭疽杆菌及梭形芽胞杆菌等有强大的抗菌作用[1]。虽然现今抗菌药物越来越多,红霉素在治疗领域仍占有自己的地位。尤其是半合成红霉素衍生物的开发成功如阿齐霉素、甲红霉素、地红霉素、罗红霉素、氟红霉素等,使得大环内酯类抗生素在未来的抗感染药物中所拥有的市场份额进一步提升和扩大。
在几种可行易操作的诱变方法中,紫外诱变可使DNA分子形成嘧啶二聚体,即两个相邻的嘧啶共价连接;氯化锂诱变可导致AT-GC碱基对的转换或导致碱基的缺失;离子束诱变是利用正电荷低能离子束注入生物体引起遗传物质的可遗传性改变。离子束对生物体有能量沉积、动量传递、粒子注入和电荷交换等4个原初反应过程[2],生物体从而产生DNA分子断裂、碱基缺失等物理损伤、自由基化学损伤等多种生物学效应[3]。复合诱变包括两种或多种诱变剂的先后使用、同一种诱变剂的重复作用和两种或多种诱变剂的同时使用。普遍认为[4],复合诱变具有协同效应,两种或两种以上诱变剂合理搭配进行复合诱变较单一诱变效果好。
本文将紫外-氯化锂-离子束结合起来对红霉素生产菌——红色链霉菌进行复合诱变。
1 材料与方法
1.1 菌种
红色链霉菌,实验室保存。
1.2 培养基
斜面/平板培养基:蛋白胨1.0%,玉米浆1.0%,淀 粉 1.0%,硫 酸 铵 0.3%,氯 化 钠0.3%,碳酸钙0.25%,琼脂1.5%,pH=6.5。
氯化锂平板培养基:平板培养基加上一定浓度的氯化锂。
种子培养基:淀粉3.5%,硫酸铵0.75%,氯化钠0.5%,蛋白胨0.5%,糊精2.0%,葡萄糖3.0%,酵母粉2.0%,碳酸钙0.8%,硫酸镁0.05%,磷 酸 氢 二 钾 0.08%,豆 油 0.2mL/25mL,pH=6.5。
发酵培养基:淀粉3.0%,硫酸铵0.5%,葡萄糖2.0%,玉米浆0.1%,碳酸钙0.9%,豆油0.3mL/25mL,pH=6.5。
1.3 培养条件
斜面/平板培养:用无菌操作将孢子悬浮液接于斜面/平板培养基上,置37℃恒温室中培养6~7d。
种子培养:在250mL三角瓶内装50mL种子培养基,接种量为10%,于33℃下培养72h,摇床转速为220r/min。
发酵培养:摇瓶为500mL三角瓶,装液量50%,接种量10%,于33℃下培养7d,摇床转速为220r/min。
1.4 诱变及筛选方法
1.4.1 单孢子悬浮液制备 成熟的新鲜斜面加无菌水10mL,刮洗下培养好的新鲜斜面孢子后倾于带有一定玻璃珠的250mL三角瓶内振摇 20min(250r/min),取出过滤成菌悬液[5],备用。
1.4.2 氯化锂处理 取0.2mL菌悬液均匀涂布于不同浓度(0.3%、0.6%、0.9%、1.2%、1.5%、1.8%)的氯化锂平板培养基上,同条件下无氯化锂的平板培养基为对照样。
1.4.3 紫外诱变处理 取0.2mL菌悬液均匀涂布于生长平板培养基上,先开启20W紫外灯,预热20min,再将培养皿放在紫外灯下30cm 处,打开平皿盖,照射30、60、90、120、150、180s,同条件下不进行照射的为对照样。
1.4.4 离子束诱变处理 取0.1mL菌悬液均匀涂布于无菌平皿上,以无菌风吹干。镜检无细胞重叠者进行离子注入。注入能量为10keV,注量(×1014)为50、100、150、200、250、300cm-2,靶室真空度为10-3Pa。将平皿置于靶台上,以10s脉冲式注入,间隔50s,以降低温度效应的影响,靶室内放置不接受照射的对照样。离子注入后,取出平皿,以1mL无菌水洗脱,涂平板培养基。
1.4.5 氯化锂-紫外-离子束复合诱变 将菌悬液先涂布于含有一定浓度氯化锂的平板培养基上,经紫外灯照射一定时间后进行培养,待其成熟制作成菌悬液进行离子注入,注入后再将其涂布于氯化锂平板培养基上;以相同的操作,取未经氯化锂、紫外线、离子束处理的菌悬液稀释涂布平板为对照样。
1.4.6 筛选方法 从培养成熟的平板菌落中挑选正常型菌落接斜面,待生长成熟后按10%接种量接入摇瓶进行培养。
1.4.7 存活率和正突变率计算 菌株的存活率为其诱变后在平板培养基上生长的菌落数与同条件下未经诱变的对照菌株在平板培养基上生长的菌落数的比值。正突变率为效价与对照菌株相比提高在5%以上的菌株占全部被考察菌株的比例。
1.5 分析方法
1.5.1 pH测定 取摇瓶发酵液过滤后用上海雷磁pHS-3B型精密pH计测量。
1.5.2 残糖测定 发酵液过滤后稀释一定倍数,采用SBA40型生物传感器进行测定。
1.5.3 产物液相测定 色谱柱,不锈钢柱(内装填 料 PLRS-S,10nm,长 250mm,内 径4.6mm,Agilent);流动相,乙腈与0.04mol/L NH4H2PO4体积比为1∶2混合液,pH=7.0;检测波长,210nm;柱温,室温;流速,1.0mL/min;进样量,100μL[6]。
2 结果与讨论
2.1 氯化锂剂量确定
在经氯化锂处理后的每个剂量的平板中各挑出20个菌株进行摇瓶试验,考察氯化锂浓度对红色链霉菌存活率和正突变率的影响,结果如图1所示。在存活率逐渐下降的情况下,突变率呈先上升后下降的趋势,当氯化锂浓度为1.2%时,红色链霉菌的存活率为90.15%,同时正突变率最高,为16.22%。因此,本实验确定1.2%为最佳氯化锂诱变剂量。
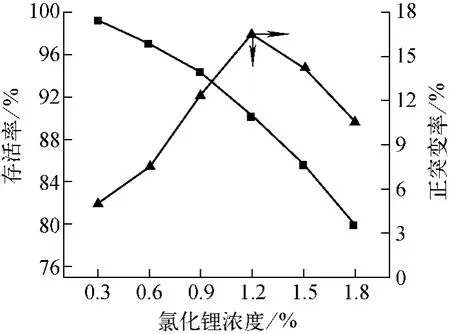
图1 不同氯化锂浓度下菌种的存活率和正突变率Fig.1 Survival rate and mutation rate with different concentrations of LiCl
2.2 紫外剂量确定
在经紫外照射处理后的每个剂量的平板中各挑出20个菌株进行摇瓶试验,考察紫外辐照时间对红色链霉菌存活率和正突变率的影响,结果如图2所示。据文献报道[4],采用紫外线诱变,一般致死率为70%~80%时,产生正突变的几率较高,有利于突变株的进一步筛选。由图2可见,紫外具有较强的杀菌能力,辐照120s时,正突变率最高,达20.05%,同时存活率仅21.83%,辐照180s时几乎无菌存活。因此,本实验确定120s为最佳紫外诱变时间。

图2 不同紫外照射时间下菌种的存活率和正突变率Fig.2 Survival rate and mutation rate with different time of UV
2.3 离子束注量确定
在经离子束诱变后的每个注量的平板中各挑出20个菌株进行摇瓶试验,考察离子束注量对红色链霉菌存活率和正突变率的影响,结果如图3所示。对于10keV氮离子,离子注量小时菌株的存活率较高,注量增大存活率呈下降趋势,但在200×1014cm-2附近,存活率有短暂回升,整个存活率曲线呈“马鞍形”,同时正突变率也达28.73%。对于“马鞍型”曲线形成的原因,宋道军等[7]认为当注量较小时,存活率下降是能量沉积效应和动量传递效应综合作用的结果。因小注量下低能N+的直接作用可导致DNA的损伤,能量沉积所产生的大量自由基亦会导致DNA和生物膜等其他生物大分子的损伤,从而造成存活率下降。继续提高注量,大量连续注入电荷的堆积会产生很强的库仑斥力,这种库仑斥力能对被注入细胞形成一“保护屏障”,阻碍后续注入离子对细胞的损伤,从而达到对细胞的保护作用;且大量堆积的电荷可形成一弱电场,这种电场的刺激效应可激活菌体内的各种酶,尤其是修复酶,从而提高了损伤修复的效率,存活率又有所回升。当注量继续增大时,能量沉积和动量传递所造成的DNA和生物膜等其他生物大分子的严重损伤已超出其所具有的修复能力,聚集于细胞表面的电荷产生库仑爆炸,使细胞失去电荷屏蔽而使存活率急剧下降。另外,在200×1014cm-2下,菌株的正突变率最高,与其对应的存活率一致,因此,本试验确定200×1014cm-2为最佳离子束诱变注量。

图3 不同氮离子注量下菌种的存活率和正突变率Fig.3 Survival rate and mutation rate with different ion fluences
2.4 复合诱变对菌体的影响
按上述确定的诱变条件进行氯化锂-紫外-离子束复合诱变。取在最优条件下分别经氯化锂、紫外、离子束与复合诱变的正突变菌株各50株进行摇瓶发酵,结果列于表1。由表1可见,复合诱变的存活率最低,但正突变率高达43.50%,效价提高幅度大的菌株所占比例最高。在3种单一诱变方式中,氯化锂诱变的存活率最高,但效价提高10%以上的菌株比例不高;紫外诱变的存活率最低,菌株提高幅度也不大;经离子束诱变的菌株存活率虽不高,但正突变率最高,且菌株产量提高幅度高于其他两种诱变方式。可见,如果要使用单一诱变方式,可选择用离子束进行诱变。由多次复合诱变筛选到1株高产菌株,命名为E0317-1-7-26。
2.5 高产菌株分离稳定性考察
将高产菌株 E0317-1-7-26作为出发菌株,分离3代,进行产量测定,考察其分离稳定性,结果示于图4。由图4可见,每代的产量提高幅度均呈下降趋势,但第3代产生回复性趋势。结果表明,经3代分离后,菌体不但稳定性增强,而且产量也有稳定性提高。

表1 诱变结果Table 1 Result of mutation

图4 菌体的效价提高范围Fig.4 Increasing range of high-producing strain titer
2.6 高产菌株遗传稳定性考察
将出发菌株和高产菌株 E0317-1-7-26各传代5次,每代3个平行样,发酵完进行产量测定,取3个样的平均值,考察高产菌株遗传稳定性,结果列于表2,其中F1~F5分别表示第1至第5代。由表2可知,高产菌株E0317-1-7-26经传代5次后,效价略有下降,F2虽下降幅度较大,但F3效价回复性提高,然后逐渐稳定。平均效价达7 093μg/mL。

表2 高产菌株的遗传稳定性考察结果Table 2 Inheritance stability of high-producing strain
3 结论
以上实验结果表明,不同诱变方式对红色链霉菌产生了不同的生物效应,单独使用一种诱变方式可获得突变菌株,但几率很低。某一菌株长期使用诱变剂后,会对诱变剂产生“钝化效应”。因此,目前在实验中多采用几种诱变剂复合处理、交叉使用的方法进行菌种选育。相关资料[8]也表明,复合诱变较单诱变剂处理后的效果好,通常是物理诱变复合化学诱变。在诱变育种中,诱变剂的选择较为重要,选择较合适的诱变剂会大幅减少工作量。
由表1可看出,复合诱变能在很大程度上获得高产菌株,紫外和离子束诱变过的菌株经氯化锂作用,其提高的抗生素效价能够保持稳定,这可能与氯化锂能够抑制菌体的自我修复有关。经紫外和离子束诱变过的存活孢子经氯化锂作用,有“提高突变‘易出误差’修复”的作用[9],即氯化锂可稳定紫外和离子束所引起的遗传物质的改变。但不是所有的诱变剂都对所选的菌株产生相同的诱变效应,菌株本身对不同的诱变剂的抵抗能力不同。在这3种诱变方式中,对红色链霉菌而言,离子束作为单因素诱变效果最好(图3)。总之,本实验结果证实了在红色链霉菌育种中,复合诱变优于单因素诱变,筛选到目的菌株的概率相对较大。
本文研究了利用氯化锂、紫外和离子束复合诱变选育红霉素生产菌——红色链霉菌,比较了3种诱变方式的不同诱变结果,由此确定氯化锂的最优诱变浓度为1.2%,紫外的最优诱变时间为120s,离子束的最优诱变注量为200×1014cm-2。再将3种最优诱变条件组合,用复合诱变方法筛选到1株高产菌株E0317-1-7-26。与出发菌株相比,高产突变菌株发酵生产红霉素的能力从5 923μg/mL提高到7 126μg/mL,且遗传性能稳定,为实现红霉素的产业化生产提供了保证。另外,该方法可快速有效地获得较理想的抗生素高产稳产优良菌株,拓宽了它在制药生物工程中的应用前景,为今后微生物诱变选育打下了坚实的基础。
[1]朱明珍.红霉素35年:产生菌及其发酵[J].中国抗生素杂志,1987,12(6):463-470.ZHU Mingzhen.Erythromycin 35years:Producer and fermentation[J].Chinese Journal of Antibiotics,1987,12(6):463-470(in Chinese).
[2]SHAO C L,WANG X Q,YU Z L.Phosphate release from N+ions irradiated 5′-CMP nucleotide and its kinetics[J].Radiation Physics and Chemistry,1997,6(50):561-565.
[3]虞龙,张宁.离子注入微生物诱变育种的研究与应用进展[J].微生物学杂志,2005,25(2):80-83.YU Long,ZHANG Ning.Advance in research and application of microbial mutation breeding by ion implantation[J].Journal of Microbiology,2005,25(2):80-83(in Chinese).
[4]郭继平,马莺.紫外诱变选育米曲霉高产蛋白酶菌株[J].微生物学通报,2007,34(2):246-250.GUO Jiping,MA Ying.BreedingAspergillus oryzaestrain with high protease activity by ultraviolet induced mutation[J]. Microbiology,2007,34(2):246-250(in Chinese).
[5]王啸,邱树毅,何腊平.UV,LiCl复合诱变深黄被孢霉选育多不饱和脂肪酸高产菌株[J].食品科学,2004,25(4):50-52.WANG Xiao,QIU Shuyi,HE Laping.Screening of a high polyunsaturated fatty acid yield withMortierellaisabellinamutated by UV and LiCl[J].Food Sci,2004,25(4):50-52(in Chinese).
[6]张立军.红霉素含量的HPLC测定[J].山东医药工业,2000,19(6):13-15.ZHANG Lijun.Determination of erythromycin by HPLC[J].Shangdong Pharmaceutical Industry,2000,19(6):13-15(in Chinese).
[7]宋道军,姚建铭,余增亮,等.离子注入微生物产生“马鞍型”存活曲线的可能作用机制[J].核技术,1999,22(3):129-132.SONG Daojun,YAO Jianming,YU Zengliang,et al.A possible mechanism of dose related survival of microorganism implanted by N+ions[J].Nucl Tech,1999,22(3):129-132(in Chinese).
[8]吴华昌,马钦元,邓静,等.不同诱变方法对紫红曲霉产红色素的影响[J].中国酿造,2010,214(1):55-57.WU Huachang,MA Qingyuan,DENG Jing,et al.Effects of mutation methods on pigments production byMonascuspurpureus[J].China Brewing,2010,214(1):55-57(in Chinese).
[9]王从,方金瑞.抗生素[M].北京:科学出版社,1988:177-212.
