尿N-乙酰-β-D-氨基葡萄糖苷酶对监测甲氨蝶呤肾脏毒性的意义
2011-09-17潘文萍
赵 霞,潘文萍
(山东省千佛山医院药学部,山东 济南 250014)
甲氨蝶呤是治疗类风湿性关节炎(RA)的重要药物,患者往往长达数十年服用该药。甲氨蝶呤的血液和肝脏毒性早已被人们重视,但长期服用甲氨蝶呤导致的肾脏毒性鲜见报道。笔者选用反映肾脏早期损伤的灵敏指标尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)、尿微量白蛋白作为监测项目,对服用甲氨蝶呤不同年限的类风湿性关节炎患者进行检测,以期对长期服用甲氨蝶呤的肾脏毒性作有益探索。
1 资料与方法
1.1 临床资料
选择2008年7月至2009年9月在本院风湿免疫科门诊和住院的服用甲氨蝶呤的类风湿关节炎患者61例,诊断均符合美国风湿病学院1987年修订的《类风湿性关节炎分类标准》[1]。其中女56例,男 5例;年龄 15~37岁,平均(23.6±9.4)岁;病程 3~60月,平均(10.2±28)月;合并高血压3例,脑梗死2例,糖尿病1例,其余患者均无其他合并症。所有患者均长期服用甲氨蝶呤,服用方法甲氨蝶呤10 mg、每周1次,按其服用甲氨蝶呤的时间分为0~1(含 1年)年组、1~3(含 3 年)年组、3~5(含 5 年)年组。正常对照组为本院年龄、性别匹配的体检正常人群30例。
1.2 检测方法
取清晨新鲜尿液检测。应用对硝基本苯酚(PNP)比色法,用浙江夸克生物科技有限公司提供的试剂盒测定尿中NAG活力单位。将尿NAG测定值和尿肌酐比值表示尿NAG活性,从而纠正因尿液浓缩或稀释所测得NAG活性差异。采用酶终点比色法、Roche试剂,利用Bechman全自动生化分析仪进行尿肌酐检测。
采用速率散射比浊法、德国德灵试剂,利用BN Prospec特种蛋白分析仪测定尿微量清蛋白(mALB)、尿α1-微球蛋白(α1-MG)。采清晨空腹静脉血3 mL,离心取血清,以Roche试剂,利用Bechman全自动生化分析仪检测血清尿素氮和肌酐。
1.3 统计学处理
采用SPSS 12.0统计软件,计数资料差异性比较采用 χ2检验,计量资料用均数差异显著性 t检验。
2 结果
结果见表1。服用甲氨蝶呤不同年限的类风湿性关节炎患者的血清尿素氮和肌酐均在正常范围内。0~1年组、1~3年组、3~5年组类风湿性关节炎患者尿mALB排出量虽略高于正常对照组,但不存在统计学差异;0~1年组、1~3年组类风湿性关节炎患者尿α1-MG排泄量较正常对照组无差异,而3~5年组较正常对照组存在统计学差异;类风湿性关节炎患者尿NAG活性随服用甲氨蝶呤的时间的延长而增高,0~1年组与正常对照组无差异,1~3年组、3~5年组与正常对照均存在统计学差异。结果见表1。
表1 服用甲氨蝶呤的类风湿性关节炎患者和正常对照组尿NAG活性和尿微量蛋白比较(±s)
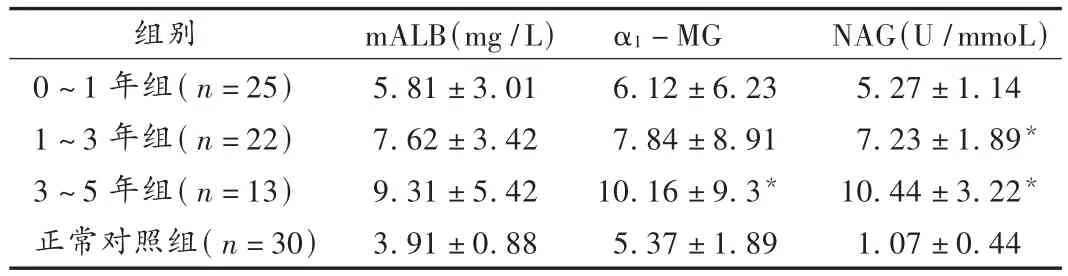
表1 服用甲氨蝶呤的类风湿性关节炎患者和正常对照组尿NAG活性和尿微量蛋白比较(±s)
注:与正常对照组比较,*P <0.01。
组别0~1年组(n=25)1~3年组(n=22)3~5年组(n=13)正常对照组(n=30)mALB(mg/L)5.81 ± 3.01 7.62 ± 3.42 9.31 ± 5.42 3.91 ± 0.88 α1-MG 6.12 ± 6.23 7.84 ± 8.91 10.16 ± 9.3*5.37 ± 1.89 NAG(U/mmoL)5.27 ± 1.14 7.23 ± 1.89*10.44 ± 3.22*1.07 ± 0.44
3 讨论
甲氨蝶呤为治疗类风湿性关节炎的一线慢作用抗风湿药,患者往往需要长期服用。甲氨蝶呤的疗效-毒性之比令人满意,有研究证实了长达90个月的疗效及耐受性[2]。然而,甲氨蝶呤毕竟是一个具有一定毒性的药物,约7%~30%的患者因其毒性作用而停药,甚至导致个别患者死亡[3]。甲氨蝶呤可引起多系统的毒副作用,常见的有消化道反应、皮肤黏膜损害、肝功能损害、骨髓抑制和肾脏损伤[4],已引起临床医师的注意,但甲氨蝶呤的肾脏损伤多被人们忽视。临床上尚未有长期服用甲氨蝶呤导致肾功能不全的报道,但服用甲氨蝶呤是否存在轻微的肾脏损伤,目前鲜有研究。
为研究长期服用甲氨蝶呤患者是否存在肾损伤,选择了反映早期肾功能损伤的敏感指标尿NAG活性、尿mALB、尿α1-MG3项作为检测项目。正常老年人尿NAG活性较正常成年人偏高,可能与年龄增大、肾单位减少,肾功能减退有关[5]。为排除这些因素对研究结果的影响,选择的研究人群平均年龄为(23.6±9.4)岁,合并糖尿病、高血压等可能影响肾脏功能的慢性疾病者较少。结果发现,不论患者服用甲氨蝶呤的时间长短,其尿mALB排出量异常率不高,与正常对照组无统计学差异;而尿NAG活性、尿α1-MG随着服用药物的时间延长均出现异常,与正常对照人群有统计学差异。尿酶主要源于肾小管上皮细胞,故对肾小管损伤有诊断价值。其中NAG是一种相对分子质量约为130 000的溶酶体水解酶,不能通过肾小球滤过膜,由近曲小管上皮细胞刷状缘合成并分泌,其在尿中增高反映肾小管结构损伤;由于NAG在尿液中不易失活,且正常时尿NAG排出量相对恒定,是肾小管功能损害最敏感的指标[6]。尿 α1-MG是一种低分子糖蛋白,游离 α1-MG能自由通过肾小球滤膜,绝大部分在近曲小管被重吸收或降解,当肾小管受损时,尿α1-MG排泌增高[7]。尿α1-MG也是早期肾小管损害的指标,与尿NAG具有良好相关性,但灵敏度不及尿NAG[5]。mALB是一种带有负电荷的大分子蛋白,正常情况下只有极少量的白蛋白可以通过尿液排出到体外。正常状态下,mALB很难通过肾小球基底膜。任何能够引起肾小球基底膜通透性增高的病变,均可导致mALB的排出升高,尿mALB的异常反映早期肾小球的损害。综合研究结果,笔者推断,甲氨蝶呤的肾脏损害主要在肾小管,而非肾小球。
氨基苷类药物所引起的肾毒性损害中,尿NAG酶均明显增高,且较其他尿酶的增高更早出现。由于尿NAG酶较敏感,因此临床上常用来作为肾毒性药物的监护指标[8]。笔者也选择此项灵敏指标探究甲氨蝶呤的早期肾脏损害。结果发现,1~3年组服用甲氨蝶呤的类风湿性关节炎患者在尿α1-MG排泄量正常的情况下,尿NAG活性已出现异常,相比较而言,尿NAG活性异常出现的时间较早,这与尿NAG更灵敏有关。这也说明甲氨蝶呤的肾损害较轻微,应用一些灵敏指标才可监测到。尿NAG酶的检测特异性强、灵敏度高、简便易行,可作为监测服用甲氨蝶呤患者肾脏损害的指标。
[1]美国风湿病学会.类风湿关节炎分类标准[J].中华风湿病学杂志,1998,2(2):120.
[2]KremerJM,PhelpsCT.Long-term prospective study ofthe use of methotrexate in the treatmenf of rheumatoid arthritis[J].Arthritis Rheum,1992,35(2):138 -145.
[3]Weinblatt ME,Weissman BN,Holdsworth DE,et al.Long- term prospective study of methotrexate in the treatment of rheumatoid arthritis[J].Arthritis Rheum,1992,35(2):129 -137.
[4]姚 建.肾小管标志蛋白及其临床意义[J].中华肾脏病杂志,1997,13(2):113-115.
[5]贺进良,朱建军.100例老年人尿NAG、尿沉渣定量检测结果分析[J].中国现代实用医学杂志,2006(6):80-81.
[6]Kobayashi E,Suwazono Y,Uetani M,et al.Estimation of benchmark dose as the threshold levels of urinary cadmium,based on excretion oftotalprotein,beta2-microglobulin,and N-acteyl-beta-D-glucosaminidase in cadmium nonpolluted regions in Japan[J].Environ Res,2006,101(3):401 - 406.
[7]刘尚全.尿微球蛋白检测在糖尿病肾病早期诊断中的意义[J].安徽医科大学学报,2007(5):152-154.
[8]Langhendries JP,Mattor M,Framcose A,et al.Validity of N - acetylbeta-D-glucosaminidase(NAG)determination in assessing netilmicin nephrotoxicity in preterm babies[J].Biol Neonate,1989,56(2):76.
