pH值对水热合成黄铁矿型CoS2微晶的影响
2011-09-15谢玲玲孙言飞简基康
谢玲玲 吴 荣 李 锦 孙言飞 简基康
(新疆大学物理科学与技术学院,乌鲁木齐 830046)
pH值对水热合成黄铁矿型CoS2微晶的影响
谢玲玲 吴 荣 李 锦 孙言飞 简基康*
(新疆大学物理科学与技术学院,乌鲁木齐 830046)
本文以EDTA-2Na为辅助剂,Na2S2O3·5H2O为硫源,运用水热法制备了黄铁矿型CoS2微晶,研究了溶液pH值对产物结构和形貌的影响。采用X射线粉末衍射仪(XRD),扫描电子显微镜(SEM)对产物的结构和形貌进行了表征。实验结果表明,溶液为酸性环境时(pH=1、3)可得到纯相的黄铁矿型CoS2微晶,形貌为微米尺寸的空心球壳。溶液为中性和碱性环境时(pH=7、11),产物出现少量杂相,形貌变为规则的八面体晶粒。讨论了这些CoS2微晶的形成机制。
CoS2;水热合成;pH值;形貌
黄铁矿型的CoS2半导体材料具有优异的光学、电学、磁学等性质[1],如半金属铁磁性[2-3]、高的自旋极化[3],在催化、光伏、电子等领域拥有重要的应用前景[4]。近年来,制备CoS2的研究取得较大进展,尤其是在液相中制备具有特殊形貌和尺寸的CoS2纳米及微米晶的研究工作取得了一些重要的成果[5-13]。Qian等[5]以乙二胺为溶剂,Na2S3为硫源在130℃下合成立方体形貌的CoS2纳米晶,粒径为20 nm;Bi等[6]用聚合物为模板合成了针状和棒状非晶CoS2纳米粒子;张玲等[7]以NiSe作为晶种在碱性条件下水热合成CoS2晶体,并对产物进行结构精修,证实产物为黄铁矿型CoS2。王敏等[8]报道了无模板、无表面活性剂,水热合成立方相的CoS2空心微球。段鹤等[13]采用溶剂热法,以甲苯为溶剂,多硫化纳为硫源,制备了CoS2纳米晶。
在溶液相中生长晶体,体系的pH值对产物的物相和形貌有较大影响[14]。本文以EDTA-2Na为辅助剂,以Na2S2O3·5H2O为硫源,水热合成了CoS2微晶。讨论了溶液pH值对产物物相和形貌的影响。通过调整溶液的pH值,使产物CoS2的形貌从空心微球转变为规则的八面体晶粒。
1 实验部分
1.1 样品的制备
原料为氯化钴(CoCl2·6H2O,分析纯);EDTA-2Na(C10H14N2O8Na2·2H2O,分析纯);硫代硫酸钠(Na2S2O3·5H2O,分析纯);氢氧化钠(NaOH,分析纯);无水乙醇(CH3CH2OH,分析纯);去离子水。将35 mL去离子水注入容积为45 mL的反应釜中并投入4 mmol EDTA-2Na,待充分溶解后,按反应物比为nCoCl2·6H2O/nNa2S2O3·5H2O=1/2加入反应物并用磁子搅拌器搅拌15 min,充分混合后,滴入pH=12的氢氧化钠溶液调节混合溶液的pH值。反应釜密闭后置于恒温箱中,180℃下反应24 h后取出,自然冷却至室温。滤出釜底沉淀物,用无水乙醇和去离子水清洗数次,在60℃下真空干燥6 h,收集样品并进行测试。
1.2 样品的表征
采用MAC SCIENCE 18 kW转靶X射线衍射仪(XRD,Cu靶 Kα 射线,λ=0.154 05 nm,40 kV,200 mA)对样品进行物相分析。用扫描电子显微镜(SEM,Leo 1430VP 20 kV)对样品表面形貌进行观察。
2 结果与讨论
不同pH值的溶液水热生长后所得样品的XRD图如图1所示。XRD图显示,所有样品主晶相均为黄铁矿型CoS2(空间群为Pa3,ICDD PDF No.65-3322)。其中,pH=5时,样品中存在少量S(空间群为 Fddd,ICDD PDF No.42-1278)杂质,其衍射峰以“*”区分;pH=11时,样品的XRD图显示低角处存在 S8(空间群为 P2/c,ICDD PDF No.53-1109)衍射峰,如图中“○”所示。XRD表明,pH=5、11时产物中存在硫杂质,说明反应物未完全反应。仔细对比XRD图发现,pH=7,11时所得样品的XRD图中(311)、(220)等衍射峰相对强度增大,如pH=11时,图中(311)峰相对于(200)峰的衍射强度为68%,而在图1标准CoS2衍射谱中仅为32%,显示产物的形貌有可能发生变化。
图2为生长温度180℃,溶液的pH值为1,3时所得样品的SEM图像。图2(a)显示,pH=1时,样品由空心微球组成,微球的球形规则,直径达2~6 μm;从图2(b)中可看出,CoS2球壳厚约几百纳米,球壳表面凹凸不平,表明空心微球是由尺寸更小的颗粒组成的。图2(c),(d)显示,pH=3时,样品仍为空心微球,与pH=1时所得样品形貌类似,但球壳表面比较粗糙。王敏等[8]制备的CoS2空心球直径约为2 μm,球壳厚约100 nm。

图1 反应温度为180℃,不同溶液pH值,(a)1;(b)3;(c)5;(c)7;(d)11所得样品的XRD图Fig.1 XRD patterns of samples synthesized under different pH values of solution at 180℃

图2 反应温度为180℃所得样品的SEM图像Fig.2 SEM images of samples synthesized at 180 ℃when(a),(b):pH=1,(c),(d):pH=3
为了研究空心微球的形成机制,调节EDTA-2Na用量为5 mmol,溶液pH值为1,温度160℃,其他试验条件相同的情况下水热反应得到对比组样品。对比组样品的XRD及SEM如图3所示。XRD图显示,所得样品的主相为S(空间群为Fddd,ICDD PDF No.42-1278),图中标出了衍射强度较大的3个S 的衍射峰(222),(026),(206),其余未标注各峰也为S衍射峰。从其SEM图像中可看出,样品由大量S空心微球组成,微球的球形规则,直径达2~6 μm。右上角的插图显示,球壳由S纳米颗粒排列堆积而成的。
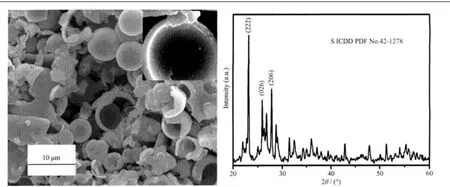
图3 EDTA-2Na用量为5 mmol,pH=1时所得样品的SEM图像及XRD图Fig.3 SEM image and XRD pattern of sample synthesized under pH=1 with the addition of 5 mmol EDTA-2Na
基于以上实验事实推测反应过程如下:起初,EDTA-2Na在水中电解出EDTA2-,并与Co2+形成稳定的螯合物Co(EDTA),与文献[15]报道的EDTA辅助生长FeS2纳米晶类似,这有效地抑制了游离的钴离子之间的聚合。接着,S2O32-不稳定而易分解出S和SO2,厌水的S聚集在SO2气泡表面形成了S空心微球。螯合物Co(EDTA)中未配位的羧基上存在着氢原子,因此容易吸附在电负性较大的S空心微球表面[16]。最终,Co2+从螯合物Co(EDTA)中缓慢释放与硫源反应生成黄铁矿型CoS2晶粒,这些晶粒在三维空间堆积形成了CoS2空心微球。王敏等[8]指出,在反应过程中,S2O32-分解出S单质,S形成球形微粒,Co2+与S反应生成CoS2,最终S被耗尽而形成空心结构的CoS2微球。由于本实验中使用了EDTA-2Na作为辅助剂,因此,虽然与王敏等[8]所得产物形貌类似,但反应过程是不同的。EDTA-2Na不仅作为一种常用的螯合剂,稳定了溶液中的Co2+浓度,并且作为一种酸提供了酸性环境,保障了足够多的SO2产生。在对比组实验中,EDTA-2Na的用量过大,Co2+难以从螯合物中逸出而无法与S空心微球反应生成CoS2。此外,本实验结果显示,S直接形成了空心微球结构,不是实心结构。
由上述生长实验结果,提出CoS2空心微球可能的生长机制两步模板法:第一步,S以分解出的SO2气泡为模板形成S空心微球[17-19];第二步,后继Co2+与S空心球模板反应生成CoS2空心微球。图4描述了CoS2空心微球的合成过程:气泡模板的形成、S空心球模板的形成、Co(EDTA)在S表面的吸附、CoS2空心微球的形成。

图4 CoS2空心微球形成过程演示图Fig.4 Schematic illustration of the possible formation process of CoS2hollow spheres
溶液的pH值为5、7、11所得样品已经XRD图证实主相为黄铁矿型CoS2,相应的形貌如图5所示。从图5中可看出,样品的形貌随着pH值的增加而改变。pH=5时,样品由类球形微粒组成,在这些微粒表面存在许多纳米量级的须状物,多个微粒间由须状物互相连接,团聚。pH=7、11时,样品形貌变为规则的八面体微粒,尺度约为1 μm。微粒之间互相团聚,同时还有一些外形不规则的纳米级颗粒吸附在微粒表面上。

图5 反应温度为 180 ℃,溶液 pH 值为(a)、(b):5;(c)、(d):7;(e)、(f):11 所得样品的 SEM 图像Fig.5 SEM images of samples synthesized under pH values of(a),(b):5;(c),(d):7;(e),(f):11 at 180℃
须状微粒形成的原因可能是吸附在S空心微球表面上的螯合物Co(EDTA)中未配位的羧基被OH-激活,不同微粒表面的活性羧基可与溶液中未配位的金属阳离子进一步螯合形成结构复杂的多元螯合物,微粒之间通过多元螯合物的作用而相互吸引、链接[20]。溶液pH值增大,导致产物的空心球壳形貌消失,可以用上述两步模板机制说明。在酸性环境中,S2O32-才能有效分解出SO2和S,保证气泡模板的供应。增大溶液的pH值,溶液中的S2O32-逐渐趋于稳定,体系缺失了软模板SO2气泡因而得不到具有空心结构的产物。此外,酸性环境中Co(EDTA)稳定性降低,Co2+的氧化能力增强,便于S球壳模板向CoS2球壳的完全转化。这也可以解释在pH值增大到5时,产物中出现了少量S杂质。据文献报道[21-22],在晶体生长过程中,那些表面能高的晶面由于具有较快的生长速率而在生长过程中慢慢消失。本体系中得到了八面体产物的原因可能是:在高pH值条件下EDTA2-会继续电离得到EDTA4-,其与Co2+形成水溶性配合物[Co(EDTA)]2-。[Co(EDTA)]2-在CoS2各晶面吸附量不同,那些吸附量大的晶面因生长较快而逐渐消失。pH=7、11时产物XRD图中峰强的变化间接证明了CoS2各晶面不同的生长速率。
3 结 论
本文以Na2S2O3·5H2O为硫源,在EDTA-2Na为辅助剂的条件下水热合成CoS2微晶。XRD与SEM分析表明,pH=1,3时合成样品为单一相的黄铁矿型CoS2空心微球。pH=5、7、11时,合成样品中存在硫杂质,产物的形貌由空心微球过渡到八面体微粒。结果表明在本体系中,pH值可以调节产物形貌,而空心微球结构的形成可以用两步模板的机制解释。
[1]Ennaoui A,Fiechter S,Pettenkofer C,et al.Sol.Energy Mater.Sol.Cells,1993,29:289-370
[2]Yamamoto R,Machida A,Moritomo Y,et al.Phys.Rev.B,1999,59(12):R7793-R7796
[3]Shishidou T,Freeman A J,Asahi R.Phys.Rev.B,2001,64:R180401-4
[4]Qian X F,Xie Y,Qian Y T,et al.J.Alloys Compd.,1998,278:110-112
[5]Qian X F,Li Y D,Xie Y,et al.Mater.Chem.Phys.,2000,66:97-99
[6]Hing B,Jiang X Q,Yang C Z,et al.Mater.Lett.,2003,57:2606-2611
[7]ZHANG Ling(张玲),ZHENG Yu-Feng(郑毓峰),SUN Yan-Fei(孙言飞),et al.J.Xinjiang Univ.(Xinjiang Daxue Xuebao),2006,1:47-52
[8]WANG Min(王敏),MIN Yu-Ling(闵宇霖),ZHANG Yuan-Guang(张元广),et al.Chem.World(Huaxue Shijie),2009,10:577-589
[9]Hu Q R,Wang S L,Zhang Y,et al.J.Alloys Compd.,2010,491:707-711
[10]Chen X H,Fan R.Chem.Mater.,2001,13:802-805
[11]Chakraborty I,Malik P,Moulik S.J.Nanopart.Res.,2006,8:889-897
[12]Dong J Q,Li D C,Peng Z H,et al.J.Solid State Electrochem.,2008,12:171-174
[13]DUAN He(段鹤),ZHENG Yu-Feng(郑毓锋),ZHANG Xiao-Gang(张校刚),et al.Mater.Mechan.Eng.(Jixie Gongcheng Cailiao),2004,28(5):49-51
[14]CHEN Yan-Hua(陈艳华),ZHENG Yu-Feng(郑毓锋),ZHANG Xiao-Gang(张校刚),et al.Sci.China G(Zhongguo Kexue G),2005,35(1):20-30
[15]WU Rong(吴荣),ZHENG Yu-Feng(郑毓锋),ZHANG Xiao-Gang(张校刚),et al.Acta Phys.Sin.(Wuli Xuebao),2004,53(10):3493-3497
[16]Kondo S(近藤精一),Ishikawa T(石川达雄),Abe I(安部郁夫),Translated by LI Guo-Xi(李国希).Science of Absorp
tion(吸附科学).Beijing:Chemical Industry Press,2005:25-26
[17]Liu X,Cui J,Zhang L,et al.Mater.Lett.,2006,60:2465-2469
[18]Wang J,Song B,Wang W J,et al.Powder Diffr.,2009,24(1):24-28
[19]Liu X D,Ma J M,Peng P,et al.Mater.Sci.Eng.B,2008,150:89-94
[20]ZHANG Hui(章慧).Coordination Chemistry:Principles and Applications(配位化学原理与应用).Beijing:Chemical Industry Press,2008:2-4
[21]Zhang L,He R,Gu H C.Mater.Res.Bull.,2006,41:260-267
[22]Wang Z L.J.Phys.Chem.B,2000,104(6):1153-1175
Effects of pH Value on Hydrothermal Synthesis of Pyrite CoS2Micro-Crystals
XIE Ling-Ling WU Rong LI Jin SUN Yan-FeiJIAN Ji-Kang*
(Department of Physics,Xinjiang University,Urumqi 830046,China)
Pyrite CoS2micro-crytals were synthesized under hydrothermal conditions employing sodium thiosulfate pentahydrate (Na2S2O3·5H2O)as sulfur source and ethylenediaminetetraacetic acid disodium (EDTA-2Na)as assistant.The effects of pH value of solution on the structures and morphologies of the products were investigated.X-ray diffraction(XRD)and scanning electron microscopy(SEM)were used to characterize the structural features and the morphology of the samples.The results show that the morphologies of the products could be tuned by the pH values of solutions.The pure-phase pyrite CoS2micro-crystals with regular hollow sphere-like morphology can be obtained in acid environment (pH=1,3),while well-faceted octahedron-shaped CoS2micro-crystals were synthesized in neutral and alkaline environment(pH=7,11).The mechanisms for the formations of the CoS2micro-crystals were discussed.
CoS2;hydrothermal synthesis;pH value;morphology
O614.81+2;O782+1;TB34
A
1001-4861(2011)01-0095-05
2010-08-03。收修改稿日期:2010-09-08。
新疆大学博士科研启动基金(No.BS080109);新疆自治区教育厅高校教师科研项目(No.XJEDU2008I05)资助。
*通讯联系人。E-mail:jianjikang@sina.com;会员登记号:S410800120M。
