脑缺血-再灌注相关细胞因子表达的TNF-α损伤机制及清开灵的作用
2011-09-13庞春红李澎涛朱晓磊
庞春红 李澎涛 朱晓磊
(1中日友好医院病理科,北京市朝阳区樱花东路2号,100029;2北京中医药大学;3世界中医药学会联合会)
通过对缺血-再灌注损伤血清TNF-α、血清P-selectin、血清sICAM-1含量的测定及对脑组织ICAM-1的免疫组化定位分析,探讨在脑缺血-再灌注所致炎症级联反应损伤过程中TNF-α对其他细胞因子所发挥的调节作用,以及清开灵的作用特征。
1 材料与方法
1.1 实验动物与分组 健康雄性Wistar大鼠,体重(200±20)g(维通利华公司实验动物中心提供)。动物随机分为9组,每组12只,9组为正常对照组、缺血再灌注24h模型组(模型24h组)、缺血再灌注72h模型组(模型72h组)、缺血再灌注24h TNF-α抗体组(抗体24h组)、缺血再灌注72h TNF-α抗体组(抗体72h组)、缺血再灌注24h清开灵给药组(清开灵24h组)、缺血再灌注72h清开灵给药组(清开灵72h组)、缺血再灌注24h TNF-α抗体与清开灵共用组(抗体加清开灵24h组)、缺血再灌注72h TNF-α抗体与清开灵共用组(抗体加清开灵72h组)。
1.2 动物模型制备 按照许沛虎[1]的方法,加以改良,经腹腔注射10%水合氯醛(按0.35mL/100g体重)麻醉,颈前术区脱毛、消毒。颈部正中切口长约3cm,逐层分离,暴露并分离双侧颈总动脉。注意勿损伤迷走神经。在双侧颈总动脉下各置一段5cm长的丝线,用血管钳钳夹丝线两端使两动脉同时夹闭,30min后同时松开丝线,使血液重新灌流,术区局部使用青霉素粉少许,逐层缝合切口。应用TNF-α抗体的各组,在松开丝线恢复再灌流的同时经大鼠舌下静脉注射TNF-α单克隆抗体溶液(用生理盐水稀释,10μg/100g体重)[2-3]。清开灵给药组分别于造模前1h、造模后4h及以后每12h按照0.3mL/100g体重腹腔注射清开灵注射液。为减轻对腹腔的刺激,用2倍体积的生理盐水进行稀释,因此,实际给药体积为0.9mL/100g体重。
1.3 取材处理 造模后分别于24h和72h两个时间点取材。腹腔注射10%水合氯醛(按0.35mL/100g体重)麻醉后经腹主动脉取全血6mL。其中4mL室温静置1h后,1500r/min离心10min,分离血清,-80℃保存待测。其余2mL加适量肝素抗凝后3000r/min离心10min,分离血浆,-80℃保存待测。
1.4 主要试剂 水合氯醛(北京化学试剂公司,批号:20030518);TNF-α单克隆抗体(R&D Sestems,Inc.Lot Number:AYX063061);清开灵注射液(北京中医药大学药厂,批号:411506A);大鼠ICAM-1 ELISA试剂盒(博士德生物工程有限公司,BSD050320);大鼠P-Selectin ELISA试剂盒(博士德生物工程有限公司,BSD041205)。
1.5 检测指标及方法 血清TNF-α浓度:放射免疫方法(解放军301医院东亚放免技术研究所测定)。血清P-选择素:双抗夹心 ABC-酶联免疫方法(ELISA),按试剂盒说明操作。血清可溶性细胞间黏附分子(sICAM-1):双抗夹心ABC-酶联免疫方法,按试剂盒说明操作。脑组织细胞间黏附分子-1(ICAM -1):免疫组织化学法定位[4-5]。
1.6 统计学方法 脑组织ICAM-1采用Image Pro 5.1图像分析软件采集数据,每组4张切片,每张切片随机选择2个视野,计算阳性区域所占总面积,然后用SPSS11.0软件进行统计学分析,数据均以s表示。其余指标直接用SPSS11.0软件进行方差分析。
2 结果
2.1 血清TNF-α含量(表1)与正常对照组比较,模型24h组和72h组血清TNF-α含量均出现明显升高(P<0.01)。与模型组比较,抗体组在再灌不同时间点血清TNF-α含量出现相反的变化。抗体24h组比模型24h组明显升高(P<0.01),抗体72h组比模型72h组明显降低(P<0.01)。2组与正常对照组比较均有统计学意义(P<0.01)。清开灵对缺血-再灌注后升高的血清TNF-α含量有降低的趋势,但与模型组比较均无统计学意义(P>0.05)。抗体加清开灵治疗在再灌不同时间点血清TNF-α含量也出现相反的变化。抗体加清开灵24h组与模型24h组比较血清TNF-α含量继续升高(P<0.05),而抗体加清开灵72h组比模型72h组出现明显降低(P<0.01)。
表1 脑缺血-再灌注大鼠血清TNF-α含量的变化(s)
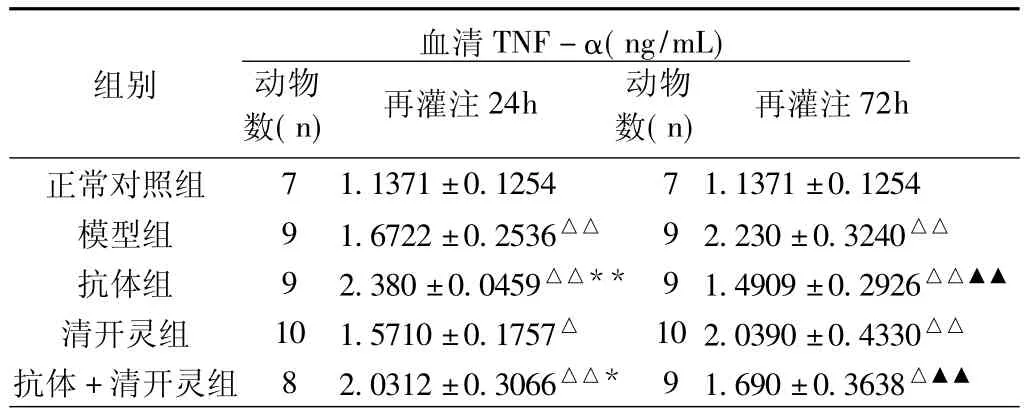
表1 脑缺血-再灌注大鼠血清TNF-α含量的变化(s)
注:与正常对照组比较,△P<0.05,△△P<0.01;与模型24h比较,*P<0.05,**P<0.01;与模型72h比较,▲▲P<0.01。
模型组 9 1.6722±0.2536△△ 9 2.230±0.3240△△抗体组 9 2.380±0.0459△△** 9 1.4909±0.2926△△▲▲清开灵组 10 1.5710±0.1757△ 10 2.0390±0.4330△△抗体+清开灵组 8 2.0312±0.3066△△* 9 1.690±0.3638 72h正常对照组组别数(n)再灌注24h 动物数(n)再灌注血清TNF-α(ng/mL)动物△▲▲
2.2 血清P-selectin含量(表2)与正常对照组比较,模型24h组和72h组血清P-selectin含量均有明显升高(P<0.01)。应用抗体、清开灵、以及抗体加清开灵治疗均可显著降低相应时间点的缺血-再灌注后升高的血清P-selectin含量(P<0.01),但都未回复到正常水平,与正常对照组比较均有统计学意义(P<0.01)。各72h组血清P-selectin含量均明显低于相应的24h组(P<0.01)。
表2 脑缺血-再灌注大鼠血清P-selectin含量的变化(s)
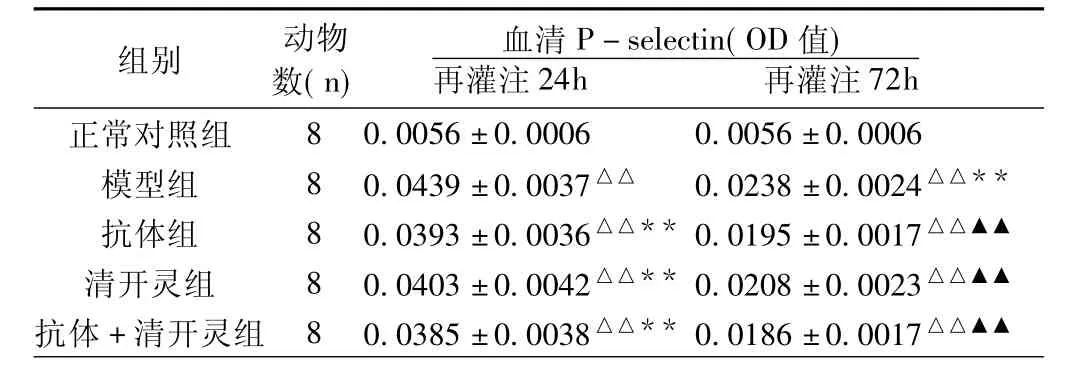
表2 脑缺血-再灌注大鼠血清P-selectin含量的变化(s)
注:与正常对照组比较,△△P<0.01;与模型24h比较,**P<0.01;与模型72h比较,▲▲P<0.01。
正常对照组△△▲▲
2.3 血清sICAM-1含量(表3)与正常对照组比较,模型24h组和72h组血清sICAM-1含量均出现明显升高(P<0.01)。应用抗体、清开灵、以及抗体加清开灵治疗均可显著降低相应时间点的缺血-再灌注后升高的血清sICAM-1含量(P<0.01),但都未回复到正常水平,与正常对照组比较均有统计学意义(P<0.01)。
表3 脑缺血-再灌注大鼠血清sICAM-1含量的变化(s)
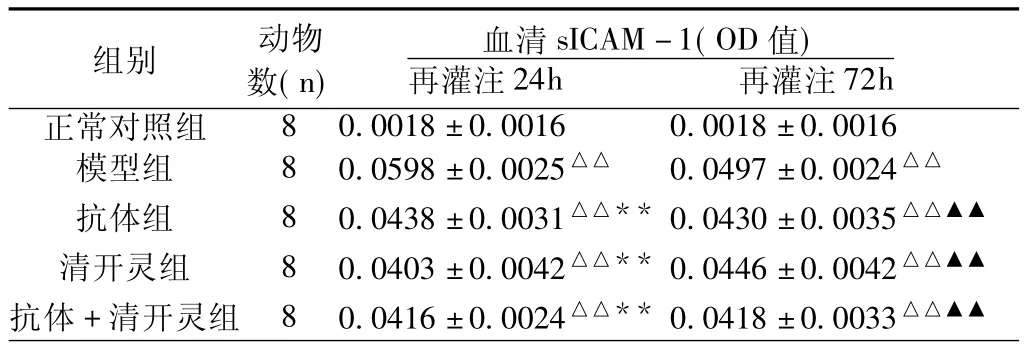
表3 脑缺血-再灌注大鼠血清sICAM-1含量的变化(s)
注:与正常对照组比较,△△P<0.01;与模型24h比较,**P<0.01;与模型72h比较,▲▲P<0.01。
模型组 8 0.0598±0.0025△△ 0.0497±0.0024△△抗体组 8 0.0438±0.0031△△** 0.0430±0.0035△△▲▲清开灵组 8 0.0403±0.0042△△** 0.0446±0.0042△△▲▲抗体+清开灵组 8 0.0416±0.0024△△** 0.0418±0.0033 72h正常对照组组别 动物数(n)血清sICAM-1(OD值)再灌注24h 再灌注△△▲▲
表4 脑缺血-再灌注大鼠脑组织ICAM-1含量的变化(s)

表4 脑缺血-再灌注大鼠脑组织ICAM-1含量的变化(s)
注:与正常对照组比较,△△P<0.01;与模型24h比较,**P<0.01,▲P <0.05,▲▲P<0.01。
72h正常对照组组别 视野数脑组织ICAM-1表达量(%)(阳性区域面积百分比)再灌注24h 再灌注△△▲▲
2.4 脑组织ICAM-1含量(表4)与正常对照组比较,模型24h组和72h组脑组织ICAM-1含量均出现明显升高(P<0.01)。应用抗体、清开灵、以及抗体加清开灵治疗均可不同程度降低相应时间点的缺血-再灌注后升高的脑组织ICAM-1含量,抗体72h组有统计学意义(P<0.05),其余各组均有统计学意义(P<0.01)。但以上各组脑组织ICAM-1含量都未回复到正常水平,与正常对照组比较均有统计学意义(P<0.01)。相比之下,抗体加清开灵组的疗效最佳,其次为抗体组。各72h组脑组织ICAM-1含量也不同程度低于相应的24h组。
3 讨论
脑缺血-再灌注是一个复杂的、多因素的通过多种途径产生损伤作用的病理过程。其中,多种细胞因子、黏附分子参与脑组织的损伤和修复[6-7]。全脑缺血-再灌注后,与再灌注有关的急性炎症反应在继发性脑损伤中的作用日益受到重视[8]。
3.1 TNF-α TNF是一种多效细胞因子,在脑缺血过程中,TNF-α的大量表达促使白细胞在毛细血管及小血管中的聚集和黏附,而白细胞对血管内皮的黏附是白细胞向坏死组织浸润的初步阶段。Lin等[9]的实验表明TNF-α在脑缺血后引起的白细胞浸润和组织损伤中起重要作用。TNF-α通过如下作用对缺血脑组织产生损伤[10-11]:1)与血管内皮细胞相互作用改变其通透性;2)通过各种途径增加白细胞与血管内皮细胞的黏附性,如TNF-α可通过上调ICAM-1(细胞间黏附分子-1)、CD11/CD18从而增强白细胞与内皮细胞的黏附作用;3)与内皮细胞相互作用损伤内皮启发动凝血过程。
本实验研究表明,脑缺血-再灌注损伤导致血清TNF-α含量明显升高。清开灵对其有降低的趋势。因我们所采用的TNF-α含量测定方法无法将血液中游离的TNF-α与结合了抗体的TNF-α相区别,结果显示的是二者的总和。所以,抗体组及抗体加清开灵组在再灌不同时间点血清TNF-α含量出现的相反变化可能由以下原因造成:1)早期在血清中大量TNF-α被抗体中和以后,可能通过反馈调节导致更多TNF-α的产生,从而检测结果有明显升高;2)后期,TNF-α抗原抗体复合物逐渐被清除,从而检测结果有明显降低;3)使用TNF-α抗体可减轻该模型的血脑屏障损伤,使其通透性降低,从而神经胶质细胞和神经元分泌的炎性介质TNF-α漏出至外周血的数量减少。而这并非即时效应,而是随着时间延长而作用增强。
3.2 P-selectin P-selectin存在于血管内皮细胞(CEC)的Weibel-Palade小体和血小板(PLT)的α-颗粒,是二者活化及血管内皮细胞炎症反应的标志,静止的内皮细胞和血小板不表达[12]。P-selectin主要通过激活中性粒细胞(PMN)在炎症早期表达,通过钙离子的参与来调节白细胞与内皮细胞、血小板细胞黏附过程,介导PMN在活化内皮细胞上的滚动,在炎症晚期则同其他选择素协同发挥作用。脑缺血-再灌注时,P-selectin可在几分钟内转位于细胞表面,与中性白细胞表面的唾液酸化Lewisx作用,介导早期多形核白细胞在内皮细胞上的低亲和滚动。
本实验结果表明,脑缺血-再灌注损伤时,P-selectin在炎症早期表达,随时间延长表达减弱。应用抗体、清开灵、以及抗体加清开灵治疗均可使相应时间点的缺血-再灌注后升高的血清P-selectin含量显著得以回复,但都未回复到正常水平。相比之下,抗体加清开灵组的疗效最佳,其次为抗体组。由此我们怀疑是否应用抗体对脑缺血-再灌注大鼠血清P-selectin有着较大的影响作用。应用抗体各组的血清P-selectin无论24h还是72h均不同程度低于对应的未应用抗体的各组。因此,促进P-selectin表达可能是TNF-α在炎症过程中发挥作用的途径之一。
3.3 ICAM -1 近年来的研究结果表明[13-14],在缺血性脑损伤的病理过程中存在着炎症反应。在缺血区脑组织,大量中性粒细胞和单核细胞聚集和浸润,导致血脑屏障的破坏,引起脑组织水肿及神经细胞的变性坏死。ICAM-1是表达于血脑屏障内皮细胞的一种跨膜糖蛋白,它介导炎性细胞参与血脑屏障内皮细胞损害的病理过程。但血脑屏障通透性改变与ICAM-1表达之间的关系尚未引起人们的重视。正常情况下,ICAM-1在脑组织微血管内皮细胞仅有少量表达,在脑组织受损(如缺血、创伤及炎症)时,在内毒素及一些细胞因子如IL-1、TNF-α,γ-干扰素等的刺激下,其在血管内皮的表达明显升高[15]。
本实验从血清含量和脑组织表达量两个方面对ICAM-1进行了探讨,结果如下:1)缺血-再灌注损伤后,血清sICAM-1含量明显升高。应用抗体、清开灵、以及抗体加清开灵治疗均可显著降低相应时间点的缺血-再灌注后升高的血清sICAM-1含量,但都未回复到正常水平。从以上实验结果可以看出,应用抗体和清开灵均可通过降低脑组织微血管内皮细胞ICAM-1的表达而抑制黏附分子所介导的炎性损伤作用。是否应用抗体对脑缺血-再灌注大鼠血清sICAM-1含量有着一定的影响作用。由此验证了TNF-α与ICAM-1具有一定的相关性。ICAM-1可能是在TNF-α的刺激下,在血管内皮的表达出现升高。2)缺血-再灌注损伤后,脑组织ICAM-1含量明显升高。应用抗体、清开灵、以及抗体加清开灵治疗均可不同程度降低相应时间点的缺血-再灌注后升高的脑组织ICAM-1含量,除抗体72h组作用较显著外,其余各组作用显著。但以上各组脑组织ICAM-1含量都未回复到正常水平。相比之下,抗体加清开灵组的疗效最佳,其次为抗体组。各72h组脑组织ICAM-1含量明显低于相应的24h组。是否应用抗体对脑缺血-再灌注大鼠脑组织ICAM-1含量有着一定的影响作用。
应用清开灵以及TNF-α单克隆抗体均能通过抑制TNF-α而影响ICAM-1和P-selectin的表达,从而阻抑它们进一步所介导的炎细胞黏附及内皮损伤,减轻脑组织的炎性损伤。本实验结果为清开灵的解毒通络病机提供了实验依据。
[1]许沛虎,涂晋文.愈风汤对大鼠脑缺血/再灌流后脑含水量及脑组织钾钠钙含量的影响.中国实验方剂学杂志,1997,3(2):18-20.
[2]刘清和,曾庆杏,余绍祖.抗肿瘤坏死因子-α单克隆抗体对缺血-再灌注大鼠脑损伤影响的实验研究.中风与神经疾病杂志,1999,16(4):208-210.
[3]李旦,孙桂莲,史金阳.肿瘤坏死因子-α多克隆抗体对新生大鼠缺氧缺血性脑损伤的保护作用研究.临床神经病学杂志,1999,12(1):15-17.
[4]张贵斌,余绍祖,黄本友.黏附分子在脑缺血再灌注损伤中的作用.卒中与神经疾病,2001,8(4):256 -258.
[5]田玉科,吴震.6%经乙基淀粉血液稀释对大鼠全脑缺血/再灌注后ICAM-1表达的影响.中华麻醉学杂志,2002,22(1):734-736.
[6]Williams AJ Bertir,Dave JR,et al.Delayed treatment of ischemia/reperfusion brain injury,Stroke,2004,35(5):1186 -1191.
[7]atriotomo I,Bowen KK,Vemuganti R.JAK 2 and STAT 3 activation contributes to neuronal damage following transient focal cerebral ischemia.J Neurochem,2006,98(5):1353 -1368.
[8]高剑峰,李建生,周友龙.脑脉通对老龄大鼠脑缺血再灌注炎症级联反应的影响.中华中医药杂志,2008,23(7):583-586.
[9]Lin HY,Huang CC,Chang KF,Lipopolysaccharide proconditioning reduces neuroinflammation against hypoxic ischemia and prorideslong--term outcome of neuroprotection in neonatal rat.Pediatr Res,2009,66(3):254-259.
[10]张娜,朱晓磊,李澎涛.胆酸、栀子苷及配伍对大鼠缺血再灌注脑组织TNF-α、IL-1β和ICAM-1含量的影响.中国医药学报,2003,13(8):463-465.
[11]雷军荣,秦军,张晶.姜黄素对大鼠缺血性脑损伤炎症反应和血脑屏障通透性的影响.中国药理学通报,2010,26(1):120-12.
[12]高帆,聂亚雄.P-选择素与缺血性脑卒中.神经疾病与精神卫生,2009,9(2):174 -177.
[13]Stammirovic D,Satoh K.Inflammatory mediators of cerebral endothelium:a role in ischemic brain inflammation.Brain Pathol,2000,10(1):113-126.
[14]丁丽君,董志.脑缺血-再灌注损伤中炎性反应的研究进展.中国脑血管病杂志,2009,6(11):611 -616.
[15]Kanemoto Y,Nakase H.Akita N,et al.Effects of anti- intercellular adhesion molecule-1 antibody on reperfusion injury induced by late reperfusion in the rat middle cerebral artery occlusion model.Neurosurgery,2002,51(4):1034 -1042.
