无动物成分器官培养法保存角膜内皮细胞活性的实验研究
2011-09-11魏捷,蒋华
魏 捷,蒋 华
器官培养保存法是目前国际上主要的角膜供体长期保存法,能保持角膜内皮细胞(corneal endothelial cells,CEC)活性长达 4周,不仅利于合理配置角膜资源,而且角膜抗原性也会随保存时间延长而逐渐减弱。研究认为,保存至3周时角膜片内的树突状细胞可完全消失[1],可以降低免疫排斥反应发生率。胎牛血清(fetal bovine serum,FBS)因为营养成分丰富在器官培养保存法中应用广泛,但其批间变异大,成分不够清晰稳定,还有病原体污染风险。出于对人体安全性的长远考虑,有必要考虑自培养基中去除血清成分[2]。本实验拟对新型培养基-无动物成分培养基 (animal compound free medium,ACF)在无血清器官培养保存CEC活性方面的效果进行初步探索。
1 材料和方法
1.1 材料与动物分组 16只SPF级成年Wistar大鼠,体重200~250 g,雌雄不限,山东大学动物实验中心提供,过量麻醉处死,取双侧眼球。ACF购自美国Sciencell公司,MEM购自美国Gibco公司,葡聚糖T-500购自美国Pharmacia公司,兔多克隆抗ZO-1抗体购自Santa Cruz公司,SP-9000免疫组化染色试剂盒来自北京中杉金桥生物技术有限公司,RNA裂解液、总RNA提取试剂盒购自上海华美生物工程公司,TaKaRa试剂盒及DNA Marker由大连宝生物公司提供,引物由北京奥科生物技术有限责任公司合成。将角膜片随机分为2组,每组16只。对照组:角膜保存于MEM+2%FBS培养液中。试验组:即ACF组,角膜保存于无血清的ACF培养液中。
1.2 角膜器官培养保存方法 在超净台上按眼库标准无菌化程序处理。生理盐水冲洗眼球,再依序浸泡于0.5%碘伏溶液和含500 U/ml庆大霉素的乳酸林格液中,时间分别为2、20 min。剪下完整角膜片,角巩膜缘缝合1针后悬吊于20 ml培养液中,密封保存瓶口,置于31℃恒温箱中不换液保存4周。保存结束后,将角膜移至10 ml脱水液(各组培养液中加5%葡聚糖T500)中,31℃恒温脱水48 h。
1.3 保存前后ECD计数 保存前大鼠角膜置于培养皿中,0.9%生理盐水浸泡4 min,使细胞间隙暂时扩大,倒置显微镜下计数角膜内皮细胞密度(endothelial cells density,ECD)。 保存结束脱水后,大鼠角膜内皮面滴0.25%台盼蓝染色1 min,生理盐水缓慢漂洗,再滴1%茜素红染色2 min,生理盐水漂洗,普通光学显微镜下计数角膜ECD。
1.4 免疫组织化学染色法检测内皮层中ZO-1的表达 保存结束取出大鼠角膜,立即OCT包埋,液氮内速冻15 min,转入深低温冰箱保存备用。检测时连续冰冻切片,厚度4 μm,常规贴片、固定,晾干,密封,4℃短期保存。染色当天取出玻片,按说明书行SP三步法免疫组织化学染色,风干,封片,观察照相。兔多克隆抗ZO-1抗体按1∶200浓度稀释。
1.5 RT-PCR检测去上皮角膜中ZO-1mRNA表达每组取6只保存后大鼠角膜,去除上皮层,按照TRIzol试剂盒说明书进行总RNA的提取,逆转录试剂盒逆转录合成cDNA。ZO-1(249bP)的上游引物:5’-GCCTCTGCAGTTAAGCAT-3’,下游引物:5’-AAGAGCTGGCTGTTTTAA-3’。 β-actin(281bP)的上游引物:5'-TGACGAGGCCCAGAGCAAGA-3',下游引物:5'-ATGGGCACAGTGTGGGTGAC-3'。 PCR扩增条件:94℃预变性5 min,反应35个循环,其中94℃变性 45 s,55℃退火 45 s,72℃延伸 1 min,循环结束后72℃延伸10 min。用1.5%琼脂糖凝胶电泳100 min,凝胶紫外成像系统中扫描拍照并分析,
以目的基因的扩增带灰度与同管扩增的β-actin扩增带灰度之比来表示目的基因的mRNA表达水平。1.6 统计学分析 采用SPSS 15.0统计分析软件进行统计学处理,数据先求出组内x±s,显著性分析用t检验。

表1 保存前后各组大鼠角膜内皮细胞密度(个/mm2,x±s)
2 结果
2.1 培养保存过程中角膜的大体图像 自培养后第2天,两组角膜出现渐进性加重的基质水肿,上皮灰白色混浊,中央出现片状剥离。此后,角膜水肿逐渐加重,基质明显增厚,内皮面出现皱褶并逐渐增多。多数角膜在保存7~10 d时厚度达峰值。在葡聚糖T500中脱水48 h后,角膜变薄并基本恢复透明。
2.2 保存前后CEC计数 保存前两组间角膜ECD无统计学差异(P>0.05)。保存结束并脱水2 d后,对照组ECD大幅下降,而ACF组的ECD则高于2000个/mm2,组间比较有统计学差异(P<0.01)。计算 28 d保存期内日均CEC丢失率 [(保存前ECD-保存后ECD)/保存前ECD×100%÷28]衡量CEC损失程度,发现ACF组明显低于对照组,两组间比较有统计学差异(P<0.01)。脱水结束后,活性染色显示ACF组中CEC死亡比例明显低于对照组,组间比较差异非常显著(P<0.01)。 见表 1。
2.3 免疫组织化学染色结果 冰冻切片显示ZO-1在大鼠角膜内皮面有明确表达,呈棕黄色颗粒,广泛分布于胞浆内(图1)。ACF组切片上CEC与后弹力层贴附较紧密,ZO-1即随内皮细胞呈连续线形表达,表达强度高;对照组CEC间连接相对松散,有部分细胞脱落或不表达,ZO-1表达强度相对降低。
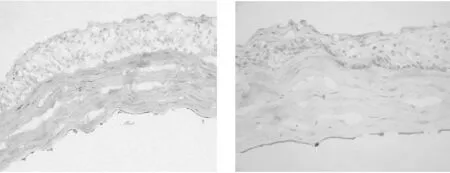
①对照(MEM+20 ml/L FBS)组 ②ACF 组图 1 保存后大鼠角膜内皮层中ZO-1的表达(SABC ×400)
2.4 RT-PCR半定量检测去上皮大鼠角膜中ZO-1mRNA的表达 结果显示两组大鼠角膜都有ZO-1mRNA表达,大小249 bp,与目的基因长度一致(图 2)。ACF组 ZO-1mRNA表达水平 (0.921 8±0.027 0)明显高于对照组(0.452 7±0.012 7),组间比较有非常显著性差异(t=38.448,P=0.000)。
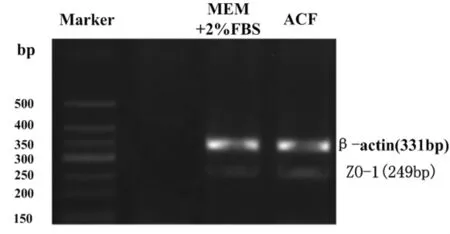
图 2 RT-PCR检测去上皮大鼠角膜中ZO-1mRNA表达的电泳图
3 讨论
要实现角膜植片无血清器官培养方式,前提是寻找到营养成分更为丰富的替代培养基。近年来,一些特殊设计无血清培养基相继问世,而被称作“chemical defined”(CD,限定化学成分的)的无动物来源培养基的出现,标志着细胞培养基发展的更高境界,彻底消除了培养基生物安全方面的担忧。目前国外学者在该领域的研究结论多倾向于选择endothelial SFM[3,4],一种原设计支持人脐静脉和脐动脉内皮细胞分离、生长的特殊培养基。它对CEC的保存效果确切,但价格昂贵,不是推广应用的最佳选择。因此,本实验选择研究成本相对较低的ACF。
Slettedal等[4]研究证实,即使在人角膜,在器官保存损伤过程中,CEC也会启动修复程序,具体修复机制不仅有扩大移行,还包括增殖分裂过程。而ACF中富含多种对于启动和促进CEC的增殖修复都非常关键的生长因子和种类丰富的其他营养成分,可以更好地发挥内皮保护作用[5]。本实验结果显示,保存结束后,MEM+2%FBS组的ECD值降至2000个/mm2以下,证明这种“基础”培养基的营养成分不足以充分满足不换液状态下CEC的长期生存需要。相比之下,无血清的ACF组不仅最终ECD值要高出许多,达到(2 143±169)个/mm2,还同时拥有较低的细胞日均损失率和死亡细胞比例。在眼库工作中,角膜ECD值是评价保存后植片质量的最重要指标,多要求在2 000~2 200个/mm2以上,ACF组的保存结果完全满足该项要求,进一步证明无血清ACF可以较传统MEM培养基更好地保存CEC活性,满足移植手术的需要。
细胞间紧密连接在维持内皮细胞屏障功能上发挥着重要作用[6]。ZO-1是一种磷酸蛋白,蛋白家族膜相关鸟苷酸激酶的家族成员,分子量220 000,属结构性跨膜蛋白,是构成上皮和内皮细胞间紧密连接的重要成分之一,到目前为止还没有发现缺乏ZO-1的紧密连接。若是ZO-1表达水平下降或缺失,多数情况下存在紧密连接的组织结构如血脑屏障、视网膜色素上皮细胞间、角膜内皮细胞间等会随之松散甚至分解,所以ZO-1常被用作紧密连接的屏障功能和通透性功能的衡量指标[7,8]。现有ZO-1抗体只可用于人或鼠,因此,笔者选用大鼠角膜来做检测。病理切片发现ZO-1的确存在于保存后大鼠CEC层。不过大鼠角膜小且后弹力层菲薄撕除难度大,而ZO-1在基质中又少有表达,所以半定量RT-PCR法改为检测去上皮后大鼠角膜中ZO-1的表达,结果与CEC的计数资料趋势保持一致,ZO-1在ACF保存组的表达水平明显高于MEM组,检测ZO-1的表达可在一定程度上辅助反映CEC的功能状态和细胞间紧密连接的完整性,也从另一个侧面证实了ACF能有效保持CEC活性的良好效果。
综上所述,自器官培养基中除去血清成分是组织细胞培养发展过程中的新要求和必然趋势。ACF营养丰富,能有效降低密闭保存过程中CEC的损失程度,成分明确,便于进行对比研究,还可以排除病原体传染风险,对CEC的保护作用明显超越传统的MEM,在无血清器官培养保存CEC活性方面极有发展潜力。
[1]刘 涛,潘志强,王 立,等.兔角膜器官培养保存与应用的研究[J].中华眼科杂志,2006,42(9):808-813.
[2]Hempel B,Bednarz J,Engelmann K.Use of a serum-free medium for long-term storage of human corneas.Influence on endothelial cell density and corneal metabolism[J].Graefes Arch Clin Exp Ophthalmol,2001,239(10):801-805.
[3]Bednarz J,Doubilei V,Wollnik PC,et al.Effect of three different media on serum free culture of donor corneas and isolated human corneal endothelial cells[J].Br J Ophthalmol,2001,85(12):1416-1420.
[4]Slettedal JK,Lyberg T,Rger M,et al.Regeneration with proliferation of the endothelium of cultured human donor corneas with extended postmortem time[J].Cornea,2008,27(2):212-219.
[5]邵应峰,胡诞宁,陈家祺.bFGF、EGF和NGF对人角膜内皮细胞生长调控的实验研究[J].眼科学报,2008,24(1):9-12.
[6]Proulx S,Bensaoula T,Nada O,et al.Transplantation of a tissueengineered corneal endothelium reconstructed on a devitalized carrier in the feline model[J].Invest Ophthalmol Vis Sci,2009,50(6):2686-2694.
[7]张文一,白海青,士峥华.视网膜色素上皮细胞中诱导型一氧化氮合酶、精氨酸代谢相关酶的表达及一氧化氮对细胞紧密连接的影响[J].中华眼底病杂志,2005,21(1):32-36.
[8]Hitani K,Yokoo S,Honda N,et al.Transplantation of a sheet of human corneal endothelial cell in a rabbit model[J].Mol Vis,2008,14(3):1-9.
