水蛭提取物对肝癌HepG2细胞DNA去甲基化作用研究
2011-09-06田雪飞伍参荣廖兴华
田雪飞 ,孙 婧 ,方 圆 ,伍参荣 ,周 青 ,廖兴华
(1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.湖南中医药大学基础医学院,湖南 长沙 410208;3.湖南中医药大学第一附属医院,湖南 长沙 410007)
DNA甲基化是复制后的修饰,在细胞增殖、分化过程中起重要作用。肝癌相关抑癌基因,例如P16基因等启动子区域的CpG岛甲基化,在肝癌的发生发展过程中起着重要的作用[1]。已有部分研究证实中药成分槲皮素[2]、CDP成分[3]及复方左金丸[4]等具有降低抑癌基因甲基化水平的作用,提示探索中药DNA去甲基化作用对中医药抗肿瘤研究具有重要的意义。前期研究中我们发现水蛭提取物具有体外抑制肝癌HepG2细胞增殖及诱导凋亡的作用[5],为此本实验通过观察水蛭提取物对肝癌细胞甲基转移酶(DNMTs)表达的影响,研究中药有效成分的DNA去甲基化作用,进一步探讨水蛭提取物的抗肝癌作用机制。现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 药物 水蛭购于湖南中医药大学第一附属医院,并由湖南省中医药研究院超微工程中心制备成水蛭超微粉。提取物参照研究组前期建立的液氮快速冻融法制备[5]:取水蛭超微粉1.5 g置15 mL离心管内,加10 mL灭菌双蒸水制成混悬液,再将离心管置液氮内5 min取出,立即放入37℃水浴中迅速融解,重复3次,3 000 r/min离心10 min,取上清液0.22μm微孔滤膜滤过,冷冻干燥18 h即得水蛭提取物冻干粉,-20℃保存备用。
1.1.2 试剂 Trizol RNA提取试剂为美国Gibco公司产品,RT-PCR相关试剂及引物为大连宝生物工程有限公司产品或合成;胎牛血清、低糖DMEM培养基干粉为Gibco公司产品;5-脱氧杂氮胞苷 (5-Aza-cdR)为Sigma公司产品。兔抗人DNMT1、DNMT3a、DNMT3b多克隆抗体购自美国Abcam公司;二抗为生物素标记的羊抗兔IgG,DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.1.3 细胞株 人肝癌细胞株HepG2购自中南大学湘雅细胞中心并保存。
1.1.4 仪器 倒置荧光显微镜 (日本OLYMPUS公司);自动酶标仪(奥地利TECAN公司);CO2培养箱(美国Hitachi公司),基因扩增仪(中国杭州大和热磁力电子公司);凝胶电泳仪(中国杭州博日科技公司);凝胶图像分析系统(中国上海天能科技公司)。
1.2 方法
1.2.1 细胞培养 HepG2培养于含10%小牛血清,100 U/mL链霉素和青霉素的DMEM培养液中,37℃,饱和湿度和5%CO2条件下培养,2~4 d更换培养基1次,常规传代培养,取对数生长期细胞进行实验。
1.2.2 药物干预浓度及分组 HepG2细胞接种24 h后分别用水蛭提取物、5-Aza-cdR处理。水蛭提取物临用前用含10%小牛血清的DMEM细胞培养液溶解稀释成工作浓度。根据预实验结果确定工作浓度为 3.0、6.0、9.0、12.0、15.0 mg/mL;5-Aza-cdR临用前用含10%胎牛血清的DMEM细胞培养液稀释成工作浓度,根据文献[6]及预实验结果确定工作浓度为 0.3、0.6、0.9、1.2、1.5 μM;DNMTs 表达检测以MTT检测1/2 IC50含药量作为工作浓度;均采用未加药物处理的细胞作为对照组。
1.2.3 MTT法检测细胞增殖抑制率 取对数生长期HepG2细胞接种96孔板,每孔接种2×104个细胞,分别培养48 h后每孔加入5 g/L MTT 10μL,37℃条件下继续培养4 h,弃上清液,每孔加入100μL DMSO,酶标仪波长490 nm处检测吸光度A值,实验重复3次。按下列公式计算细胞抑制率:细胞生长抑制率(%)=(对照孔A值-试验孔A值)/对照孔A值×100%。根据不同药物浓度条件下细胞生长抑制率数值进行相关回归分析,并根据回归方程计算半数抑制浓度(IC50)。
1.2.4 RT-PCR 法 检 测 DNMT1、DNMT3a、DNMT3b mRNA表达 取对数生长期1×106个HepG2细胞接种于培养瓶,培养6 h待贴壁后,换含水蛭提取物、5-Aza-cdR(IC50含药量)的培养基处理,对照组以不含药物的培养基处理。继续培养48 h后收集细胞,总RNA提取按Trizol试剂盒说明进行,紫外分光光度计测定总RNA浓度与纯度,-70℃保存备用。逆转录取2μL总RNA,10mM Oligo dT 1μL,用DEPC水补至总体积12μL,70℃ 5 min,冰上骤冷后加入5×buffer 4μL,20 mU/L RNA酶抑制剂 1 μL,10 mM dNTP 2 μL, 200 mU/L MMLV 1 μL,37 ℃ 反应 60 min,94 ℃灭活 5 min。PCR序列根据 Genebank中人 DNMT1、DNMT3a、DNMT3b、GAPDH cDNA序列进行设计。PCR反应体系为总体积 25μL,其中 10×PCR buffer 2.5 μL,dNTP 0.2mM, 上下游引物各 0.5 mM,MgCL21 mM,Taq酶 0.25 μL,cDNA 模板 2 μL,余下用无菌ddH2O补足,引物序列及PCR反应条件见表1。取PCR产物5μL在1.5%琼脂糖凝胶上电泳 (含0.5 mg/L溴化乙锭),PCR条带应用Eagle EyeⅡ图像分析处理系统分析结果,基因的相对表达水平等于该基因RT-PCR产物电泳条带的灰度值/GAPDH RT-PCR产物电泳条带的灰度值。

表1 PCR引物序列、反应条件及扩增的目的片段大小
1.2.5 免疫组化法检测DNMT1、DNMT3a、DNMT3b蛋白表达 对培养贴壁细胞洗脱涂片于已消毒的载玻片上,37℃过夜;PBS液轻洗,用冷丙酮固定5 min,自然干燥,SABC法免疫组织化学染色(操作流程按说明书进行)。显微镜下观察DNMT1、DNMT3a、DNMT3b蛋白染色和在细胞中的分布情况。并对每组标本计数300个细胞,计算染色阳性比率。
1.3 统计学分析
所有数据均采用SPSS 11.0统计软件进行统计学分析,数值变量资料以“x±s”表示,采用单因素方差分析,组间均数比较采用q检验,以P<0.05为差异具有统计学意义。IC50采用直线相关回归分析,根据回归方程计算求出。
2 结果
2.1 水蛭提取物、5-Aza-cdR对肝癌HepG2细胞增殖抑制作用的影响
MTT实验结果显示,水蛭提取物、5-Aza-cdR以剂量依赖性方式抑制HepG2细胞增殖,增殖抑制率随水蛭提取物、5-Aza-cdR的浓度增高而增加。水蛭提取物、5-Aza-cdR各剂量组吸光度OD值与对照组比较差异均有显著统计学意义(P<0.01)。求出直线回归方程水蛭提取物为y(增殖抑制率)=7.587x(药物浓度)+7.488,计算可得作用HepG2细胞48 h时的水蛭提取物半数有效抑制浓度IC50=6.0 mg/mL,因此确定3 mg/mL为水蛭提取物进行下一步试验的工作浓度;直线回归方程5-Aza-cdR为 y(增殖抑制率)=55.357x(药物浓度)-3.029,计算可得作用HepG2细胞48 h时的5-Aza-cdR半数有效抑制浓度IC50=0.96μM,因此确定0.48μM为5-Aza-cdR进行下一步试验的工作浓度。见表2。
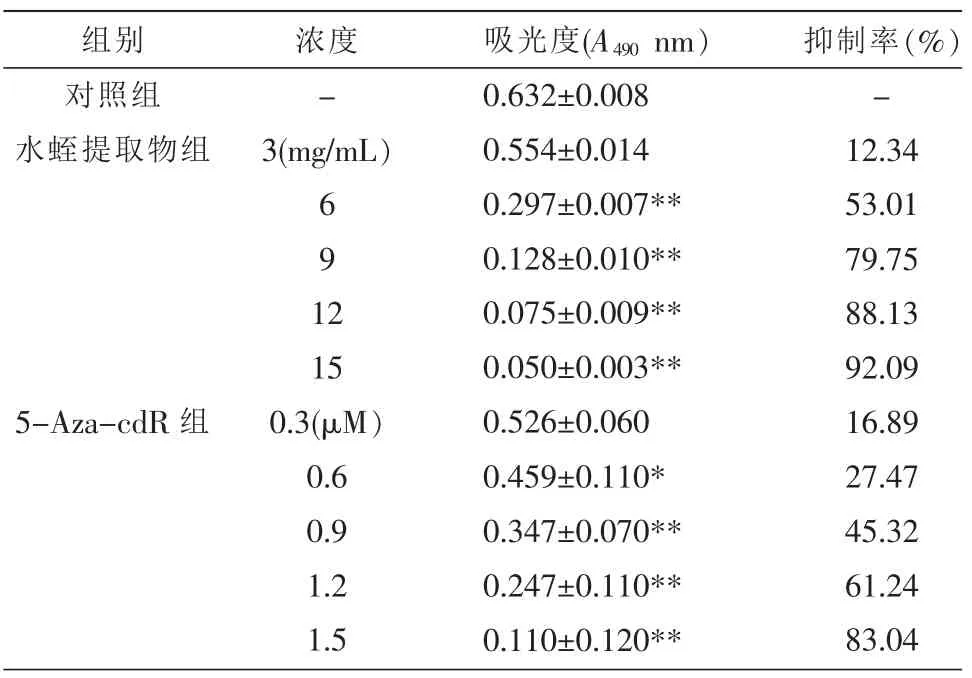
表2 水蛭提取物、5-Aza-cdR处理48 h后对肝癌HepG2细胞增殖抑制作用
2.2 水蛭提取物对肝癌HepG2细胞DNMT1、DNMT3a、DNMT3b mRNA表达的影响
水蛭提取物对肝癌HepG2细胞DNMT1、DNMT3a、DNMT3b mRNA表达有抑制作用,IC50药物浓度下处理 48 h 后,DNMT1、DNMT3a、DNMT3b mRNA表达降低,与对照组比较两者间比较差异有统计学意义(P<0.01);与阳性对照 5-Aza-cdR 组比较,对 DNMT1 mRNA 表达降低要弱于对照组(P<0.05),但水蛭提取物抑制DNMT3a、DNMT3b mRNA表达的作用要强于5-Aza-cdR,两者比较差异有统计学意义(P<0.05)。 见表 3,图 1~3。
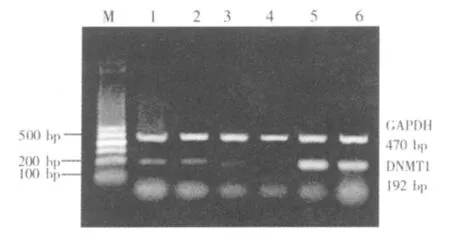
图1 RT-PCR扩增肝癌细胞HepG2 DNMT1 mRNA表达电泳图
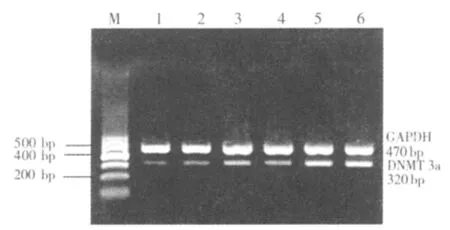
图2 RT-PCR扩增肝癌细胞HepG2 DNMT3a mRNA表达电泳图

图3 RT-PCR扩增肝癌细胞HepG2 DNMT3b mRNA表达电泳图
2.3 水蛭提取物对肝癌HepG2细胞DNMT1、DNMT3a、DNMT3b蛋白表达的影响
对照组 HepG2 细胞 DNMT1、DNMT3a、DNMT3b表达依次为DNMT1高度表达,而DNMT3a、DNMT3b分别中、低度表达。经水蛭提取物处理后,DNMT1、DNMT3a、DNMT3b 表 达 明 显 降低 , 尤 其DNMT3b表达降低最为明显,与对照组比较差异有显著统计学意义 (P<0.01),与阳性对照5-Aza-cdR组比较,DNMT1表达要高,但降低DNMT3a、DNMT3b效果明显优于5-Aza-cdR组,差异有统计学意义(P<0.05,P<0.01)。 数据见表 4。
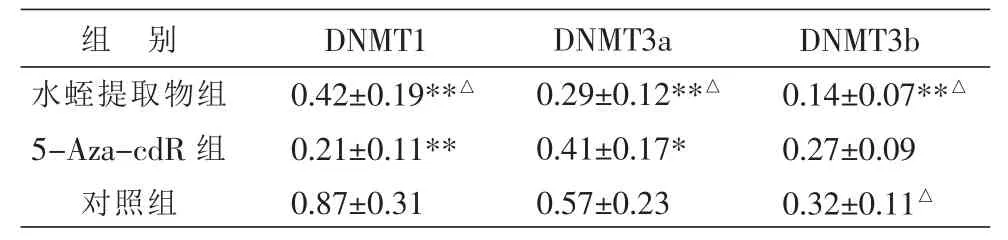
表3 水蛭提取物对肝癌HepG2细胞DNMT1、DNMT3a、DNMT3b mRNA表达水平的影响(灰度值,目的基因/GAPDH)
表4 水蛭提取物对肝癌HepG2细胞DNMT1、DNMT3a、DNMT3b蛋白表达水平的影响 (光密度值,)
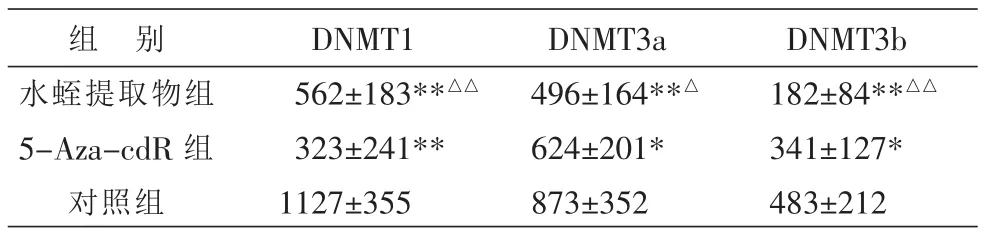
表4 水蛭提取物对肝癌HepG2细胞DNMT1、DNMT3a、DNMT3b蛋白表达水平的影响 (光密度值,)
组 别水蛭提取物组5-Aza-cdR组对照组DNMT1 562±183**△△323±241**1127±355 DNMT3a 496±164**△624±201*873±352 DNMT3b 182±84**△△341±127*483±212
3 讨论
虽然肝癌细胞发生甲基化异常的模式目前仍不清楚, 但 DNMTs, 包括 DNMT1,DNMT3a,DNMT3b已被证实在肝癌细胞内存在表达异常[6-7]。其中DNMT1在正常细胞S期复制过程中具有维持甲基化的功能,多数表现为散在的C被甲基化,而CpG岛未被甲基化[8]。DNMT1高表达是CpG岛甲基化紊乱的重要因素之一,DNMT1高表达总是伴有总基因组DNA低甲基化和癌基因低甲基化或抑癌基因高甲基化。通过siRNA靶向抑制DNMT1表达后肿瘤相关基因启动子如RASSF1A、p16等可发生去甲基化而重新表达[9-10]。
有报道及我们本课题组前期研究结果表明水蛭可通过直接杀伤、诱导分化及凋亡等机制发挥抗肿瘤作用[5,11],能否通过DNA去甲基化作用发挥抗肿瘤作用是值得研究的问题。本研究发现,水蛭提取物对肝癌HepG2细胞具有增殖抑制作用,且具有剂量依赖性。HepG2细胞中DNMT1基因表达明显增高,DNMT3a、DNMT3b基因呈中、低度表达。而经IC50浓度的水蛭提取物处理后 DNMT1、DNMT3a、DNMT3b基因表达显著降低,尤其可完全抑制DNMT3b基因的表达,其蛋白表达也呈弱阳性。虽然水蛭降低DNMT1表达作用远低于对照药物甲基化转移酶抑制剂5-Aza-cdR,但降低DNMT3a、DNMT3b的作用要优于5-Aza-cdR。结果表明DNA去甲基化作用可能是水蛭提取物抗肿瘤的机制之一,也提示从抗肿瘤中药中筛选DNA去甲基化中药有效成分具有可行性。
[1]Costa E,Dong E,Grayson DR,Guidotti A,et al.eviewing the role of DNA (cytosine-5)methyltransferase overexpression in the cortical GABAergic dysfunction associated with psychosis ulnerability[J].Epigenetics,2007,2(1):29-36.
[2]马 莉,王志平,贾雪琴,等.槲皮素对膀胱癌细胞生长抑制相关基因的去甲基化作用[J].中华实验外科杂志,2007,24(1):115.
[3]栾 菊,覃 扬,徐 丹,等.中药成分CDP抑制肿瘤细胞生长及其去甲基化作用的研究 [J].四川大学学报 (医学版),2005,36(6):834-838.
[4]文 彬,熊旻利,戴伟怡,等.左金丸及反左金丸对实验性大肠癌不同时期甲基转移酶表达的影响 [J].世界华人消化杂志,2009,17(20):2 074-2 078.
[5]郭永良,田雪飞,肖 竺.水蛭提取物对人肝癌HepG2细胞体外抑制作用研究[J].中国中医药信息杂志,2009,16(8):30-31.
[6]Clouaire T,Stancheva I.Methyl-CpG binding proteins:specialized transcriptional repressors or structural components of chromatin[J].Cell Mol Life Sci,2008,65(10):1 509-1 522.
[7]Herath NI,Leggett BA,MacDonald GA.Review of genetic and epigenetic alterations in hepatocarcinogenesis[J].J Gastroenterol Hepatol,2006,21(1 Pt 1):15-21.
[8]Oh BK,Kim H,Park HJ,et al.DNA methyltransferase expression and DNA methylation in human hepatocellular carcinoma and their clinicopathological correlation[J].Int J Mol Med,2007,20(1):65-73.
[9]Bakker J,Lin X,Nelson WG.Methyl-CpG binding domain protein 2 represses transcription from hypermethylated pi-class glutathione S-transferase gene promoters in hepatocellular carcinoma cells[J].J Biol Chem,2002,277(25):2 257-2 280.
[10]Sowińska A,Jagodzinski PP.RNA interference-mediated knockdown of DNMT1 and DNMT3B induces CXCL12 expression in MCF-7 breast cancer and AsPC1 pancreatic carcinoma cell lines[J].Cancer Lett,2007,255(1):153-159.
[11]钟志宏,陈文贵,柳永和,等.水蛭提取物抑制HepG2细胞生长及诱导其凋亡的实验研究[J].中南大学学报(医学版),2007,32(1):99-103.
