酒客乐对大鼠酒精性肝纤维化疗效及机制的研究*
2011-08-31甘爱萍李云桥陈宏慈
甘爱萍 李云桥 陈宏慈
1.湖北省中医院综合科 (湖北武汉,430061) 2.华中科技大学附属协和医院综合科
在我国随着生活条件的改善及酒精消耗量的增多,酒精性肝损伤的发病亦在逐渐增多[1]。酒精性肝损伤,即酒精性肝病 (Alcoholic liver disease,ALD)是由于长期的过度饮酒所致的肝脏疾病。在临床病理学上可将其分为酒精性脂肪肝、酒精性肝炎、肝纤维化和肝硬化几种基本类型[2],其中酒精性肝纤维化是发展到酒精性肝硬化的重要阶段,是一个可逆过程[3,4]。因此研究其防治具有重要意义。笔者利用酒精性肝纤维化的大鼠模型,通过观察中药复方酒客乐对其体重、肝功能、肝纤维化血清学指标 [Ⅲ型前胶原氨基末端肽 (PⅢP)、层粘蛋白 (LN)]、肝脏表达 TGF-β1(转化生长因子-β1)水平以及病理学的影响,探讨酒客乐对酒精性肝纤维化的防治作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 纯系Wistar清洁级雄性大白鼠,体重135~165g,由同济医科大学实验中心提供。
1.1.2 饲料 普通大鼠饲料,由湖北中医药大学实验中心提供。
1.1.3 药物 酒客乐,由葛花、枳椇子、木瓜等药 (购于湖北省中医院药房)组成,每剂首次加水350ml浸泡30分钟后以文火煎煮30分钟,滤出煎液,药渣加3倍量水继续煎煮20分钟,合并两次药液,于水浴上浓缩制成1g/ml、3g/ml两种提取液,过滤后4℃储存备用。
1.1.4 主要试剂 红星二锅头白酒,55°,北京酿酒总厂生产;吡唑,Sigma公司制造,批号:000218;橄榄油,购于湖北省医药公司;TGF-β1免疫组化染色试剂盒,批号:000712,DAB显色试剂盒,产品批号:001022,均购于武汉博士德生物工程有限公司;PⅢP、LN试剂盒购于北京邦定泰克生物技术有限公司;ALT(丙氨酸转氨酶)、AST(天门冬氨酸转氨酶)试剂盒,购于武汉亚法生物技术有限公司。
1.1.5 主要仪器设备 光镜、Ts-RE自动脱水机、BM-Ⅲ型组织包埋机、AO切片机、CS-B型摊片烤片机、电子天平、H-600日立电镜、离心机、HP.IAS-1000型全自动彩色图像分析系统、721型分光光度计。
1.2 方法
1.2.1 动物分组与处理 40只大鼠随机分为5组,每组8只。分别是:正常对照组 (简称正常组):正常饲料,自由饮水。造模组:灌胃白酒-橄榄油-吡唑混合液,酒的摄入量为8~12g·kg-1·d-1,随时间的延长而递增,橄榄油的摄入量为2g·kg-1·d-1;吡唑摄入量为24mg·kg-1·d-1。造模时间为12周。高剂量预防组:每天早晨 (7∶00-8∶00)灌胃白酒-橄榄油-吡唑混合液,2小时后灌胃1次3g/ml酒客乐煎剂,剂量为24g·kg-1·d-1。低剂量预防组:每天早晨 (7∶00-8∶00)灌胃白酒-橄榄油-吡唑混合液,2小时后灌胃1次1g/ml酒客乐煎剂,剂量为8g·kg-1·d-1。治疗组:灌服白酒-橄榄油-吡唑混合液12周造模成功后用3g/ml酒客乐灌胃治疗4周,剂量为24g·kg-1·d-1。
以上药物剂量根据人民卫生出版社出版,陈奇主编的《中药药理实验方法》,按体型系数换算法求得 (低剂量相当于成人普通剂量,高剂量为成人普通剂量的3倍)。
1.2.2 标本采集 ①血液 实验第12周结束后,将大白鼠(除治疗组外)用戊巴比妥钠 (50mg/ml)腹腔注射麻醉后摘眼法取血,分离血清后于-20℃冰箱内保存备用。治疗组大鼠于第16周结束后采集标本。②肝组织 采血后用脊椎脱臼法处死动物,打开腹腔,切取肝左叶组织 (大小约12mm×5mm×2mm),生理盐水冲洗后将其浸入10%甲醛液固定用于光镜观察;切取肝右叶组织 (大小约1mm×1mm×1mm),立即将其浸入2.5%戊二醛中固定用于电镜观察。
1.2.3 观察指标及方法 一般情况,观察大鼠饮水、摄食、活动状态、精神状态、营养,早晚各1次;体重变化,每周测量1次;血清ALT、AST含量,采用赖氏法测定,具体操作严格按试剂盒说明书进行;血清PⅢP、LN含量,采用放射免疫法,同位素室专人测定;病理切片,常规石蜡切片,HE染色,光镜观察,由湖北省中医院病理科协助完成;肝脏超微结构的改变,在透视电镜下观察;肝脏表达TGF-β1水平,采用SABC法:①载玻片防脱片剂处理,采用APES。捞片后置60℃烤箱30~60分钟,以使切片紧密黏附。②常规石蜡切片,切片脱蜡。③蒸馏水新鲜配置3%H2O2,室温10分钟以灭活内源性酶,蒸馏水洗2分钟×3次。④滴加复合消化液,室温10分钟,0.1M PBS洗2分钟×3次。⑤滴加山羊血清封闭液,室温10分钟,甩去多余液体,不洗。⑥滴加兔抗抗原,20℃,60分钟,0.1M PBS洗2分钟×3次。⑦滴加生物素化山羊抗兔 IgG,20℃ ~37℃,20分钟,0.1M PBS洗2分钟×3次。⑧滴加洗剂 SABC,20℃,20分钟,0.1M PBS洗5分钟 ×4次。⑨DAB显色,使用 DAB显色试剂盒(ED1012)。取1ml蒸馏水,加试剂盒中A、B、C试剂各1滴,混匀后加至切片,室温显色,镜下控制反应时间,蒸馏水洗涤。⑩苏木素轻度复染,脱水、透明、去脂、封片。
显微镜观察切片染成棕色的部位,即为阳性反应,每组随机取8张切片,每张切片随机取6幅图,染色结果采用计算机图像分析系统处理。
2 实验结果
2.1 一般情况 造模组大鼠皮毛欠光泽,活动量减少,饮食减少,精神状态差,身体消瘦,体重增长较其他几组缓慢,差异有显著性意义 (P<0.01)。酒客乐高剂量预防组大鼠体重与对照组之间差异无显著性意义 (P>0.05),酒客乐高、低剂量对大鼠体重影响的差异有显著性意义 (P<0.05),见表1。结果表明,酒客乐能显著改善大鼠体质,且随剂量增加而作用增强。
表1 各组大鼠体重变化比较 (±s,g)

表1 各组大鼠体重变化比较 (±s,g)
与造模组比较,△△P<0.01;与正常组比较,*P<0.05;与低剂量预防组比较,□P<0.05
组别 n 体重4周 8周 12周正常组 8 245±12△△ 309±9△△ 374±8△△造模组 8 194±11 218±10 252±11低剂量预防组 8 229±9△△* 291±7△△* 336±7△△*高剂量预防组 8 239±12△△ 304±8△△□ 366±7△△□
2.2 肝脏病理形态学变化 光镜观察:正常组大鼠肝组织结构完整,肝小叶轮廓清晰,肝细胞以中央静脉为中心向四周呈放射状排列,肝细胞分界清,核圆而清晰,位于细胞中央,胞质丰富。造模组大鼠肝组织中央静脉周围纤维化和肝细胞周围纤维化,肝小叶结构破坏,汇管区纤维组织增生,有弥漫性炎性细胞浸润、肝细胞坏死,可见酒精小体,预防组和治疗组大鼠肝脏中央静脉纤维化,炎症、坏死较造模组减轻,肝细胞周围纤维增生减少,见插页图1。
电镜观察:正常大鼠肝脏星状细胞位于Disse腔内,胞体小,细胞器不发达,排列整齐。造模组大鼠肝脏星状细胞数量明显增多,并逐渐向成纤维细胞过渡,表现为细胞桨内脂滴减少或消失,富含扩张的粗面内质网,网腔增大,有的细胞膜下可见致密的细丝束,细胞周围可见大量纤维束。预防组和治疗组大鼠细胞仅有轻度变性,如线粒体肿胀,内质网扩张及脱粒,细胞坏死少见,见插页图2。
2.3 酒客乐对大鼠血清ALT、AST含量的影响 见表2。
表2 各组大鼠肝功能比较 (±s,IU/L)
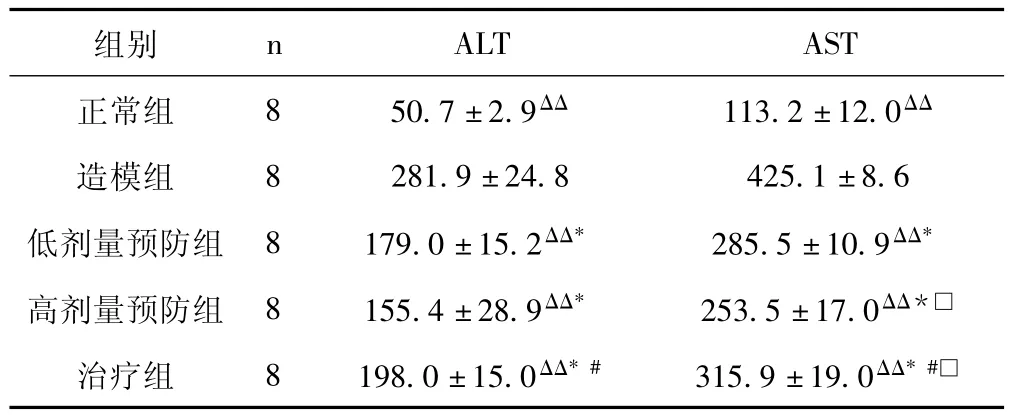
表2 各组大鼠肝功能比较 (±s,IU/L)
与造模组比较,△△P<0.01;与正常组比较,*P<0.05;与高剂量预防组比较,#P<0.05;与低剂量预防组比较,□P<0.05
组别n ALT AST正常组 8 50.7±2.9ΔΔ 113.2±12.0ΔΔ造模组 8 281.9 ±24.8 425.1 ±8.6低剂量预防组 8 179.0 ±15.2ΔΔ* 285.5 ±10.9ΔΔ*高剂量预防组 8 155.4 ±28.9ΔΔ* 253.5 ±17.0ΔΔ*□治疗组 8 198.0 ±15.0ΔΔ*# 315.9 ±19.0ΔΔ*#□
由表2可知,造模组大鼠ALT、AST值显著高于正常对照组 (P<0.01)。酒客乐高、低剂量预防组及治疗组大鼠ALT、AST值显著低于造模组 (P<0.01)。表明酒客乐能降低大鼠血清ALT、AST含量,改善肝功能。
2.4 酒客乐对大鼠血清PⅢP、LN含量的影响 见表3。
表3 各组大鼠血清PⅢP、LN含量比较(±s,μg/L)
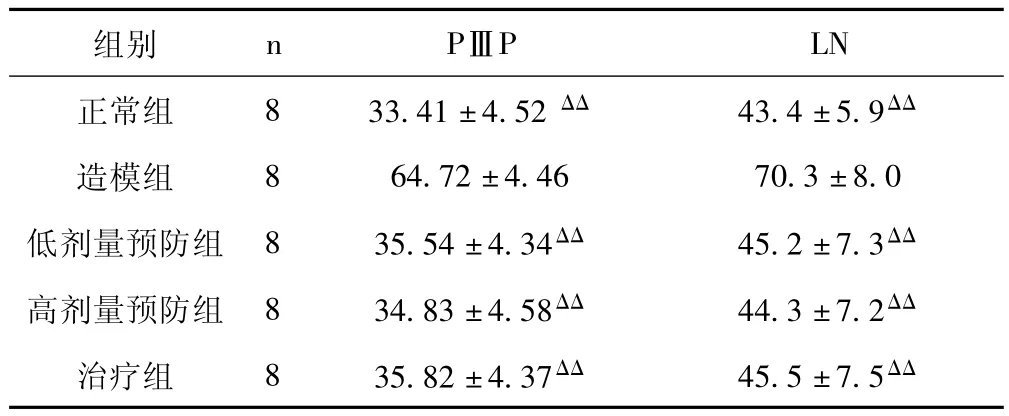
表3 各组大鼠血清PⅢP、LN含量比较(±s,μg/L)
与造模组比较,ΔΔP<0.01
组别 n PⅢP LN正常组 8 33.41±4.52 ΔΔ 43.4±5.9ΔΔ造模组 8 64.72 ±4.46 70.3 ±8.0低剂量预防组 8 35.54 ±4.34ΔΔ 45.2 ±7.3ΔΔ高剂量预防组 8 34.83 ±4.58ΔΔ 44.3 ±7.2ΔΔ治疗组 8 35.82±4.37ΔΔ 45.5±7.5ΔΔ
由表3可知,造模组大鼠血清PⅢP、LN含量显著高于正常对照组,酒客乐高、低剂量预防组及治疗组大鼠血清PⅢP、LN含量显著低于造模组,表明酒客乐能显著降低大鼠血清PⅢP、LN含量,减轻肝纤维化程度。
2.5 酒客乐对大鼠肝脏表达TGF-β1水平的影响 正常组大鼠肝脏表达的TGF-β1主要分布于门静脉周围细胞,导管周围细胞,肝小叶中央静脉周围与肝包膜间质细胞。造模组大鼠肝脏表达的TGF-β1在上述部位明显增加,有的形成网状间隔。酒客乐高、低剂量预防组及治疗组大鼠肝小叶内中央静脉虽可见TGF-β1染色增强,但比造模组TGF-β1染色程度明显减轻,且无网状间隔。免疫组化图像分析结果见表4。
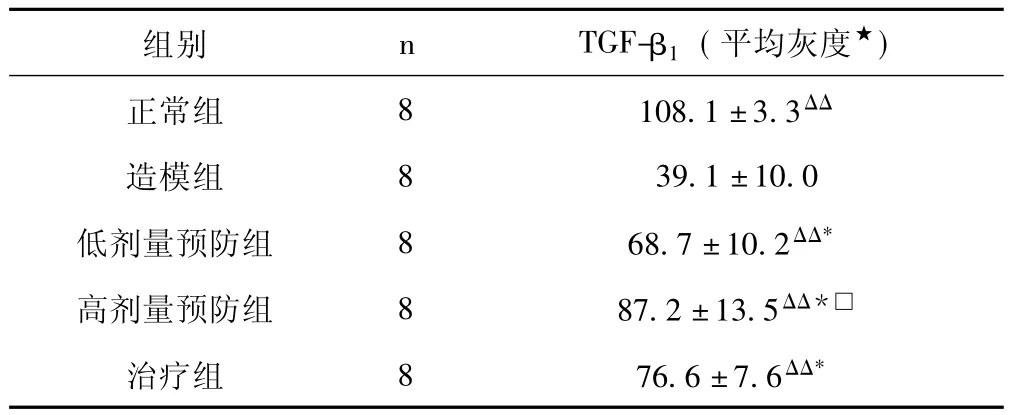
表4 各组大鼠肝脏表达TGF-β1水平的比较
由表4可知,造模组大鼠肝组织表达TGF-β1水平显著高于正常对照组。酒客乐高、低剂量预防组、治疗组大鼠肝脏表达TGF-β1水平显著低于造模组。表明酒客乐能抑制大鼠肝组织TGF-β1产生,抑制细胞外基质 (ECM)产生,减轻肝纤维化程度。
3 讨论
中医医籍中称酗酒所致疾病为“酒客病”,酒客乐是集历代中医治疗酒客病的经验,针对酒精性味辛甘,大热有毒,气味俱阳,体湿性热,易致肝、胃损伤的特点研制而成。方中葛花性味甘凉,芳香轻扬,既能解酒又能醒脾;枳椇子性味甘酸平,《滇南本草》记载:“能解酒毒”。二者均为公认的解酒要药[5],共为君药。陈皮理气健脾,燥湿化痰;紫苏叶行气和胃;白豆蔻行气化浊;檀香理气和胃,共为臣药。诸药相伍,共奏理气健脾,化湿祛痰,解化酒毒之功效。葛花主要有形成分为异黄酮类,实验表明葛花的异黄酮类和三萜类成分能使饮用乙醇小鼠血中乙醛含量降低,有利于减轻乙醇中毒。葛花的甲醇提取物尚能抑制肝损害的ALT及AST升高,另外还可降血脂,改善肝脏微循环[6]。枳椇子为枳椇的干燥成熟种子,含大量葡萄糖、苹果酸钙,实验证明,枳椇子能使小鼠醉酒时间明显缩短,能降低血中乙醇浓度[7],能显著增加小鼠综合体能和抵御不良刺激的能力[8]。
国内外病理学者研究表明酒精性肝纤维化典型的组织病理学表现为:①肝星芒状纤维化 (stellate fibrosis):从门脉区向肝小叶星芒状伸展;②肝细胞周围纤维化 (pericellular fibrosis):各个或数个肝细胞被包绕的纤维化,不包括沿着肝窦壁伸展的直线性纤维化;③中心静脉周围纤维化 (perivenular fibrosis):2/3以上的中心静脉壁厚度大于4μm;④汇管区稠密化 (dense fibrosis):门脉区或纤维隔部位的胶原密集成束状[9~11]。酒精性肝纤维化形成中,早期以Ⅳ型胶原和LN在窦周沉积为主[12],胶原沉积部位有大量活化的星状细胞存在[13]。本研究中光镜和电镜观察结果表明,酒客乐能明显减轻酒精性肝纤维化大鼠肝脏病理形态改变。
大量研究表明,血清PⅢP能很好地反映肝纤维组织生成的活动性,它反映的是胶原合成的能力,是观察抗纤维化药物疗效的较好指标。LN缓慢地参与了肝纤维化的形成过程,其血清值可以反映毛细血管化与汇管区纤维化。而且,一些常规的血液学或肝脏生化学指标也与肝纤维化进程有不同程度的关系,如 ALT、AST、γ-GT(γ-谷氨酰转肽酶) 等[14]。本研究结果显示酒客乐能降低ALT、AST、PⅢP、LN的含量,表明其具有抗酒精性肝纤维化的作用。
ECM是存在于细胞外的间质成分。肝纤维化的病理改变因ECM的增生和降解失衡所致[15,16]。ECM不仅是一种惰性支持物,又具有活跃的生物学功能,近来研究发现,ECM沉积并非仅仅是一个“空间占有”现象,而是一个动态过程[17],参与了细胞增殖、分化、迁移等过程,在许多病理过程中ECM发生改变。TGF-β1是一类多功能的生长因子,参与体内多种生理病理过程,对细胞的增殖和发育、转化的分化都有一定的调节作用,对TGF-β1深入研究表明,TGF-β1与肝脏的再生、纤维化及癌变有密切关系,TGF-β1能促进肝脏ECM生成[18],抑制基质金属蛋白酶 (matrix metalloproteinase,MMP)的产生及其活性[19],从而抑制ECM的降解,在肝纤维化病理过程中起重要作用。本实验免疫组化研究表明,酒精性肝纤维化时大鼠肝脏TGF-β1表达增强,酒客乐高、低剂量预防组和治疗组大鼠肝脏表达的TGF-β1较造模组明显减少(P<0.01),表明酒客乐通过抑制TGF-β1表达而减少ECM的生成,加速ECM降解,最终抑制酒精性肝纤维化的形成。
[1]邱德凯.重视对酒精性肝病的防治 [J].中华消化杂志,1993,13(3):126.
[2]雷秉钧.老年酒精性肝病 [J].实用老年病学,1995,9(3):104.
[3]LIEBER CS.Prevention and treatment of liver fibrosis based on pathogenesis [J].Alcohol Clin Exp Res,1999,23(5):944-949.
[4]CUI WEI,SU XIAO-LIN,FU BAO-YU.Kangxianfufang-Ⅰprevents fibrosis in alcoholic liver disease in the rat[J].World Chin J Digestol,2002,10(11):1245-1249.
[5]孙龙川.本草解酒药物辑要[J].江西中医药,1992,23(1):55.
[6]阴健,郭立弓.中药现代研究与临床应用[M].北京:学苑出版社,1993:632-634.
[7]苗明三.法定中药药理与临床[M].西安:世界图书出版西安公司,1998:1399.
[8]KEN-LCHI KAUAI,TOSHIYUKI AKIYAMA,YUKIO OGIHARA,et al.A new sapogenin in the saponins of Zizyphus jujuba,Hovenid dulcis and Bacopa monniera [J].Phytochemistry,1974,13(12):2829-2832.
[9]FRENCH SW,NAS HJ,SHITABOTA P,et al.Pathology of alcoholic liver disease [J].Semi Live Dis,1993,13(2):154-169.
[10]加贺田,奥平雅彦,打越每之,他.アルユール性肝障害の病理組織学的檢討 [J].肝脏,1993,34:710-713.
[11]王泰岭,赵静波.酒精性肝病的病理[J].胃肠病学与肝脏病学杂志,1997,6(1):4-8.
[12]TSUTSUMI M,URASHIMA S,MATSUDA Y,et al.Change in typeⅣcollagen content in liver of patients with alcoholic liver disease[J].Hepatology,1993,17(5):820-827.
[13]MAK KM,LEO MA,LIEVER CS.Alcoholic liver injury in baboons:transformation of lipotytes to transitional cells [J].Gastroenterology,1984,87(1):188-200.
[14]GIANNINI E,CEPPA P,BOTTA F,et al.Steatosis and bile duct damage in chronic hepatitis C:distribution and relationships in a group of Northern Italian patients [J].Liver,1999,19(5):432-437.
[15]SAKATA R,UENO T,NAKAMURA T,et al.Green tea polyphend epigallocate chin-3-gallate inhibits platelet-derived growth facter-induced prof-liferation human hepatic stellate cell line LI 90[J].Hepatal,2004,40(1):52-59.
[16]ISONO M,SODA M,INOUE A,et al.Reverse transformation of hepatic myofibroblast-like cells by TGF betal/LAP [J].Biochem Biophys Res Commun,2003,311(4):559-653.
[17]程明亮,刘三都.肝纤维化的基础研究与临床[M].北京:人民卫生出版社,1995:313-314.
[18]NIEMELA O,PARKKILA S,PASANEN M,et al.Early alcoholic liver injury formation of protein adducts with acetaldehyde and lipid peroxidation Products,and expression of CXPZEI and CYP3A[J].Alcohol Clin Exp Res,1998 ,22(9):2118-2124.
[19]OKAZAKIL,WATANABE,HAZAWA S,et al.Molecular mechanism of the reversibility of hepatic fibrosis with special reference to the role of matrix metaloproteinases [J].Gastroenterol Hepatol,2000,15(Suppl):D 26-32.
