转化生长因子β受体Ⅰ在红藻氨酸致癫痫大鼠额叶和海马的表达
2011-08-25俸军林蒋静子康俊玲
俸军林, 王 晶, 蒋静子, 康俊玲
转化生长因子 β(transforming growth factor-β,TGFβ)是在20世纪八十年代早期发现的具有转化特性的蛋白质,参与体内多种病理和生理过程,它在细胞膜表面的受体有3个亚型,即Ⅰ型、Ⅱ型及Ⅲ型受体(TβRⅠ、TβRⅡ、TβRⅢ)[1]。TGFβ 及其受体在中枢神经系统内广泛表达,通常认为TβRⅠ是中枢神经系统免疫和炎症过程的重要调节因子,是一种有效的免疫调节剂[2]。目前,有学者提出TβRⅠ参与了癫痫的发病机制,但尚需进一步研究。本实验利用立体定向技术行侧脑室注射红藻氨酸建立大鼠颞叶癫痫模型,用Western Bloting技术检测癫痫发作后不同时间点大鼠额叶及海马组织中TβRⅠ蛋白的表达情况,以探讨TβRⅠ与癫痫的关系。
1 材料与方法
1.1 实验动物及动物模型制作
1.1.1 实验动物及分组 雄性250~300g远交群(SD)大鼠60只,购自桂林医学院动物实验中心。实验动物饲养条件:温暖(20℃)、避强光、避噪音、单笼、自由进食和饮水。60只SD大鼠按随机数字表法分成对照组(10只)和模型组(50只),模型组按照致痫后动物处死时间再分为6h、12h、24h、72h、1w共5个亚组,每组10只。
1.1.2 动物模型制作 以3.6%水合氯醛360mg/kg腹腔注射麻醉SD大鼠,将大鼠头部固定在脑立体定向仪上,备皮,碘伏局部消毒后再用酒精消毒一次。铺孔巾,沿头部正中线切开头皮约1cm,暴露前囟。按照大鼠脑立体定向图谱确定侧脑室位置(前囟后0.8mm,右侧旁开1.5mm),钻一直径为1.0mm的圆孔,深度达硬脑膜表面,将预先装有KA的微量进样器沿钻孔进针,深度达4.5mm时缓慢进针,在10min 内缓慢匀速注射 1μg/μl KA 溶液 lμl,完毕后留针5min,缓慢拔除穿刺针,用骨蜡封闭颅骨钻孔,缝合头皮,放回笼中作行为学观察。按Racine[3]分级判断癫痫发作程度,Ⅲ级以上为成功动物模型。
1.1.3 脑组织的获取 按上述分组时间点,麻醉后断头处死大鼠,在冰台上取出大鼠脑组织,先取黄豆大小的额叶组织置入冻存管中,再于大脑背侧先用手术刀片轻划一刀,用镊子背缘迅速分离大脑组织,暴露出两侧海马,然后取出两侧海马,同样置入冻存管中,放入液氮中冻存。
1.2 实验方法
1.2.1 主要仪器试剂、仪器 Narishige SR-6R大鼠脑立体定向仪(日本产),DYCP-31A型电泳仪(北京六一仪器厂),DF-6P3C型超声细胞破碎机(宁波新芝科器研究所),TE-22型转膜仪(美国通用电器公司),JS-380型凝胶分析系统仪器(南宁精密仪器仪表有限公司);主要试剂:红藻氨酸(Sigma-Aldrich),Marker(上海生工生物工程技术服务有限公司),BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒、Western细胞裂解液和GAPDH抗体为碧云天生物技术公司提供,TβRⅠ(Santa Cruz Biotechnology)。
1.2.2 Western Bloting 检测脑组织中 TβRⅠ蛋白的表达
(1)总蛋白的提取:取液氮中保存的脑组织100mg置入研磨器中,研磨成粉末后转入EP管中,加入1ml蛋白裂解液(含PMSF)裂解30min后,置于超声细胞粉碎机下彻底粉碎组织;4℃下12000r/min离心30min,取上清蛋白分装于EP冻存管中,并置于-80℃保存。按BCA试剂盒说明制作标准曲线并测定蛋白含量。
(2)凝胶电泳:取总蛋白50μg,加等量2×加样缓冲液,100℃煮沸5min,冷却后10000r/min离心30s。在直流电压100~120V下进行电泳,当蛋白条带迁移至底部时即关闭电源。
(3)转膜:根据Marker条带将胶条割至合适大小,用转膜缓冲液平衡,将滤纸、PVDF膜切成与凝胶尺寸大小,转膜装置从下至上依次按阳极碳板、2层滤纸、PVDF膜、凝胶、2层滤纸、阴极碳板的顺序放好,接通电源,恒流1mA/cm2,转移2h。
(4)免疫反应:将膜用TBS从下向上浸湿后,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭1h,加 TβRⅠ多克隆抗体(1∶500),4℃杂交过夜,用TBST液洗膜30min(洗涤次数约2~3次)后用HRP标记的二抗杂交,37℃,1h。杂交后用TBST液洗膜30min(洗涤次数约2~3次)。
(5)化学发光、显影、定影:将杂交膜置于发光显影液中,保鲜膜包好,放入X光片夹中。在红灯下取出X光片,迅速浸入显影液中显影,待出现明显条带后,立即把X光片浸入定影液中,以胶片透明为止。用自来水冲去胶片上残留的定影液,室温下晾干。
(6)凝胶图象分析:将胶片进行扫描或拍照,用凝胶图象处理系统分析,计算待测基因与GA PDH光密度比值,然后与对照组进行比较。
1.3 统计学处理
2 结果
2.1 实验大鼠的行为学观察
侧脑室注入KA后10~30min,模型组绝大部分大鼠即表现出胡须颤动、面部惊厥、节律性点头、单侧前肢的阵挛,持续约30 min;注射后1~3h出现反复发作的凝视、咀嚼、流涎、面部抽搐、肢体抽搐、身体背曲、尾部翘起、站立跌倒等癫痫发作表现。每次发作数秒至十余秒,反复间歇发作数小时;6~8h后发作次数逐渐减少,24h~1w期间可出现间断性自发性发作。按Racine[3]分级标准:0级:0只,Ⅰ级:0只,Ⅱ级:0只,Ⅲ级19只,Ⅳ级:21只,Ⅴ级10只,符合模型组标准,全部认为造模成功,术后无法耐受全身强直发作死亡5只,其中Ⅴ级3只,Ⅳ级2只,为达到平均分组再次造模5只,均达到入选标准,无死亡。生理盐水组(对照组)大鼠无上述异常表现。
2.2 大鼠额叶及海马组织TβRⅠ蛋白的表达
2.2.1 额叶 与对照组比较,模型组大鼠额叶组织中TβRⅠ蛋白的表达在致痫后6h开始增高,72h左右达高峰,约1w后表达有所减弱。模型组大鼠致痫后各亚组额叶组织中TβRⅠ蛋白表达均显著高于对照组,差异有统计学意义(P<0.01)(见表1、图1)。
2.2.2 海马 与对照组比较,模型组大鼠额叶组织中TβRⅠ蛋白的表达在致痫后6h开始增高,72h左右达高峰,约1w后表达有所减弱。模型组大鼠致痫后各亚组海马组织中TβRⅠ蛋白表达均显著高于对照组,差异有统计学意义(P<0.01)(见表1、图2)。
2.2.3 额叶与海马TβRⅠ蛋白表达的比较统计分析显示,海马组织中TβRⅠ蛋白的表达比额叶更明显,差异有统计学意义(P<0.05)(见表1)。
表1 模型组与对照组大鼠TβRⅠ蛋白/GAPDH灰度值比值±s)

表1 模型组与对照组大鼠TβRⅠ蛋白/GAPDH灰度值比值±s)
与对照组比较*P<0.01;与海马比较#P<0.05
组别 n 额叶 海马对照组6h组12h组24h组72h组1w组1010101010100.165 ±0.1860.351 ±0.095*#0.395 ±0.115*#0.433 ±0.159*#0.463 ±0.141*#0.410 ±0.178*#0.173 ±0.1990.323 ±0.115*0.511 ±0.159*0.563 ±0.164*0.651 ±0.171*0.508 ±0.111*
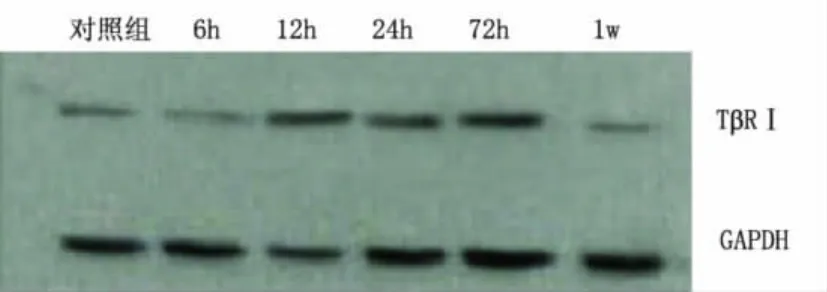
图1 Western Bloting检测各组大鼠额叶TβRⅠ蛋白的表达
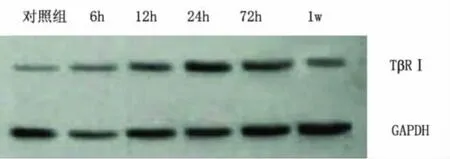
图2 Western Bloting检测各组大鼠海马TβRⅠ蛋白的表达
3 讨论
KA侧脑室注射所致大鼠癫痫模型主要是模拟人类颞叶癫痫。实验表明,癫痫脑组织中星型胶质细胞发生了明显的数量、形态及功能的变化,星型胶质细胞增生可作为颞叶癫痫患者的病理学特征[4]。转化生长因子家族(TGFs)是多效性的细胞因子,在细胞间通信起着关键作用,其信号通路对细胞生长、分化、增殖、黏附、迁移及凋亡等生理病理过程起重要作用[5]。TGFs发挥发生物作用主要通过TβRⅠ和TβRⅡ激活细胞内信号系统,如:Smads蛋白通路或P38 MAPK通路,将TβRⅠ的信号由胞浆传递到胞核调节相应的靶基因转录[6]。Cacheaux等[7]提出TGF可作为“一个新的抑制胶质细胞功能,在癫痫发生过程中改变胶质细胞-神经元信息连通的途径”。既往已有报道表明,TβRⅠ介导肾脏和肺的内皮细胞摄取蛋白质[8]。TβRⅠ广泛表达于大脑神经系统,脑损伤后TβRⅠ表达明显增高,但TβRⅠ与癫痫的关系尚未明了。有学者提出,TβRⅠ介导星型胶质细胞转运血清蛋白质参与癫痫的发生[9]。其研究是通过脱氧皮质固酮破坏血脑屏障建立起体内模型,采用荧光标记跟踪技术可见BBB通透性增高,血清蛋白质通过胞内隆突从核外转移到核内。将皮质区域暴露于 TβRⅠ激酶活性抑制剂SB431542中,减少了荧光素-白蛋白标记细胞的数量,并且标记的部分显示主要为细胞膜染色,没有细胞核染色,表明血清蛋白质转运是依赖于TβRⅠ。将大鼠皮质暴露于缺乏TβRⅠ的血清蛋白质环境中,与暴露于含有TβRⅠ的血清蛋白质环境中进行对照,发现脑微环境暴露于后者能产生的痫样活动,人为使用TβRⅠ抑制剂可抑制蛋白质的摄取,说明蛋白质进入星型胶质细胞是由 TβRⅠ介导的。Koller H等[10]发现,在大鼠癫痫模型中反应性星型胶质细胞中TβRⅠ激活引起K+内向整流通道下调,最终细胞外功能依赖性K+聚集,NMDA受体激活而促发痫样活动。以上资料表明,星型胶质细胞摄取蛋白质是由TβRⅠ介导的,TβRⅠ激活使星型胶质细胞K+通道快速下调,更进一步证明TβRⅠ与蛋白质的相互作用直接调节星型胶质细胞的功能,并参与癫痫的发病机制。重庆市癫痫病防治中心利用患者脑库组织进行临床实验,参考基因芯片表达谱的结果,研究TβRⅠ在颞叶癫痫灶中的表达情况,实验研究表明难治性颞叶灶中星型胶质细胞TβRⅠ蛋白表达明显增高,提出TβRⅠ可能参与人类颞叶癫痫的发病[11]。本实验结果显示,模型组大鼠额叶组织及海马组织中TβRⅠ的表达呈现出动态改变,在致痫后早期显著增高,以海马为甚,进一步证明TβRⅠ参与了癫痫早期的发病机制。
额叶是大脑发育中最高级的部分,它包括初级运动区、前运动区和前额叶,额叶的主要功能与精神、语言和随意运动有关。近年来国内外学者发现,25%癫痫患者较正常人群存在认知功能障碍[12]。海马担当着关于记忆以及空间定位的作用,KA致痫大鼠行为学表现与人类颞叶癫痫十分相似,致痫后大鼠海马CA3区和齿状回均出现明显的神经元脱失并有胶质细胞增生,神经元变性及大量固缩的坏死神经元[13]。本实验结果显示,大鼠致痫后TβRⅠ蛋白在海马组织表达较额叶更加显著,提示颞叶癫痫脑组织损伤以海马结构为主,同时有额叶脑组织损伤。
目前,TβRⅠ参与癫痫发病机制的研究甚少,本实验只是从TβRⅠ蛋白表达的角度为其参与癫痫发病机制提供实验依据。有关TβRⅠ在癫痫发病机制中的具体作用及详细机制,还需要更多、更深入的研究证明。
[1] 徐忠信,李 巍,包晓群,等.转化生长因子与脑缺血[J].中风与神经疾病杂志,1999,1(4):254 -256.
[2] Aigner L,Bogdahn U.TGF-beta in neural stem cells and in tumors of the central nervous system[J].J Cell Tissue Res,2008,331(1):225-241.
[3] Racine RJ.Modification of seizure activity by electrical stimulation Ⅱ-Motor seizure[J].Electroencophaogr Clin Neurophysiol,1972,32(3):281-294.
[4] Vezzani A,Balosso S,Ravizza T.The role of cytokines in the pathophysiology of epilepsy[J].Brain Behav Immun,2008,22(6):797 -803.
[5] Nishijima T,Piriz J,Duflot S,et al.Neuronal activity drives localized blood-brain-barrier transport of serum insulin-like growth factor-I into the CNS[J].J Neuron,2010,67(5):834 -846.
[6] Daniel M,Douglas MR,Lagord C,et al.High CSF transforming growth factor beta levels after subarachnoid haemorrhage:association with chronic communicating hydrocephalus[J].J Neurol Neurosurg Psychiatry,2009,80(5):545 -550.
[7] Cacheaux LP,Ivens S,David Y,et al.Transcriptome profiling reveals TGF-beta signaling involvement in epileptogenesis[J].J Neurosci,2009,29(28):8927 -8935.
[8] Fu Y,Chang A,Chang L,et al.Differential regulation of transforming growth factor beta signaling pathways by Notch in human endothelial cells[J].J Biol Chem,2009,284(29):19452 -19462.
[9] Ivens S,Kaufer D,Flores LP,et al.TGF-beta receptor-mediated albumin uptake into astrocytes is involved in neocortical epileptogenesis[J].Brain,2007,130(Pt 2):535 -547.
[10] Koller H,Schroeter M,Jander S,et al.Time course of inwardly rectifying K+current reduction in glial cells surrounding ischemic brain lesions[J].J Brain Res,2000,872:194 - 198.
[11] Lu Y,Xue T,Yuan J,et al.Increased expression of TGF-beta type I receptor in brain tissues of patients with temporal lobe epilepsy[J].Clin Sci(Lond),2009,117(1):17 -22.
[12] Liang S,Li A,Zhao M,et al.Epilepsy surgery in tuberous sclerosis complex:emphasis on surgical candidate and neuropsychology[J].JEpilepsia,2010,51(11):2316 -2321.
[13] 俸军林,蒋静子,李 浩,等.红藻氨酸致癫痫大鼠 S100B、CGRP蛋白表达及海马病理改变[J].中华神经医学杂志,2011,10(3):255 -259.
