骨髓间充质干细胞移植治疗对大鼠脑梗死后神经再生抑制因素的影响
2011-08-25梁松岚杨风刚金永华冯念苹
梁松岚, 郝 光, 杨风刚, 金永华, 冯念苹
神经再生是近年来研究的热点,其中Nogo-A、少突胶质细胞髓磷酯糖蛋白(oligodendrocyte myelin glycoprotein,OMgp)和髓磷酯相关糖蛋白 (myelinassociated glycoprotein,MAG)是3种重要的神经轴突生长抑制因子。既往研究证实3种分子对轴突再生有较强的抑制作用[1]。骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)已被证明移植后可进入到受损脑组织区域,分泌神经生长因子、血管内皮生长因子等,减少缺血半暗带的细胞凋亡,改善局部血液循环,促进轴突再生和突触重建,从而有利于损伤后的神经功能恢复[2],但其促进神经功能恢复的机制是否与下调神经再生抑制因子的表达有关尚不清楚。本实验通过建立大鼠脑缺血再灌注模型来进一步探讨BMSCs移植后促进大鼠脑梗死神经功能恢复的机制,为干细胞移植治疗脑梗死完善理论依据。
1 材料和方法
1.1 主要试剂 DMEM培养液 (美国 Hyclone公司);胎牛血清(美国 Hyclone公司);胰酶(北京索来宝科技有限公司);Nogo-A兔抗多克隆抗体(武汉博士德生物工程有限公司);OMgp兔抗多克隆抗体,MAG兔抗多克隆抗体(北京博奥森生物技术有限公司);二步法免疫组化检测试剂,二氨基联苯胺(DAB)显色剂(北京中杉金桥生物技术有限公司)。
1.2 实验动物及分组 健康SD大鼠,体质量80~120g,雌雄不限,哈尔滨医科大学实验动物中心提供。动物模型:健康SD大鼠102只,体质量220~280g,雄性,实验动物分为假手术组(Sham组)、损伤对照组(MCAO组)、溶剂对照组(Vehicle组)和移植组(BMSCs组),各组再自造模成功起计算分为3、7、14、21 d组,每组6 只,其中3d 组共12 只,6 只取材,6只用于观察BMSCs分布。
1.3 局灶性脑缺血再灌注模型建立 采用改良Longa法[3]制备大鼠左侧大脑中动脉缺血再灌注模型。线栓采用直径0.234mm的鱼线头端蘸蜡。用10%水合氯醛 (0.35ml/100g)腹腔麻醉大鼠,仰卧固定,在颈部正中略偏左行2.0~2.5cm 纵向切口,暴露分离出左侧颈总动脉、颈外动脉、颈内动脉。线栓经颈总动脉插入颈内动脉,自分叉处计算插线长度约18~20mm。假手术组除不插入线栓外,其余过程同上。脑缺血2h后,轻轻抽出尼龙线至有阻力感,实施再灌注。按 Zea Longa评分标准[3]对术后动物评分,0分:无神经缺损症状;1分:不能伸展右侧前爪;2分:行走时向右侧转圈;3分:行走时向右侧倾倒;4分:不能自发行走,意识丧失,1~3分者纳入实验。
1.4 神经功能缺损程度评分 评分观察者为非本试验组人员,在损伤后不同时间点参照Chen等[4]发表的改良神经功能缺损程度评分(modified neurological severity score,mNSS)方法,去掉了一些不易判断结果的项目,如深感觉检测、平衡试验等。所有动物在术后3、7、14、21d分别进行评分。
1.5 BMSCs的分离与培养 脱颈处死大鼠,无菌操作取出双侧股骨、胫骨,剔肉,暴露骨髓腔。用注射器抽取DMEM培养液(含10%胎牛血清)冲洗骨髓腔,收集骨髓细胞液,轻轻吹打均匀,然后用200目无菌金属滤网过滤。以1×109个/L的密度接种于培养瓶中,置于37℃、5%CO2饱和湿度培养箱中培养。接种后48h更换培养液,去除未贴壁细胞,此后每2d更换培养液1次。培养10~14d,以1∶2比例传代培养。其后每2d更换培养液1次,每7~10d传代1次。
1.6 BMSCs的标记与移植 收集第3代MSCs,绿色荧光染料羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)标记,具体步骤按说明书操作。将标记的BMSCs用0.01mol/L PBS稀释成3×109个/L的细胞悬液。于缺血24h,移植组经大鼠尾静脉注入1ml BMSCs悬液,对照组注入0.01 mol/L PBS 1ml。
1.7 BMSCs在脑内分布的观察 移植3d组处死6只大鼠,迅速取出脑组织,立即放入液氮中,以视交叉为中心定位制成冰冻切片,丙酮固定5min,倒置荧光显微镜下,用波长488nm的激发光观察由CFSE标记的BMSCs在移植大鼠脑内的存活及分布情况。
1.8 免疫组织化学染色 各组按相应时间点,过量麻醉,左心室插管,先后灌注0.9%生理盐水、4%多聚甲醛溶液各100ml内固定,断头取脑,置于超过标本体积10倍的4%多聚甲醛溶液中外固定至24h。以视交叉为中心向前、后各取2mm厚的冠状脑片,充分固定后常规脱水,透明、石蜡包埋、连续切片进行免疫组织化学染色,检测Nogo-A、OMgp和MAG蛋白的表达。Nogo-A抗体滴度为1∶30,OMgp抗体滴度1∶80,MAG抗体滴度1∶100。光学显微镜下观察,胞浆中有棕黄色颗粒的为阳性细胞。每张切片于梗死灶周围选择10个表达最强的视野,计数阳性细胞数后取平均值。
2 结果
2.1 BMSCs的分离与培养 原代培养的骨髓细胞接种3d,部分贴壁生长,多呈长梭形、三角形和多角形,即为BMSCs。5d开始,部分BMSCs形成集落。于7~12d开始呈指数增长,具有一定的方向性,呈束状或放射状排列。14d左右,细胞贴壁率达90%。传代培养的BMSCs形态多为长梭形,较原代细胞体积增大,增殖速度加快,贴壁能力增强,7d左右贴壁率达80% ~90%(见图1、图2)。
2.2 BMSCs在脑组织中的分布 荧光显微镜下可观察到发绿色荧光的BMSCs,表明BMSCs在移植后到达脑组织,在脑组织中存活良好(见图3)。
2.3 大鼠神经功能缺损程度评分 BMSCs组在7、14和21d神经功能缺损评分优于MCAO组和Vehicle组,差异有统计学意义,P<0.05(见表1)。
2.4 免疫组织化学染色结果 Nogo-A阳性染色主要在少突胶质细胞中表达,神经元中也有表达,大体成环状或半弧形分布。Sham组各时间点损伤区周边白质中可见少量散在的Nogo-A阳性细胞,MCAO组和Vehicle组Nogo-A阳性染色细胞数于造模成功后3d增加,7d有所减少,14d达到高峰,21d时减少,在3、14和21d时Nogo-A阳性染色细胞数均高于Sham组相应时间点,差异具有显著性(P<0.05)。BMSCs组 Nogo-A阳性细胞数在 3、14和21d均少于 MCAO组和 Vehicle组(P<0.05),其中,BMSCs组14d Nogo-A阳性染色细胞数仍高于Sham组14d时的表达(P<0.05)。
OMgp阳性染色在少突胶质细胞、神经元中均有表达,成环状或弧形分布于细胞质。Sham组各时间点损伤区周边白质中可见少量散在的OMgp阳性细胞,MCAO组和Vehicle组OMgp阳性染色细胞数于造模成功后3d增加,14d达到高峰,21d时仍然维持在14d水平,在3、7、14和21d时OMgp阳性染色细胞数均高于 Sham组相应时间点(P<0.05)。BMSCs组OMgp阳性细胞数在7、14和21d均少于MCAO组和Vehicle组(P<0.05)。MAG阳性染色在少突胶质细胞中表达,成环状或弧形分布。Sham组各时间点损伤区周边白质中可见少量散在的MAG阳性细胞,MCAO组和Vehicle组MAG阳性染色细胞数于造模成功后3d明显增加,7d至14d保持同3d水平,至21d时减少,在3、7、14和21d时MAG阳性染色细胞数均高Sham组相应时间点(P<0.05)。BMSCs组 MAG 阳性细胞数在 3、7、14 和21d均少于MCAO组和Vehicle组(P<0.05)(见表2~表4、图4~图6)。

图1 光学显微镜下原代培养14d(×100)

图2 第3代BMSCs(×100)
图3 荧光显微镜下移植BMSCs分布(×200)
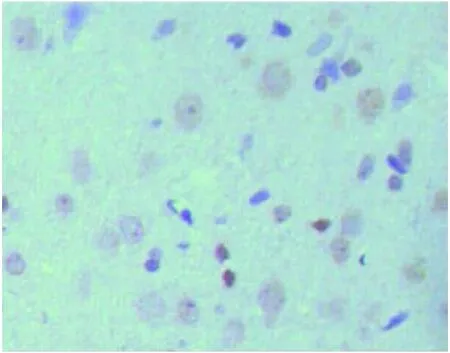
图4 光学显微镜下Nogo-A的表达(×400)

图5 光学显微镜下OMgp的表达(×400)
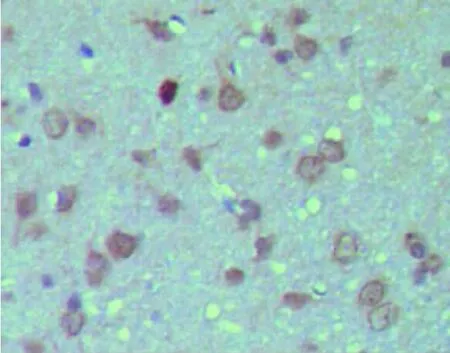
图6 光学显微镜下MAG的表达(×400)
表1 各组不同时间点mNSS评分结果 ± s,n=6)

表1 各组不同时间点mNSS评分结果 ± s,n=6)
与MCAO 组比较#P <0.05,与 Vehicle组比较*P <0.05
组别3d 7d 14d 21d MCAO组Vehicle组BMSCs组3.67 ±0.523.50 ±0.553.33 ±0.522.83 ±0.752.83 ±0.751.83 ±0.41#*2.17 ±0.752.33 ±0.521.17 ±0.41#*2.00 ±0.632.00 ±0.631.17 ±0.41#*
表2 各组不同时间点Nogo-A阳性细胞数比较 ± s,n=6)
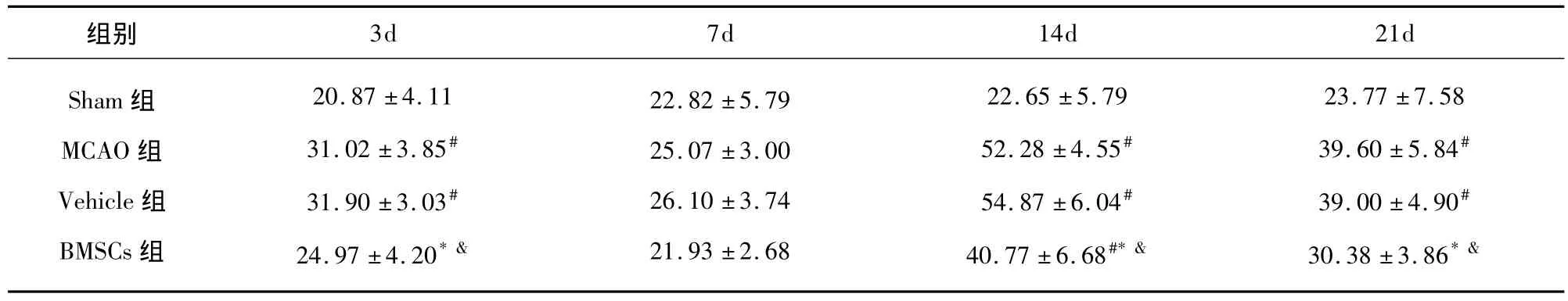
表2 各组不同时间点Nogo-A阳性细胞数比较 ± s,n=6)
与Sham 组比较#P <0.05,和 MCAO 组比较*P<0.05,和Vehicle组比较 & P <0.05
Sham组MCAO组Vehicle组BMSCs组20.87 ±4.1131.02 ±3.85#31.90 ±3.03#24.97 ±4.20*&22.82 ±5.7925.07 ±3.0026.10 ±3.7421.93 ±2.6825 ±5.79528 ±4.55#54.87 ±6.04#40.77 ±6.68#*&23.77 ±7.5839.60 ±5.84#39.00 ±4.90#30.38 ±3.86*&
± s,n=6)表3 各组不同时间点OMgp阳性细胞数比较

± s,n=6)表3 各组不同时间点OMgp阳性细胞数比较
与Sham 组比较#P <0.05,和 MCAO 组比较*P<0.05,和Vehicle组比较 & P <0.05
Sham组MCAO组Vehicle组BMSCs组21.58 ±3.4432.60 ±5.14#33.17 ±5.02#30.42 ±3.58#21.05 ±2.6840.87 ±3.12#42.52 ±4.86#31.22 ±3.22#*&22.17 ±3.8646.02 ±3.35#45.37 ±4.26#32.55 ±5.94#*&23.25 ±4.7547.25 ±3.64#48.47 ±3.26#32.23 ±3.97#*&
表4 各组不同时间点MAG阳性细胞数比较 ± s,n=6)

表4 各组不同时间点MAG阳性细胞数比较 ± s,n=6)
与Sham 组比较#P <0.05,和 MCAO 组比较*P<0.05,和Vehicle组比较 & P <0.05
Sham组MCAO组Vehicle组BMSCs组41.47 ±4.5868.48 ±6.35#70.47 ±4.21#51.68 ±7.21#*&41.12 ±3.4366.70 ±5.01#68.77 ±5.44#55.28 ±9.91#*&42.85 ±4.4367.32 ±6.69#69.38 ±4.95#53.52 ±7.70#*&39.97 ±4.2355.53 ±7.80#56.25 ±7.03#44.02 ±8.16*&
3 讨论
脑梗死后梗死灶中心区的神经细胞完全缺血坏死,周围的神经细胞也受到了不同程度的损伤。虽然中枢神经系统有一定的再生潜能,但是损伤后轴突再生抑制因子的存在不利于轴突生长,阻碍神经功能恢复。Nogo-A、OMgp和MAG是3种重要的髓鞘源性轴突再生抑制因子,是神经再生抑制微环境重要的组成成员。Nogo-A是Nogo基因编码3种产物之一,含有1163个氨基酸残基,主要表达于少突胶质细胞的内质网和细胞表面。目前研究发现Nogo-A 有3 个活性区域[5],可与受体 NgR 和 PirB[6]及结合素结合而发挥诱导生长锥塌陷和阻断轴突生长的作用。Papadopoulos等[7]发现,应用 Nogo-A单克隆抗体IN-1可促进大鼠脑梗死后皮质锥体细胞树突生成增加,促进神经功能恢复。OMgp在神经元和少突胶质细胞表达,是一种糖基磷脂酰肌醇连接蛋白(glycosylphosphatidyl-inositol-linked protein),锚定于少突细胞和神经元的胞膜上;MAG属于免疫球蛋白样凝集素家族成员,与神经细胞黏附分子(neural cell adhesion molecule,NCAM)高度同源,是一种含有600个氨基酸的跨膜蛋白,根据mRNA剪接形式的不同,生成的MAG产物分为两种异构体,即L-MAG和S-MAG。William等最近发现,在脊髓损伤的小鼠模型中,OMgp和MAG能够与Nogo-A发挥协同效应一起限制轴突生长和神经功能恢复[8]。
干细胞移植治疗技术仍然是当前研究的热点。BMSCs已被证明移植后可以通过多种机制促进神经功能恢复。BMSCs到达损伤部位以后可向神经元和胶质细胞转化,重建神经网络[9],可分泌各种神经生长因子如碱性成纤维生长因子(Fibroblast growt h factor,FGF)[10]、神经生长因子(Nerve growt h factor,NGF)[11]等参与损伤修复过程,同时还可以通过增加新生血管[12]来改善局部血液供应,加快神经功能恢复。有学者对接受BMSCs移植的脑梗死大鼠进行为期一年的研究发现,BMSCs移植可减小胶质瘢痕的厚度,减少瘢痕附近Nogo-A表达的细胞数量,促进大鼠神经功能恢复[13]。但是BMSCs移植后对神经再生抑制微环境其它因子有何影响,目前未见相关报道。
本研究采用全骨髓贴壁法分离培养BMSCs,经尾静脉进行BMSCs移植。脑梗死后3d在损伤周边区脑组织中观察到CFSE染色的绿色阳性细胞,表明移植的BMSCs能向受损部位迁移、募集、存活。在大鼠脑组织缺血损伤后,Nogo-A、OMgp和MAG表达较假手术组均有不同程度增加,且两个对照组之间相比无明显差异,而BMSCs组结果显示,多数时间点3种蛋白阳性表达细胞数都有所下降,且BMSCs组神经功能缺损评分结果表明该组大鼠神经功能恢复优于两个对照组,差异具有统计学意义。
因此,我们认为脑梗死后Nogo-A、OMgp和MAG 3种神经再生抑制因子的表达增加抑制神经再生,阻碍了神经功能恢复,而BMSCs移植可通过在一定程度上下调Nogo-A、OMgp和MAG的表达,削弱三者对神经再生的抑制作用,进而促进神经功能恢复。
[1] Yiu G,He ZG.Glial inhibition of CNS axon regeneration[J].Nat Rev Neurosci,2006,7(8):617-627.
[2] 行治国,潘兴华,朱兴宝,等.骨髓间充质干细胞移植治疗脑梗死:有望产生结构与功能的双重修复作用[J].中国组织工程研究与临床康复,2007,11(46):9369 -9374.
[3] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[4] Chen J,Li Y,Wang L,et al.Therapeutic benefit of intracerebral transplantation of bone marrow stromal cells after cerebral ischemia in rats[J].JNeurol Sci,2001,189(1 -2):49 - 57.
[5] Bongiorno D,Petratos S.Molecular regulation of Nogo-A in neural cells:Novel insights into structure and function[J].Int J Biochem Cell Biol,2010,42(7),1072 -1075.
[6] Atwal JK,Pinkston-Gosse J,Syken J,et al.PirB is a Functional Receptor for Myelin Inhibitors of Axonal Regeneration[J].Science,2008,322(5903),967 -970.
[7] Papadopoulos CM,Tsai S-Y,Cheatwood JL,et al.Dendritic plasticity in the adult rat following middle cerebral artery occlusion and Nogo-A neutralization[J].Cereb Cort,2006,16(4):529 -536.
[8] Cafferty WBJ,Duffy P,Huebner E,et al.MAG and OMgp Synergize with Nogo-A to Restrict Axonal Growth and Neurological Recovery after Spinal Cord Trauma[J].JNeurosci,2010,30(20):6825 -6837.
[9] Li Y,Chen J,Wang L,et al.Treatment of stroke in rat with intracarotid administration of marrow stromal cells[J].Neurology,2001,56(12)1666-1672.
[10] Schmidt A,Ladage D,Schin Kerhe T,et al.Basic fibroblast growth factor controls migration in human mesenchymal stem cells[J].Stem Cells,2006,24(7):1750 -1758.
[11] Chen Q,Long Y,Yuan X,et al.Protective effect s of bone marrow stromal cell transplantation in injured rodent brain:synthesis of neurotrophic factors[J].J Neurosci Res,2005,80(5):611 -619.
[12] Toyama K,Honmou O,Harada K,et al.Therapeutic benefits of angiogenetic gene-modified human mesenchymal stem cells after cerebral ischemia[J].Exp Neurol,2009,216(1):47 -55.
[13] Li HS,Li Y,Chen JL,et al.One-Year Follow-Up After Bone Marrow Stromal Cell Treatment in Middle-Aged Female Rats With Stroke[J].Stroke,2007,38:2150 -2156.
