NOS1基因多态性与腔隙性脑梗死相关性研究
2011-08-25张志茹杜丹华
高 鹏, 张志茹, 杜丹华, 吴 江
遗传学研究表明脑卒中的发生具有遗传易感性。由脑内小血管闭塞所导致的腔隙性脑梗死是脑卒中最常见的一种类型,其与脑内大中血管闭塞所致的动脉粥样硬化性脑梗死可能存在不同的遗传学机制。已有研究表明神经元型一氧化氮合酶(nNOS)催化生成的NO是小动脉NO的主要来源,具有抗小动脉硬化的作用[1]。缺乏一氧化氮(NO)会导致脑血管的自动调节功能受损[2,3],这是腔隙性脑梗死的发病机制之一。但目前国内外尚未见NOS1基因与腔隙性脑梗死关系的文献报道。本研究将编码nNOS的NOS1基因作为候选基因,探讨其基因多态性与腔隙性脑梗死的关系。
1 对象与方法
1.1 研究对象 本研究共纳入385例无血缘关系的腔隙性脑梗死患者和313例健康对照人群。病例组来自吉林大学第一医院神经科2005年~2006年的住院患者,男273例,女112例,平均年龄60.3±11.0岁。由2名神经科医生根据详细的神经科检查、头部CT或头部MRI,并依据TOAST分型标准[4]对腔隙性脑梗死患者做出诊断,除外房颤、肿瘤等栓子来源的脑栓塞性疾病;除外肝肾功能不全、血液系统疾病。对照组来自吉林大学第一医院体检中心同期门诊体检人群,男186例,女127例,平均年龄59.2±9.2岁。经病史询问无脑血管病史,部分经头部CT或MRI证实。所有入组人群均签署知情同意书,并采集全血用于DNA提取。
1.2 方法 我们选择了rs9658281(SNP1,MspⅠsite)和rs2682820(SNP2,HaeⅢ site)2个单核苷酸多态性位点,采用限制性酶切片段多态性的方法对SNPs基因型进行分析。应用DNA提取试剂盒(Promega,北京)提取基因组DNA。应用Primer 5.0软件设计引物,SNP1上游引物:5’-CAACCCTTAGCTTAAATCAG-3’,下游引物5’-GTGCCAGACCTAAGATGC-3’;SNP2 上游引物 5’-CCGAGGGTAACTGGACATTG-3’,下游引物 5’-CAAGGTAGGTGCTATAATCTC-3’,由上海生物工程技术有限公司合成。PCR 反应体系为 25μl,其中双蒸水 18μl,10mmol Tris-HCl(pH 8.3),50mmol KCl,1.5mmol MgCl2,4 种 dNTP 各 200μmol,引物各 0.4μmol,Taq DNA 聚合酶(Promega,北京)1.0U,基因组 DNA 30~50ng。PCR反应条件:94℃预变性5min,94℃变性45s,55℃复性 1min,72℃ 延伸 1min,35 个循环,最后72℃延伸10min。酶切体系:PCR产物以限制性内切酶(Promega,北京)于37℃水浴4~6h酶切,经2%琼脂糖凝胶电泳(90mV)40min,在凝胶成像系统(UVP,美国)下观察结果。
1.3 统计学分析 应用拟和优度检验分析病例组和对照组基因型频率的分布是否符合Hardy-Weinberg(H-W)平衡;采用UNPHASED遗传学软件[5]应用cocaphase对SNPs进行连锁不平衡分析;应用cocaphase对等位基因频率进行分析;采用SPSS15.0软件应用卡方检验对基因型频率进行分析;应用t检验对近似正态分布的计量资料进行分析。P<0.05认为有统计学意义。应用Logistic回归分析调整腔隙性脑梗死传统危险因素的影响。
2 结果
2.1临床指标检测结果 临床指标分析表明腔隙性脑梗死组高血压、糖尿病、吸烟、饮酒的频率显著高于对照组(P<0.01),腔隙性脑梗死组低密度脂蛋白(LDL-c)水平显著高于对照组(P<0.01),高密度脂蛋白(HDL-c)水平显著低于对照组(P<0.01),两组总胆固醇和甘油三酯水平无显著差异(P >0.05)。
2.2 Harding-Weinberg平衡分析 拟和优度检验表明腔隙性脑梗死组和对照组SNP1和SNP2的基因型均未偏离H-W平衡,说明我们选择的群体是随机婚配的群体,可以进行候选基因的关联分析。
2.3 NOS1基因SNP1和SNP2位点的连锁不平衡分析 应用UNPHASED软件对SNP1和SNP2位点进行连锁不平衡分析显示,SNP1和SNP2不在同一个连锁不平衡区(D’=0.14,r2=0.04)。
2.4 腔隙性脑梗死组与对照组 NOS1基因SNP1基因型、等位基因频率的比较 腔隙性脑梗死组SNP1位点G等位基因频率显著高于对照组(χ2=4.135,P=0.042,OR=1.422,95%CI 1.013 ~1.997),这种差异在女性患者更加明显(χ2=9.522,P=0.002,OR=2.502,95%CI 1.398 ~4.479)。腔隙性脑梗死组SNP1位点GG基因型频率明显高于对照组(χ2=5.862,P=0.015,OR=1.579,95%CI 1.091 ~2.286),这种差异在女性患者更加明显(χ2=13.641,P <0.0001,OR=3.501,95%CI 1.800 ~6.810)(见表1、表2)。
2.5 腔隙性脑梗死组与对照组 NOS1基因SNP2位点基因型、等位基因频率的比较 SNP2位点的基因型频率和等位基因频率在腔隙性脑梗死组和对照组的分布无显著性差异(P>0.05)(具体数据略)。
2.6 腔隙性脑梗死组危险因素的Logistic回归分析 应用SPSS15.0软件Logistic回归分析调整了传统危险因素的影响,NOS1基因SNP1位点的AA+AG基因型与腔隙性脑梗死仍有显著性相关(χ2=6.014,P=0.014,OR=0.725,95%CI 0.561 ~0.938)(见表3)。
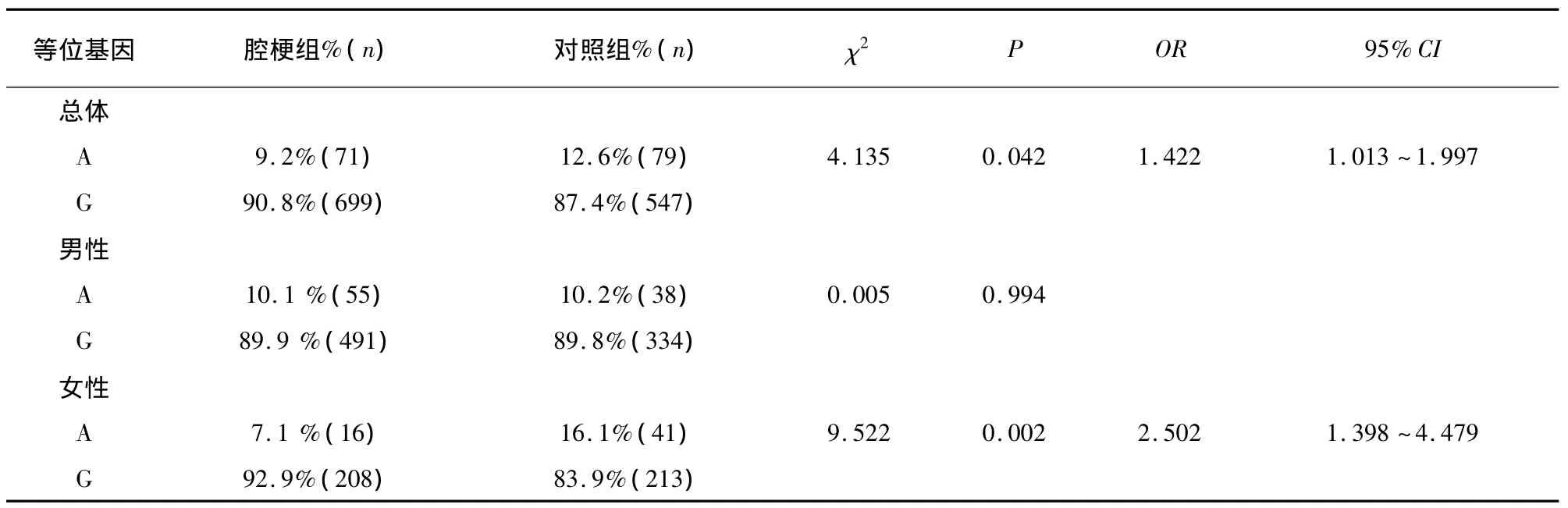
表1 腔隙性脑梗死组与对照组NOS1基因SNP1位点等位基因频率比较
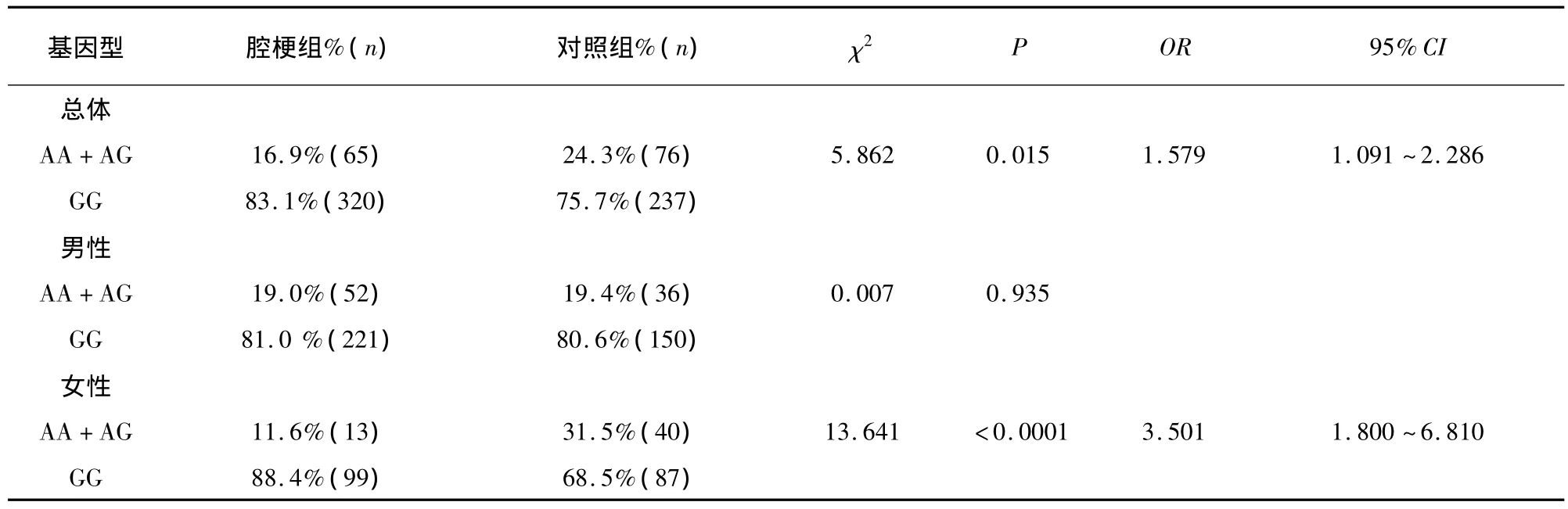
表2 腔隙性脑梗死组与对照组NOS1基因SNP1位点基因型频率比较
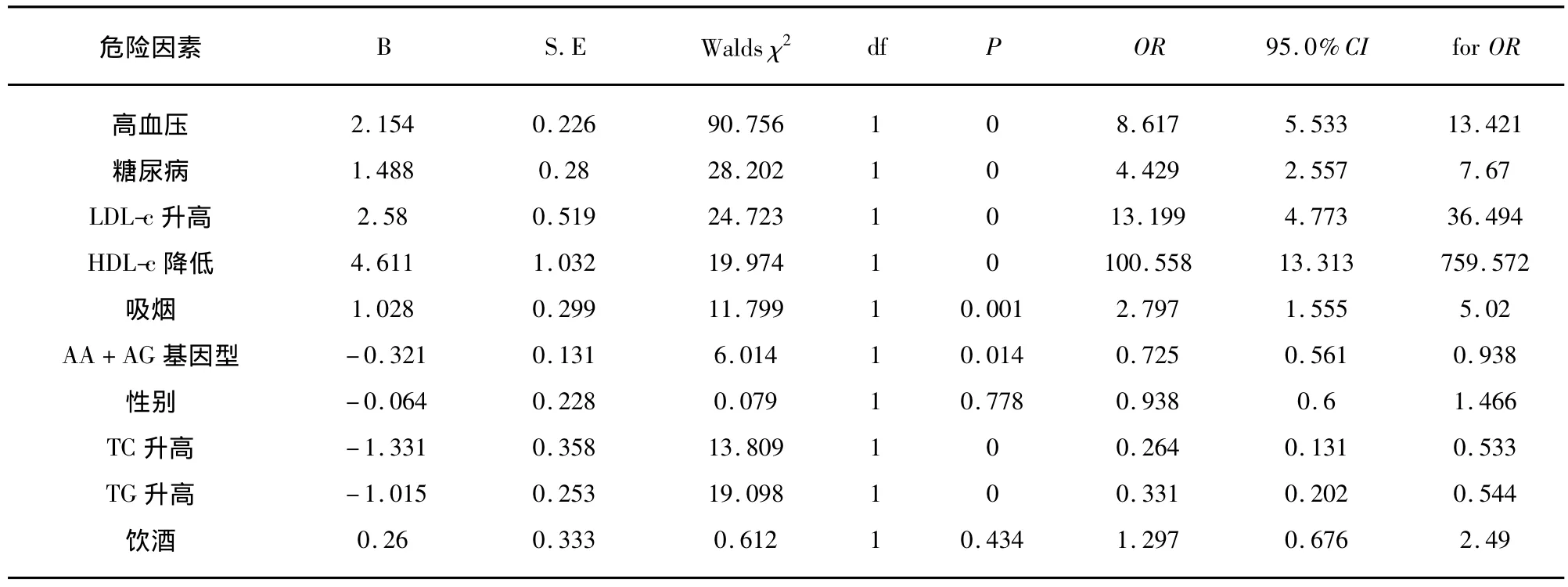
表3 NOS1基因SNP1基因型及其它危险因素与腔隙性脑梗死相关性的Logistic回归分析
3 讨论
NOS1 基因定位于染色体的 12q24.2-q24.31[6],包含29个外显子,在人类基因组的单体型中以单拷贝形式存在,编码nNOS。腔隙性脑梗死是由脑内小血管闭塞所致的脑组织缺血、坏死性疾病。而nNOS主要分布于神经元和支配小血管的硝基能纤维,nNOS源性的NO作为神经递质可引起附近血管平滑肌细胞舒张[7~9],其生成的NO是小动脉NO的主要来源,具有抗小动脉硬化的作用[1]。因此NOS1基因可能是腔隙性脑梗死潜在的候选基因。研究发现内含子是基因组中的一种重要调控元件,内含子可通过自身的剪接影响基因的表达,也可直接对基因的表达起调控作用[10]。因此我们选择位于2号内含子上的rs9658281位点(SNP1)及16号内含子上的rs2682820(SNP2)位点为遗传标记探讨NOS1基因与腔隙性脑梗死的关系。
我们的研究发现腔隙性脑梗死组过度传递了SNP1位点的G等位基因,提示NOS1基因与腔隙性脑梗死的发生存在关联。经Logistic回归分析调整了高血压、糖尿病、吸烟、血脂异常等传统危险因素后的P值为0.014,说明NOS1基因多态性与腔隙性脑梗死的发病相关,此前国内外学者均未见报道。
Morishita等[11]研究表明 NOS1 基因5’-UTR 区存在选择性剪切位点,不同的mRNA剪切变体导致NOS1基因在抑制AS新内膜形成及血管保护中作用的差异。Newton等[12]发现nNOSmRNA的1号变异外显子和2号外显子间存在一个89bp的选择性剪接外显子,该选择性剪接外显子可能是mRNA的翻译后调控元件,影响基因的转录效率,控制这一选择性剪接的位点可能位于1号外显子下游和2号外显子上游27.5kb的区域。我们所检测的NOS1基因的SNP1位点恰好位于这一区域。由此推测位于2号内含子SNP1位点的连锁不平衡信号来自这一区域。由于其影响了NOS1基因的转录,引起NO生成减少,导致动脉粥样硬化和腔隙性脑梗死的发生。
我们的研究发现NOS1基因与女性腔隙性脑梗死发生的关系更为密切。含有nNOS的神经元在脑内广泛存在,它们也分布在控制生殖的脑区。一些学者观察到雌激素可上调 nNOS的表达[13,14]。而nNOS的表达增加具有抗动脉粥样硬化的作用。本研究入组的腔隙性脑梗死组女性患者平均年龄为62.4±10.9岁,多为绝经后或围绝经期女性,普遍存在雌激素缺乏。因此我们推测,由于女性雌激素水平降低,导致nNOS的表达下调。
此外,我们的病例组人群来自于北方汉族人,这一研究结果还需要在不同地域、不同种族的人群中进行大样本的重复进一步验证。
[1] Tsuyoshi M,Tsutsui M,Shimokawa H,et al.Vasculoprotective roles of neuronal nitric oxide synthase[J].The FASEB J,2002,16(14):1994-1996.
[2] Yahashi Y,Kario K,Shimada K,et al.The27-bp repeat polymorphism in intron 4 of the endothelial cell nitric oxide synthase gene and ischemic stroke in a Japanese population[J].Blood Coagul Fibrinolysis,1998,9:405 -409.
[3] Hou L,Osei-Hyiaman D,Yu H,et al.Association of a 27-bp repeat polymorphism in ecNOSgene with ischemic stroke in Chinese patients[J].Neurology,2001,56:490 - 496.
[4] Adams HP,Bendixen BH,Kappelle LJ,et al.Classification of subtype of acute ischemic stroke,definition for use in a multicenter clinical trial[J].Stroke,1993,24(1):35 - 41.
[5] Dudbridge F.Pedigree disequilibrium tests for multilocus haplotypes[J].Genet Epidemiol,2003,25:115 -121.
[6] Xu W,Gorman P,Sheer D,et al.Regional localization of the gene coding for human brain nitric oxide synthase(NOS1)to 12q24.2-24.31 by fluorescent in situ hybridization[J].Cytogenet Cell Genet,1993,64:62-63.
[7] Iadecola C.Regulation of the cerebral microcirculation during neural activity:is nitric oxide the missing link[J].Trends Neurosci,1993,16:206-214.
[8] Toda N,Okamura T.Nitroxidergic nerve:regulation of vascular tone and blood flow in the brain[J].J Hypertens,1996,14:423 -434.
[9] Lee TJ,Liu J,Evans MS.Cholinergic-nitrergic transmitter mechanisms in the cerebral circulation[J].Microsc Res Tech,2001,53:119 -128.
[10] 王晓斌,刘国仰.有关内含子功能研究的新进展[J].中华医学遗传学杂志,2000,17(3):211 -212.
[11] Morishita T,Tsutsui M,Shimokawa H,et al.Vasculoprotective roles of neuronal nitric oxide synthase[J].FASEB J,2002,16:1994 -1996.
[12] Newton DC,Bevan SC,Choi S,et al.Translational regulation of human neuronal nitric-oxide synthase by an alternatively spliced 5'-untranslated region leader exon[J].JBiol Chem,2003,278(1):636 -644.
[13] Wood CE,Giroux D.Expression of nitric oxide synthase isoforms in the ovine fetal brain:alteration by hormonal and hemodynamic stimuli[J].JSoc Gynecol Investig,2006,13(5):329 -337.
[14] Panzica GC,Viglietti-Panzica C,Sica M,et al.Effects of gonadal hormones on central nitric oxide producing systems[J].Neuroscience,2006,138(3):987 -995.
