依达拉奉对阿尔茨海默病模型大鼠认知损害的保护作用和脑内Bcl-2表达的影响
2011-08-25周珊珊刘丽娜冯连荣张黎明
周珊珊, 刘丽娜, 冯连荣, 张黎明
阿尔茨海默病(Alzheimer disease,AD)是一种年龄相关的进行性、获得性神经系统退行性疾病,常表现为认知功能障碍、记忆力减退。AD作为老年痴呆的主要原因其病因尚不清楚,而且缺乏有效的预防和治疗方法。随着我国老龄化加剧,AD患病率逐年增加,AD的预防和治疗已经成为一个重要的医学和社会问题。目前研究认为AD的病理基础包括老年斑形成、神经原纤维缠结、神经元缺失和胆碱能神经元变性等[1]。在众多的AD病因假说中,自由基的产生被认为是一个十分重要的因素。大量研究证据表明机体自由基产生和抗氧化系统作用失衡产生的氧化应激在AD发病早期的神经损伤中起重要作用[2]。我们旨在通过ICV-STZ建立模型,应用新型自由基清除剂-依达拉奉进行干预,研究依达拉奉对AD模型大鼠脑内氧化应激和神经细胞凋亡的影响,初步探讨依达拉奉对AD模型大鼠认知功能改善作用的机制,为AD的预防和药物治疗提供新的思路。
1 材料和方法
1.1 实验材料及主要试剂 雄性成年SD大鼠48只,购于北京维通利华实验动物技术有限公司,体重200~250g。按每组12只(6只用于生化检测,6只用于免疫组化检测)随机分成4组:假手术组(S)、依达拉奉 +假手术组(E+S)、ICV-STZ组(L)、依达拉奉+ICV-STZ组(E+L)。依达拉奉(南京先声东元制药有限公司),链脲菌素(Streptozotocin,STZ,美国 Sigma公司),SOD、MDA 检测试剂盒(南京建成生物工程研究所),兔抗大鼠Bcl-2单克隆抗体(一抗,美国Santa Cruz公司),辣根过氧化物酶(HRP)标记的山羊抗兔IgG多克隆抗体(PV6001,二抗,北京中杉金桥公司),3,3’-四盐酸二氨基联苯胺(DAB,北京中杉金桥公司)。
1.2 给药方法 E+S组和E+L组大鼠每日分两次腹腔注射依达拉奉3mg·kg-1,共14d。其余两组每日腹腔注射等量的生理盐水。
1.3 AD模型的建立 依达拉奉干预14d后依照文献[3]的方法制模:大鼠10%水合氯醛3ml·kg-1腹腔注射麻醉,头部固定于立体定位仪上,沿头部正中线做矢状切口,分离皮下组织暴露颅骨。取前囟后0.8mm,左右旁开1.5mm颅骨打孔,垂直深度3.6mm微量加样器缓慢双侧脑室内注射STZ 3mg·kg-1。注入的STZ生理盐水溶液体积控制在10μl左右,假手术组脑室内注射相应体积的生理盐水。注射完毕用骨蜡封填颅骨缺损,缝合头皮。48h后重复上述手术注药过程。
1.4 Morris水迷宫评价认知功能 第一次脑室内注药2w后行Morris水迷宫测试评价各组大鼠的学习记忆能力[4]。水迷宫的主要组成部分是一个直径150cm,高60cm充满水的圆形不锈钢水池,水池分为4个象限,水池内壁呈黑色。逃逸平台是一个透明的直径为10cm的可移动圆柱形平台,其表面距水面2cm。定向航行试验:在测试中将平台放置在任一象限,选择某个象限将大鼠面朝池壁放入水中。大鼠到达平台后令其在平台停留30s,然后继续下一次训练,每次寻找平台时间不超过120s。每天训练4次,记录大鼠每次到达平台所用的时间,共训练5d。空间探索试验:第6天将水下平台撤去,将大鼠放入水中自由游动120s,记录大鼠在平台所在目标象限停留的时间。
1.5 SOD和MDA检测 认知功能评价后处死动物,迅速取脑,冷盐水冲洗去除血液和杂质。分离海马和皮质组织称重,用生理盐水分别制成10%组织匀浆。组织匀浆经4000g离心10min,取上清用于检测。SOD和MDA的检测严格按照试剂盒说明操作。
1.6 免疫组化检测Bcl-2 认知功能评价后麻醉动物,经左心室插管,灌流生理盐水和4%多聚甲醛。取脑,取视交叉前后2mm冠状切片置于4%多聚甲醛溶液固定,常规石蜡包埋切片,经HE染色,光学显微镜观察。采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连结法(SP法)检测石蜡包埋切片中Bcl-2的表达。方法如下:石蜡切片经常规处理,经内源性过氧化物酶阻断和抗原修复后滴加兔抗大鼠Bcl-2单克隆抗体(一抗),4℃孵育过夜。次日滴加PV-6001(二抗),室温下孵育20min,经DAB显色,脱水,透明,封片。采用“双盲法”在光学显微镜下观察。
1.7 统计学评价 Morris水迷宫评价和生化分析结果用均数±标准差表示。应用SPSS13.0统计软件系统作数据处理分析,统计分析方法为单因素方差分析(ANOVA),P<0.05差异具有统计学意义。免疫组织化学结果判断标准:在×400放大倍数下,每张切片随机选取10个视野,胞浆或胞核染成棕黄色为阳性。阳性细胞着色判断(A):<5%为0分;5% ~25%为1分;26% ~50%为2分;>50%为3分。阳性强度(B):无着色或与背景均匀一致的淡黄色为0分;浅棕黄色为1分;棕黄色为2分;棕褐色为3分。根据两项指标的积分数(积分=A×B)进行计分,2~3分为弱阳性(+);4~6分为阳性();7~9分为强阳性()。
2 结果
2.1 认知功能评价 定向航行试验中,随着训练时间延长各组大鼠的逃逸潜伏期均逐渐缩短。第5天各组大鼠逃逸潜伏期结果S组10.25±3.91,E+S组 13.65 ±4.24;L 组 77.71 ± 6.72,E+L 组29.08±4.52。L组比 S组潜伏期显著延长(P<0.05);E+L组比L组潜伏期显著缩短(P<0.05);S组与E+S组比较结果无统计学意义(P>0.05)(见图1)。空间探索试验中,各组大鼠目标象限停留时间为 S组33.62 ±6.98,E+S组32.69 ±5.93;L组22.4 ±5.03,E+L 组32.89 ±6.21。L 组比 S组时间显著减少(P<0.05);E+L组比L组时间显著增加(P<0.05);S组与E+S组比较结果无统计学意义(P >0.05)(见图2)。
2.2 SOD和MDA检测 L组大鼠海马和皮质SOD含量比S组显著减少(P<0.05);E+L组大鼠海马和皮质SOD含量比L组显著增加(P<0.05)。L组大鼠海马和皮质MDA含量比S组显著增加(P<0.05);E+L组大鼠海马和皮质MDA含量比L组显著减少(P<0.05)。S组和E+S组的海马和皮质SOD和MDA含量分别比较差异均无统计学意义(P >0.05)(见表1)。
2.3 Bcl-2免疫组化检测结果 L组(42%)海马的表达阳性率低于S组(92%),差异有统计学意义(P<0.05)。E+L组(75%)海马的表达阳性率高于 L组,差异有统计学意义(P<0.05)。L组(33%)皮质的表达阳性率低于S组(92%),差异有统计学意义(P<0.05)。E+L组(67%)皮质的表达阳性率高于L组,差异有统计学意义(P<0.05)(见表2)(见图3)。
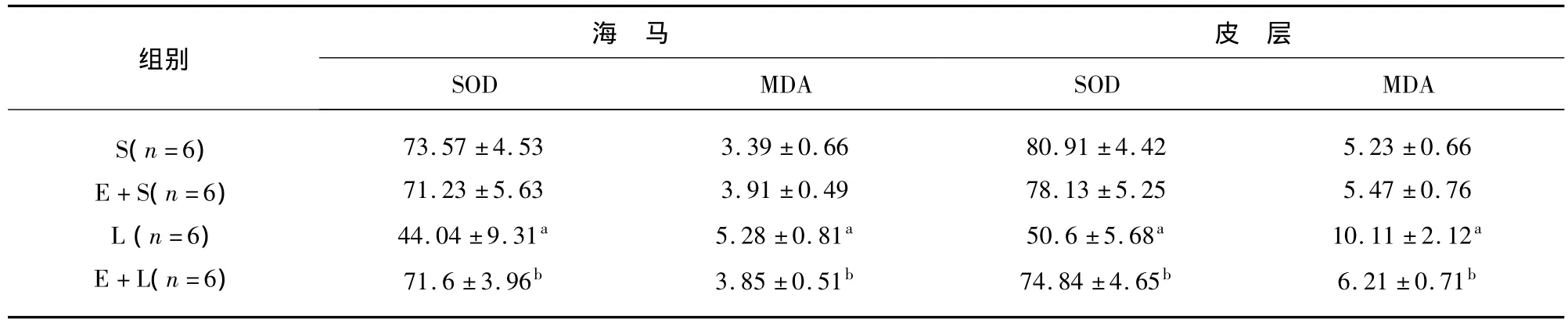
表1 各组大鼠海马和皮质SOD、MDA、GSH含量比较

表2 海马齿状回和皮质颗粒细胞不同组间Bcl-2表达
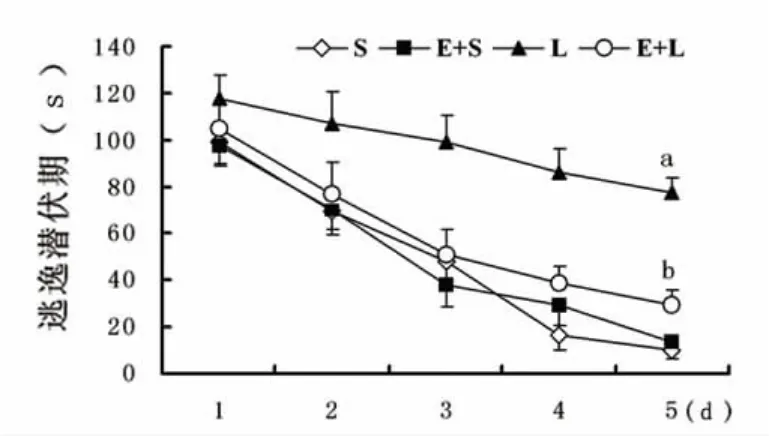
图1 Morris水迷宫各组大鼠逃逸潜伏期比较

图2 Morris水迷宫各组大鼠目标象限停留下时间比较
3 讨论
氧化应激是包括AD在内的多种随年龄进展和年龄相关的神经系统退行性疾病发生发展的重要原因[5]。氧自由基能够引起蛋白质、脂质、糖类、核酸等生物活性分子的氧化修饰,使细胞原有的结构和功能丧失,使多种生物酶失活,最终引起细胞凋亡[6]。对抗氧化应激过程中,脑组织会代偿性地加速Aβ生成[7],氧化应激还可诱导 tau蛋白的磷酸化[8]。这些改变均能引起不同程度的神经损伤,引起认知功能的下降,促进AD的进展。
有研究表明ICV-STZ能够引起大鼠学习记忆能力下降,其原因是大鼠脑内氧化应激增强、胆碱乙酰基转移酶活性降低、能量代谢障碍和tau蛋白生成增加等[9]。本实验观察到ICV-STZ引起大鼠学习和记忆能力显著下降,大鼠脑内SOD含量显著下降,MDA的含量显著增加。SOD是体内重要的抗氧化酶,能够清除自由基,具有抗氧化应激损伤的作用。MDA是体内自由基对不饱和脂肪酸引发的脂质过氧化反应的分解产物,其含量的多少可间接反应脂质过氧化水平的高低和对细胞的损伤程度。本研究结果进一步证实ICV-STZ引起脑内氧化应激增强是大鼠认知功能下降的重要原因。
依达拉奉是一种新型强力自由基清除剂。在以往的研究中,依达拉奉做为一种神经保护剂常用于缺血和出血性脑血管病的治疗,显示了较好的疗效。近年来,一些研究针对依达拉奉对非脑血管病的神经系统疾病的预防和治疗作用进行了探索。Anuj等研究证明依达拉奉能够改善糖尿病周围神经病大鼠的神经传导速度和坐骨神经的氧化应激水平[10]。最近有研究证明依达拉奉对PrP106-126损伤的PC12细胞有保护作用,进而推测依达拉奉可能对神经系统退行性疾病具有预防和治疗作用[11]。本研究应用依达拉奉干预STZ诱导的AD模型大鼠,结果表明依达拉奉能够显著改善AD模型大鼠的认知功能,逆转了STZ引发的大鼠脑内SOD减少和MDA增加。以往研究表明凋亡在AD的发生发展中起重要作用。凋亡的刺激因素包括氧化应激、能量代谢障碍、线粒体功能失调、Aβ沉积、DNA损伤等[12]。在AD患者的脑组织中已经发现Bcl-2家族和caspase家族凋亡相关蛋白表达严重失衡[13]。Bcl-2是抗凋亡蛋白的重要成员之一,Katare等发现依达拉奉能够上调缺血再灌注损伤大鼠心肌组织的Bcl-2表达以对抗氧化应激损伤,减少细胞凋亡[14]。本研究中STZ诱导的AD模型组大鼠海马和皮质脑组织Bcl-2表达显著减少。依达拉奉预处理抑制了大鼠脑组织Bcl-2表达减少,从而减少了STZ诱发的神经细胞的凋亡。
目前,包括AD在内的多种神经退行性疾病尚无有效的预防和治疗方法。依达拉奉作为一种新型自由基清除剂其对神经退行性疾病的防治作用正逐渐被人们认识。本研究结果提示依达拉奉能够保护AD模型大鼠的认知功能损害,其作用可能是通过抑制氧化应激损伤、减少神经细胞凋亡实现的。该结果为自由基清除剂应用于AD等神经退行性疾病的防治提供了理论依据。然而,依达拉奉的这种保护作用是否存在其他的机制尚有待进一步研究。
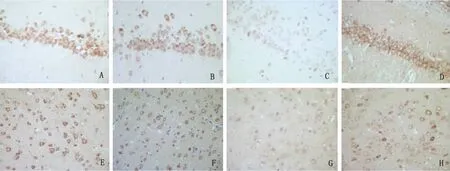
图3 海马齿状回和皮质颗粒细胞不同组间Bcl-2表达
[1] Weiss EM,Kohler CG,Vonbank J,et al.Impairment in emotion recognition abilities in patients with mild cognitive impairment,early and moderate Alzheimer disease compared with healthy comparison subjects[J].Am JGeriatr Psychiatry,2008,16(12):974 -980.
[2] Johnson DK,Storandt M,Morris JC,et al.Cognitive profiles in dementia:Alzheimer disease vs.healthy brain aging[J].Neurology,2008,71(22):1783-1789.
[3] Sharma M,Gupta YK.Chronic treatment with trans resveratrol prevents intracerebroventricular streptozotocin induced cognitive impairment and oxidative stress in rats[J].Life Sci,2002,71(21):2489 -2498.
[4] Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].J NeurosciMethods,1984,11(1):47 -60.
[5] Liu R,Liu I,Bi X,et al.Reversal of age-related learning deficits and brain oxidative stress in mice with superoxide dismutase/catalase mimetics[J].Proc Natl Acad Sci U SA,2003,100(14):8526 -8531.
[6] Ishrat T,Parveen K,Khan MM,et al.Selenium prevents cognitive decline and oxidative damage in rat model of streptozotocin-induced experimental dementia of Alzheimer's type[J].Brain Res,2009,1281:117 -127.
[7] Lee HG,Casadesus G,Zhu X,et al.Challenging the amyloid cascade hypothesis senile plaques and amyloid-beta as protective adaptations to Alzheimer disease[J].Ann N Y Acad Sci,2004,1019:1 -4.
[8] Su B,Wang X,Lee HG,et al.Chronic oxidative stress causes increased tau phoshporylation in M17 neuroblastom a cell[J].Neurosci Lett,2010,1468(3):267 -271.
[9] Prickaerts J,Fahrig T,Blokland A.Cognitive performance and biochemical markers in septum,hippocampus and striatum of rats after an i.c.v.injection of streptozotocin:a correlation analysis[J].Behav Brain Res,1999,102(1 ~2):73 -88.
[10] Saini AK,Kumar HSA,Sharma SS.Preventive and curative effect of edaravone on nerve functions and oxidative stress in experimental diabetic neuropathy[J].Eur J Pharmacol,2007,568(1 ~3):164 -172.
[11] Pan YH,Wang YC,Zhang LM,et al.Protective Effect of Edaravone against PrP106-126 Induced PC12 Cell Death[J].J Biochem Mol Toxicol,2010,24(4):235-241.
[12] Mattson MP,Magnus T.Ageing and neuronal vulnerability[J].Nat Rev Neurosci,2006,7(4):278 -294.
[13] Calissano P,Matrone C,Amadoro G.Apoptosis and in vitro Alzheimer disease neuronal models[J].Commun Integr Biol,2009,2(2):163 -169.
[14] Rajesh KG,Sasaguri S,Suzuki R,et al.Antioxidant MCI-186 inhibits mitochondrial permeability transition poreand upregulates Bcl-2 expression[J].Am JPhysiol Heart Circ Physiol,2003,285(5):2171 -2178.
