直肠间质瘤的临床分析
2011-08-23廖信芳杨清水朱应昌
廖信芳,杨清水,朱应昌
(南方医科大学附属南海医院普外科,广东 佛山 528200)
胃肠间质瘤(gastrointestinal stromal tumors,GIST)是一种发生于消化道的间叶肿瘤。以胃、小肠多见,发生于直肠的相对较少,约占5%[1]。本研究对南方医科大学附属南海医院普外科1998年1月至2010年12月收治资料完整的15例直肠间质瘤患者的临床资料进行回顾性分析,探讨直肠间质瘤的诊断及治疗特点。
1 资料与方法
1.1 一般资料
选择在本科治疗的直肠间质瘤患者15例,男11例,女4例,年龄35~69岁,平均52岁。肿瘤直径为1.1~12.6cm。其中肿瘤位于直肠返折以上部4例,直肠返折以下部11例;肿瘤下缘距肛缘0.8~12cm,平均4.9cm。主要临床表现:便血5例,大便次数增多伴有不同程度排便困难8例,肛周疼痛1例,肠梗阻1例。病程15d~20个月,平均3个月。直肠指诊确诊11例。
1.2 辅助检查
15例患者均行盆腔CT检查示:肿瘤位于直肠后壁或侧后壁者10例,位于直肠前壁或前侧壁者5例;直肠受压移位、管腔狭窄者3例,肿物边界尚清楚9例,与双侧肛提肌分界不清者1例,侵犯子宫颈及阴道后壁者1例,侵犯膀胱者1例,均无明显肿大淋巴结。结肠镜检查示:肿物均位于黏膜下,表面黏膜不同程度的糜烂或有肠腔狭窄。术前病理均报告为黏膜慢性炎。胸部X线片及B超检查未发现远处转移。行Miles术的患者术中均行冰冻检查提示恶性肿瘤。所有患者肿瘤标记物(CEA、CA19-9)检测均正常。15例直肠间质瘤患者的临床资料见表1。
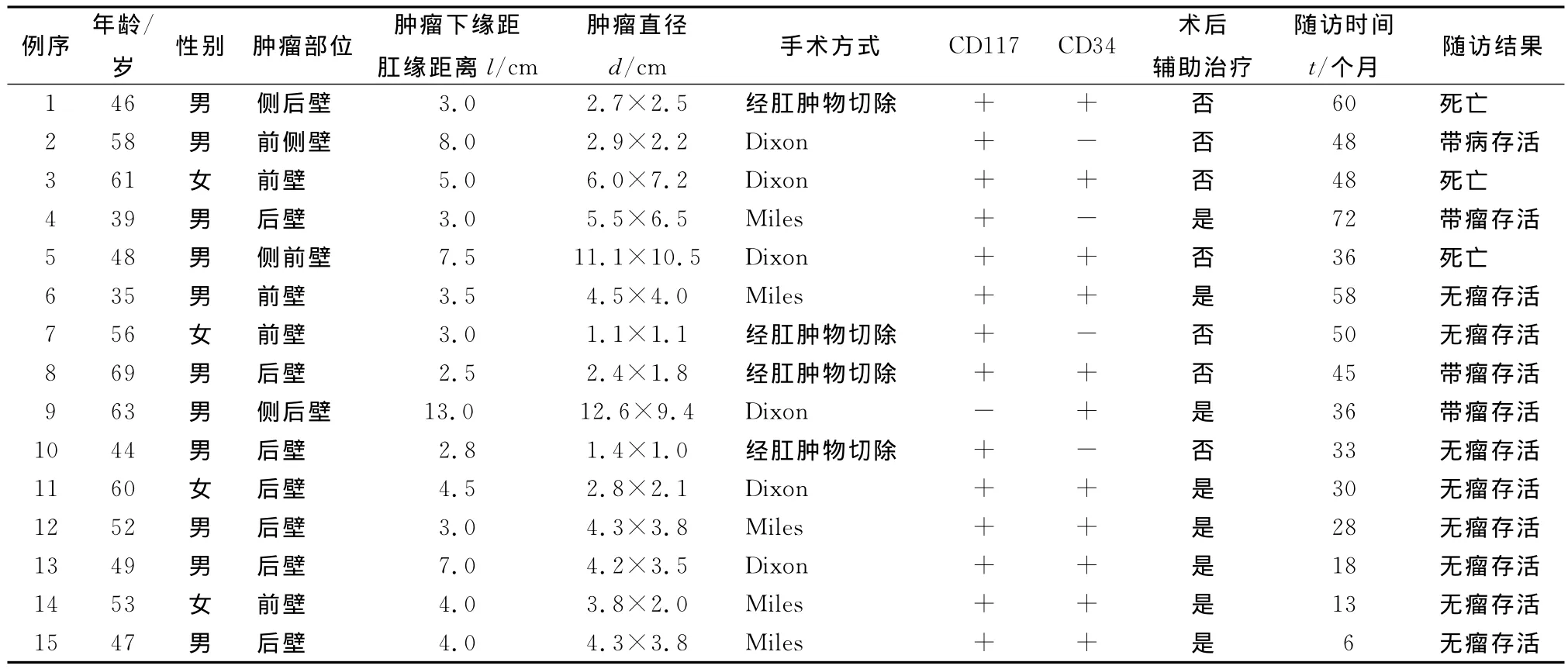
表1 15例直肠间质瘤患者的临床资料
1.3 治疗方法
1.3.1 手术治疗
15例患者均施行手术治疗:行直肠低位前切除术(Dixon)6例,直肠腹会阴联合切除术(Miles)5例(含子宫、阴道后壁、直肠部分切除1例,膀胱和前列腺、直肠切除1例),经肛门肿物切除术4例,其中2例因复发转移行2次手术。
1.3.2 靶向治疗
8例患者行靶向药物治疗。其中4例首次术后以靶向药物伊马替尼400mg·d-1辅助治疗,服药疗程为5~36个月;2例术后局部复发多次手术后继续以伊马替尼辅助治疗;2例术后肝转移服用伊马替尼400mg·d-1辅助治疗。
2 结果
手术标本中肿瘤直径为1.1~12.6cm,其中<2.0cm者2例,≥2.0~5.0cm者9例,5.1~10.0 cm者2例,>10.0cm者2例。免疫组化结果:酪氨酸激酶受体(CD117)阳性14例(93.3.0%),造血干细胞抗原(CD34)阳性11例(73.3%)。手术标本淋巴结转移均为阴性。按改良美国国立卫生研究院(NIH)的间质瘤危险度分级[2]标准:高危险度肿瘤4例,中危险度3例,低危险度6例,极低度恶性2例。15例患者随访时间6~72个月,平均38个月。2例患者分别术后12、26个月局部复发再次行手术切除,术后口服伊马替尼400mg·d-1辅助治疗;5例经腹前切除或经肛局部切除患者出现腹腔复发并肝多发转移,其中3例死亡;2例服用伊马替尼治疗后肿瘤缩小,带瘤生存;其余6例患者无复发、转移。
3 讨论
3.1 直肠间质瘤的诊断
直肠间质瘤早期无典型症状,因肿瘤位于黏膜下,结肠镜检查多不能取得病理,其诊断主要依靠影像学检查。本研究中患者的影像学检查以CT诊断为主,其CT的特征性表现为直肠腔内壁黏膜完整,肿瘤位于黏膜下或向腔外生长。其确诊主要依靠病理及免疫组化染色检查。在光镜下呈梭形细胞结构,有时伴上皮样细胞。免疫组化染色最具诊断价值的是CD117表达阳性,直肠间质瘤的CD117阳性率为95%~100%,具有很好的特异性[3]。CD34在直肠间质瘤中阳性率高达80%以上[3],在CD117表达阴性时其表达阳性对直肠间质瘤的诊断具有重要意义。作为排除组织上皮来源的Vimentin(波形蛋白),在直肠间质瘤中有近100%的阳性率,如其阴性基本排除直肠间质瘤的诊断。但GIST恶性程度与肿瘤原发灶大小、细胞核分裂相有关,而与免疫组化无关[4]。本研究CD117阳性14例(93.3%),CD34阳性11例(73.3%)。
3.2 直肠间质瘤的治疗
目前,直肠间质瘤的治疗原则是外科手术结合分子靶向治疗的综合治疗。手术治疗仍是最主要的方法,包括原发和复发转移的病例[5]。由于本病淋巴结转移非常少见,可不必常规行淋巴结清扫。手术方式主要有肿瘤局部切除、肿瘤所在器官切除、联合脏器切除等。手术方式选择主要根据肿瘤的大小、离肛缘距离、与邻近脏器的关系、患者的经济条件及对生活质量要求综合考虑。本研究中5例患者术前未取得病理结果,术中行冰冻检查考虑恶性肿瘤,因肿瘤较大,肿瘤下缘接近肛缘,为将肿物完整切除而行Miles手术。术后4例无瘤生存,1例腹腔复发者带瘤生存,因肿瘤较大且侵犯子宫、阴道后壁,行联合脏器切除。4例患者肿瘤较小距肛缘较近,经肛门局部完整切除。其中2例肿瘤>2cm者,1例死于复发并肝多发性转移;1例术后腹腔复发再次手术,后来并肝转移后一直服用伊马替尼带瘤生存。2例肿瘤<2cm者分别以无瘤生存33、50个月。复发者可能与第1次手术切除不够未达到R0切除(切缘阴性)有关。本研究6例行Dixon术者中,1例失访,2例死亡,均为高危险度、肿瘤大、患者经济条件不允许未行分子靶向治疗,死于腹腔复发并肝多发转移死亡;1例带瘤生存,患者局部复发后再次行2次手术并一直服用伊马替尼治疗;2例无瘤生存者为低危险度、肿瘤较小且局限。故首次手术争取R0切除对预后有重要意义。
对于复发或转移的GIST,即使是姑息性切除也主张再次手术切除。因GIST的侵袭性远不如其他肿瘤,且有较完整的包膜,边界相对清楚,手术切除率较高。本研究中有2例患者行再次手术,均获得比较满意的效果。
伊马替尼是选择性酪氨酸蛋白激酶抑制剂,通过阻断c-kit介导的信号传导通路而选择性地抑制GIST生长。该药能显著提高患者的生存率,其有效率超过80%。它有助于控制中高危患者的复发和转移,尤其是不能手术切除或发生远处转移的GIST患者的标准治疗[6]。本研究中2例患者术后复发,应用伊马替尼治疗后均部分缓解,带瘤生存。
[1] Kitamura Y.Gastrointestinal stromal tumors:past,present,and future[J].Gastroenterol,2008,43(7):499-508.
[2] Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Hum Pathol,2008,39(10):1411-1419.
[3] Bauer S,Lang H.The challenge of opportunities:how far can and should we go with targeted treatments and modern diagnostics in gastrointestinal stromal tumors?[J].Eur J Gastroenterol Hepatol,2007,19(8):619-622.
[4] Rubin B P,Fletcher J A,Fletcher C D.Molecular in sights into the histogenesis and pathogenesis of gastrointestinalstromal tumors[J].Int J Surg Pathol,2000,8(1):5-10.
[5] Hassan I,You Y N,Shyyan R,et al.Surgically managed gastrointestinal stromal tumors:a comparative and prognostican alysis[J].Ann Surg Oncol,2008,15(1):52-59.
[6] Hueman M T,Schulick R D.Management of gastrointestinal stromaltumors[J].Surg Clin North Am,2008,88(3):599-614.
