分子信标实时荧光定量PCR构绵羊PrP基因质粒和标准曲线
2011-08-21李发弟刁小龙赵春林
王 川,吴 润,李发弟,刁小龙,赵春林,王 芳
2.甘肃农业大学 动物科学技术学院,甘肃 730070;
3.甘肃中医学院,甘肃 730070
传染性海绵状脑病(T ransmissible spongiform encephalopathies,TSEs)是由朊蛋白引起的人和动物的一组具有共同特征的慢性、渐进性及致死性中枢神经系统(CNS)疾病,主要包括人克雅氏病(CJD)和格斯综合征(GSS)、疯牛病(BSE)、羊痒病(Scrapie)和鹿慢性消耗性疾病(CWD)等[1]。朊蛋白(Prion protein,PrP)是由一种不含核酸仅由修饰蛋白组成的传染性颗粒(PrPSc),正常的细胞型PrP(PrPC)经过一个转译后过程获得高含量的β-折叠而转变成PrPSc,这类特殊的朊蛋白是由哺乳动物正常染色体上的PrP基因所编码[2]。PrPC与PrPSc氨基酸序列虽然完全一致,但二者构象不同。当宿主受PrPSc感染时,PrPC的一些α-螺旋转变为β-片层,PrPC蛋白发生错误折叠,使其三维构象改变而引起致病性PrPSc的产生而发病[2-3]。PrPC对蛋白激酶K(PK)的消化作用很敏感,PrPSc对PK的消化作用较耐受[4],正常的朊蛋白(PrPC)不能引起神经退行性病变,虽然目前已经对许多组织的PrPm RNA行了检测,但是对它的生物学功能还知之甚少,对PrP基因表达的机制尚不清楚。研究显示:不同组织细胞朊蛋白的表达程度差异很大,在绵羊中枢神经系统和外周器官[5],牛的神经组织和淋巴结[6],金黄地鼠[7],绵羊大脑[3]以及鸡的脑组织和其它器官[8-9]中的研究发现PrPm RNA在中枢神经系统和淋巴组织中有高表达,目前的研究中,对胃肠道PrP mRNA的表达水平尚未有阐述,鉴于此,检测消化道中PrPmRNA的表达量对经口部途径感染时了解朊蛋白进入胃肠道时发生了什么以及朊病毒在机体传播的途径是什么非常重要。
实时荧光定量PCR是一种可精准定量m RNA表达水平的方法,目前该方法已被广泛应用于各个领域的基因 mRNA表达水平研究,在朊病毒研究领域该方法也被大量应用[5,10-12]。为了研究消化道中PrPm RNA的表达量表达水平在朊病毒机体传播途径中的作用,本文构建了分子信标荧光定量PCR方法检测PrP基因的表达标准质粒及标准曲线,为阐释羊痒病发生的分子机理奠定基础,从而为进一步研究朊蛋白疾病的发病机理提供有力的工具。
1 材料和方法
1.1 材料
1.1.1 组织样 选取3-4岁的雌性绵羊各四只,屠杀后分别采取大脑、小脑、脑干、丘脑、脊髓、舌、扁桃体、食管上皮、咽上皮、心、肝、脾、肺、肾、胰腺、瘤胃上皮、小肠上皮、直肠上皮、盲肠上皮、十二指肠上皮、回肠上皮、结肠上皮、空肠上皮、腹股沟淋巴结、肠淋巴结组织、下颌淋巴结、卵巢和子宫,样品立即放入液氮中2h,然后转入到-86℃超低温冰箱内。
1.1.2 主要试剂和仪器 TRIZOL(Invitrogen公司)、反转录酶SSⅢ(Invitrogen)、2×QuantiFast Probe PCR master M ix(Q IAGEN)、质粒快速提取试剂盒(Qiagen)、琼脂糖提取试剂盒(博大泰克),pGEM T-Easy Vector Systems(Promega),Prem ix Taq酶、dNTP、RNASEOUT Ribonuclease和DNase-I(TaKaRa),M yCyclerTM Thermal Cycler EN-61010(BIO-RDA laboratories,U.S.A),荧光定量 PCR仪MX3005P(Stratagene)、核酸蛋白检测仪 GeneQuant 1300(GE,USA),GL-20G-Ⅱ型冷冻离心机。
1.2 方法
1.2.1 RNA提取 称取 100mg肝脏组织,用 TRIZOL RNA提取试剂盒按照文献[13]进行。提取的RNA用30μL DEPC处理的灭菌三蒸水溶解,-86℃保存备用。
1.2.2 组织总RNA的RT-PCR
1.2.2.1 引物设计 参照GenBank注册的绵羊朊蛋白基因 序 列 AF195247、 AJ567986、AY350273、 AY350275、DQ 149332、DQ149443、DQ 149446、DQ 149481、 DQ149483、DQ149484、DQ149485、DQ149486 和 DQ149487,进行序列比对后用Primer Prem ier 5.0在绵羊PrP完整开放阅读框(ORF)内针对包含136、154和171密码子的片段设计引物。引物由Invitrogen公司合成。
上游引物 5′-AGCTGGAGCAGTGGTAGGG-3′
下游引物 5′-CATTATCTTGATGTCAGTTTCG-3′
上游引物位于PrP开放阅读框+360~+378位,下游引物位于+606~+627位,预计可扩增PrP开放阅读框+360~+627位约为268bp的目的DNA片段。
1.2.2.2 反转录合成 cDNA 取总 RNA(1μg/μL)2μL,加入O ligo(dT)18(50μmol/L)2μL、dNTPM ixture(10mmo l/L)2μL、DEPC处理灭菌三蒸水 7μL,瞬时离心后 65℃5min,冰浴 5min,然后加入 5×First-Strand Buffer 2μL,0.1mo l/L DTT 1μL,RNase 抑制剂(40U/μL)1μL,Super-ScriptTM Ⅲ Reverse Transcriptase(200 U/μL)1μL,DEPC处理灭菌三蒸水2μL,吹打混匀,瞬时离心后于 PCR仪上55℃1h,然后置70℃15m in终止反应。
1.2.2.3 RT-PCR 总体积 50μL,其中 Premix Taq 25.0μL 、cDNA 1.0μL、上下游引物各 1.0μL(10 pmo l/L)、ddH2O 22.0μL。反应条件为:94℃预变性 5 min;94℃30s、60℃30s、72℃ 30s,共 35个循环;72℃延伸 5m in。 PCR 扩增产物经1.5%L琼脂糖凝胶电泳检测。1.2.3 重组标准品质粒制备
1.2.3.1 PCR产物纯化与载体连接、转化 割胶后按照博大泰克胶回收试剂盒说明对PCR扩增片段进行纯化、回收。按照PGEM T-Easy Vector Systems试剂盒的说明书将纯化产物与 PGEM T-easy载体连接,连接体系为10μL,其反应组分为:PGEM T-Easy Vector(50ng/5μL)、PCR纯化产物1.5μL、T4 DNA 连接酶 1.0μL、灭菌三蒸水1.5μL,同时设定阴性和阳性对照。将连接体系置于4℃冰箱中过夜后加入到200μL感受态大肠杆菌DH 5α中热击转化后,加入Amp-LB液体培养基活化1h,低速离心后涂于Amp+、XGal和IPTG处理的LB琼脂平板上,37℃过夜培养后置4℃冰箱中4h。挑取单菌落白斑,在含有Am p的LB液体培养基37℃、200r/m in振荡过夜培养。
1.2.3.2 重组质粒的提取和鉴定 按照质粒快速提取试剂盒的操作要求提取质粒,对提取的质粒DNA进行重组质粒PCR、酶切和PCR-SSCP分析,挑取阳性克隆测序。利用BioEdit软件对序列分析,挑取ARQ质粒。
1.2.3.3 实时定量RT-PCR引物和探针设计 根据测序结果设计了引物和分子信标探针:
上游引物 :5′-TTTTGGCAATGACTATGAGGAC-3′
下游引物 :5′-CATTA TCTTGATGTCAGTTTCGG-3′分子信标探针:
5′FAM-CAGCGAACCAGAACAACTTTGTGCATGACTGTGCGCTG-dabcyl 3′。
1.2.3.4 重组质粒定量标准曲线的建立 测定阳性重组质粒的OD值,计算出拷贝数。将标准品重组质粒进行10倍系列稀释,以系列稀释的质粒为模板在MX3005P型实时荧光PCR仪上扩增。反应体系为 25μL,反应组分为:2×QuantiFast Probe PCR master M ix(QIAGEN)12.5μL,上下游引物各1.0μL(10pmol/L),分子信标 0.8μL(10pmol/L),质粒 DNA 1.0μL,水 8.7μL;反应条件 95℃预变性 2 min;94℃ 15s、51℃45s、72℃30s,共 40个循环,在退火后期收集荧光值。反应结束后,计算机自动得到标准曲线。
2 结 果
2.1 组织 RNA提取和目的基因片段的扩增 组织提取的总 RNA紫外分光OD260/OD280为1.8~2.0之间,电泳结果表明 RNA分子保持完整。经RT-PCR扩增,产物用1.5%琼脂糖凝胶电泳,获得大约200 bp左右的目的条带。序列测定表明,获得的目的条带同原始序列的同源性为100%。
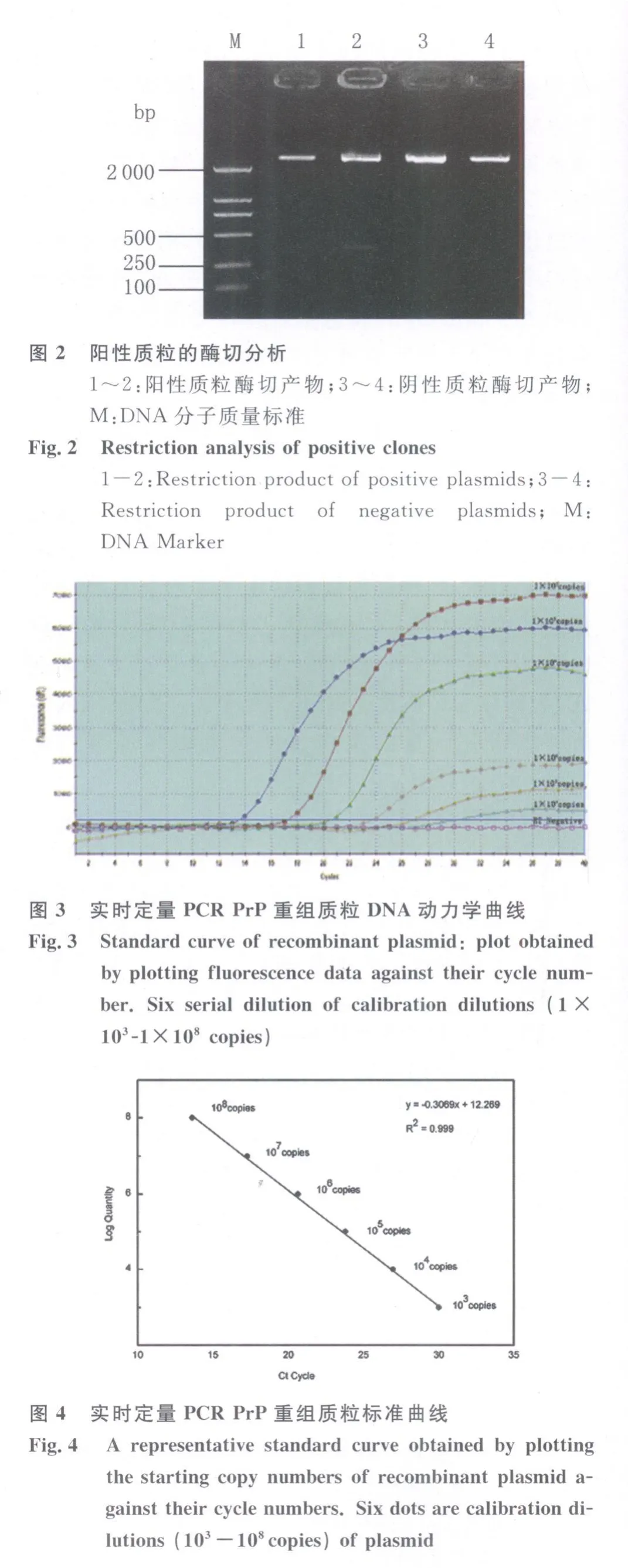
2.2 标准模板的鉴定 对提取的质粒进行Eco RⅠ酶切,在pGEM T-Easy载体插入片段的两侧均有Eco R Ⅰ酶切位点,经酶切后,目的基因含插入片段的大小为 268 bp(图 3-1和图 3-2)。对质粒DNA进行 PCR-SSCP分析[14],对质粒 DNA进行序列测定后,用bioedit软件分析测序结果,挑选出ARQ质粒,标准质粒构建成功。
2.3 定量标准曲线的构建 将重组标准品质粒测OD值定量后,对此质粒10倍系列稀释,进行实时荧光定量PCR扩增反应,反应结束后系统根据荧光值的变化规律,自动生成起始模板数扩增反应的动力学曲线,见图3。

图1 阳性克隆的PCR鉴定1~4:阳性质粒 PCR扩增产物;5~6:阴性质粒 PCR扩增产物;M:DNA分子质量标准Fig.1 PCR identification of positive clones1-4:PCR p roduct o f positive p lasm ids;5-6:PCR product of negative p lasm ids;M:DNA Marker
2.4 标准回归曲线的建立和回归方程的设定 对重组质粒10倍倍比稀释,实时荧光定量PCR扩增后,根据荧光值的变化规律,通过基线设定,系统自动生成。由回归曲线看出,起始模板浓度与Ct值之间呈良好的线性关系,该标准曲线检测的灵敏度为108~103个模板;通过对其回归曲线进行分析,发现其相关性良好,相关系数r2=0.999,系统生成的回归方程为:y=-0.3069x+12.269(图4)。
3 讨 论
实时荧光定量PCR可以通过标准曲线对未知模板进行定量分析[15-16],实现了PCR技术从定性到定量的飞跃[5]。该技术具有敏感性高、重复性好、耗时短、操作简便和无污染等优点,解决了分子医学、生物技术、微生物和诊断方面的 m RNA表达水平定量问题,因此成为人们基因定量检测的首选方法[17]。分子信标技术是一种呈发夹结构的茎环状双标记寡核苷酸探针,环部与靶 DNA序列互补,为15~35 bp茎部是由互相配对的碱基组成,但与靶DNA 无序列同源性,约 8 bp在探针的5′端和 3′端分别标记荧光发射基团和荧光淬灭基团,当溶液中的模板与分子信标结合配对时,分子信标的构象改变成链状使得荧光发射基团与淬灭基团分开,当荧光基团被激发时,就发出荧光信号,与探针互补的靶分子数量越多,荧光信号也就越强,从而实现了对目的基因的定量检测[18]。
本研究中,用分子信标作为荧光染料对绵羊的中枢神经系统、外周器官和消化系统的PrP基因的表达进行定量,具有特异性强、灵敏度高和结果准确的特性,研究结果具有可比性和重复性,可用于统计学分析。本研究中的 Ct值相对固定,重复性好,以不同浓度标准品质粒DNA分别进行荧光定量PCR扩增,发现起始浓度越高,Ct值越小,即起始模板浓与Ct值之间呈良好的线性关系。利用已知起始拷贝数的标准品质粒可做出标准曲线,因此只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。本研究中,通过 10倍系列稀释标准品质粒浓度所得到的Ct值绘制的标准曲线的相关系数高达0.999,能够保证数据的精确性。根据回归方程,可直接计算出各样品模板的初始含量。本实验成功构建了PrP标准曲线,为进一步测定绵羊体内各部位的PrPm RNA表达奠定了基础。
[1]Prusiner S B.Prions[J].Proc Natl Acad Sci,1998,95:13363-13383.
[2]Francoise DD,Louisa B,Frederic G,et al.Enhanced levels of scrapie responsive genem RNA in BSE-infectedm ouse brain[J].Brain ResM ol Brain Res,2000,76(1):173-9.
[3]A tsutaka K,A ito U,Yasunobu M,et al.Analy sis of p rion protein mRNA by in situ hybridization in brain and placenta of sheep[J].Biochem Biophys ResCommun.2000,273(3):890-893.
[4]Caughey BW,Dong A,Bhat KS,et al.Secondary structu reanalysis of the scrapie-associated protein P rP 27-30 in w ater by infrared spectroscopy[J].Biochem istry.1991,30(31):7672-7680.
[5]H an CX,Liu HX,Zhao DM.The quantification of prion gene exp ression in sheep using real-tim e RT-PCR[J].Virus Genes,2006;33:359-364.
[6]T ichopad A,Pfaffl MW,Didier A.Tissue-specific exp ression pattern of bovine prion gene:quantification using real-time RTPCR[J].Mol CellProbe.2003,17:5-10.
[7]Ning ZY,Zhao DM,Liu HX,et al.Quantification of prion gene exp ression in b rain and peripheral organs of golden ham ster by real-tim e RT-PCR[J].Anim al biotechnol.2005,16(1):55-65.[8]H arris DA,Lele P,SniderWD.Localization of them RNA for a chicken prion protein by in situ hybridization[J].Proc Natl Acad Sci USA,1993,90(9):4309-4313.
[9]Harris DA,Falls DL,Johnson FA,et al.A prion-like protein from chicken brain copu rifies w ith an acety lcholine receptor-inducing activity[J].Proc Natl Acad Sci USA,1991,370:295-297.
[10]杨建民,赵德明,李宁,等.PrPC重组蛋白脑内接种金黄地鼠对mRNA表达的影响[J].中国农业大学学报,2005,10(6):27-32.
[11]宁章勇,赵德明,杨建民,等.实时荧光定量 PCR检测 PrP基因表达标准品质粒和标准曲线的构建[J].中国兽医学报,2005,25(6):611-613.
[12]刘爱玲,周向梅,杨鸣琦,等.实时荧光定量PCR构建朊病相关细胞因子标准品质粒和标准曲线[J].动物医学进展,2010,31(6):11-14.
[13]W alker N J.Real-time and quan titative PCR:applications to mechanism-based toxicology[J].JBiochem Mol Toxicol,2001,15(3):121-127.
[14]Chom czynski P,SacchiN.Single-stepmethod of RNA isolation by acid guanidinium thiocyanate-phenol-ch lor-oform extraction[J].Anal Biochem,1997,162:156-159.
[15]赵春林,王川,吴润,等.绵羊PRNP等位基因 PCR-SSCP分析条件的优化[J].中国兽医科学,2008,38(08):721-727.
[16]Ginzinger D G.Gene quantification using real-time quantitative PCR:An emerging technology hit s t hemainst ream[J].Ex p H ematol,2002,30:5032512.
[17]Schm it tgen T D,Zakrajsek B A,M ills A G,et al.Quantitative reverset ranscription-polym erase chain reaction to study mRNA decay:comparison ofendpoint and real-timemet hods[J].Analy Biochem,2000,285:1942204.
[18]Bustin SA,Benes V,Nolan T,et al.Quan titative real-time RTPCR:a perspective[J].J M ol Endocrinol,2005,34(3):597-601.
[19]朱捷,杨成君,王军.荧光定量 PCR技术及其在科研中的应用[J].生物技术通报,2009(2):73-76.
