70例结内弥漫大B细胞淋巴瘤的临床特征、免疫亚型与预后分析
2011-08-14双跃荣黃晖李午平黄燕
双跃荣 黃晖 李午平 黄燕
江西省肿瘤医院内科,江西 南昌 330029
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是恶性淋巴瘤中最常见的一型[1],临床病理学具有高度的异质性。利妥昔单抗联合CHOP(R-CHOP)免疫化疗可以治愈60%~70%的患者,但仍有部分DLBCL患者对治疗反应差,易复发或进展,预后不佳[2-3]。国际预后指标(international prognostic index,IPI)是DLBCL重要的预后指标,但并不能完全反映肿瘤的分子生物学本质[4]。采用免疫组化法染色将DLBCL,分为生发中心B细胞样亚型(germinal centre B-cell lymphoma,GCB)和非生发中心亚型(non-germinal centre B-cell lymphoma,non-GCB)。本文收集了本院诊断治疗的DLBCL,回顾性分析各临床特征、IPI及免疫亚型等因素对DLBCL预后的影响。
1 资料和方法
1.1 临床资料
收集本院2003年—2009年住院诊治的原发于淋巴结内的DLBCL、并有完整临床病理资料和随访记录的患者70例。所有患者均经病理确诊,分类按照WHO淋巴肿瘤分类标准,临床分期采用Ann Arbor标准。IPI评分根据年龄、血清乳酸脱氢酶(LDH)、一般状况(ECOG)、临床分期和结外侵犯5个因素进行。70例淋巴结内DLBCL患者,其中男性43例,女性27例;中位年龄49岁(15~83岁),≥60岁者22例,<60岁者48例。初治58例;复治12例。Ann Arbor临床分期:I~Ⅱ期46例,Ⅲ期24例;ECOG评分:0~1分51例(72.8%),2~4分19例(27.1%);LDH正常40例(57.1%),升高30例(42.9%);全身症状(B症状) 23例(32.9%);IPI评分0~1分22例(31.4%),2分26例(37.1%),3分13例(18.6%),4~5分9例(12.6%)。
1.2 免疫亚型
对70例患者的组织标本采用免疫组织化学染色,检测CD10、BCL-6、MUM-1的表达。参照Hans等[5]报道的模型将患者分为GCB和non-GCB两类免疫亚型。CD10+或CD10-、BCL-6+、MUM-1-归入GCB亚型,CD10-、BCL-6-或CD10-、BCL-6+、MUM-1+则归入non-GCB亚型。本组70患者中,GCB型41例(58.6%),non-GCB型29例(41.4%)。
1.3 治疗方案
70例患者根据接受的治疗方案分为两组。化疗组患者接受CHOP(或CHOP样)方案治疗38例(54.3%);免疫化疗组患者接受R-CHOP方案治疗32例(45.7%),两组中各有8例患者化疗后局部放疗。CHOP方案:CTX 750 mg/m2,静脉注射,第1天;THP 50 mg/m2,静脉注射,第1天;VCR 1.4 mg/m2,静脉注射,第1天;PDN 60 mg/m2,口服,第1~5天。R-CHOP方案:利妥昔单抗375 mg/m2,静脉滴注,第1天;第2天开始CHOP方案。以上化疗方案每3周重复1次,共6次。化疗组38例中GCB型24例(63.1%),non-GCB型14例(36.9%);免疫化疗组32例中GCB型17例(53.1%),non-GCB型15例(46.9%),两组免疫亚型分布相近。
1.4 统计学处理
总生存期(overall survival,OS)的计算从淋巴瘤诊断确立到患者死亡或随访终止,与本病不相关的死亡算为截尾。应用SPSS 13.0统计软件分析,组间率的比较采用χ2检验;预后影响因素的单因素分析采用Kaplan-Meier法、logrank检验;多因素生存分析应用Cox回归模型。P<0.05为差异有统计学意义。
2 结 果
全组患者的5年OS为67.8%,其中化疗组患者的5年OS为58.9%,免疫化疗组为77.2%,免疫化疗组明显优于化疗组(P=0.017,图1)。
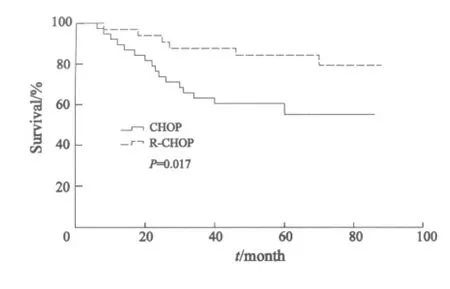
图1 化疗与免疫化疗生存曲线Fig.1 Overall survival of DLBCL patients received different therapeutic modes
70例患者免疫亚型分组:GCB型患者5年OS为73%,non-GCB型患者为55.9%,差异无统计学意义(P=0.130,图2)。

图2 免疫亚型生存曲线Fig.2 Overall survivals of different DLBCL immunological subtypes
进一步分析显示,化疗组中non-GCB型患者5年OS明显低于GCB型患者(43.5% vs 66.8%,P=0.042,图3);而免疫化疗组中non-GCB型患者5年OS 与GCB型患者差异无统计学意义(67.5% vs 80.4%,P=0.717,图4)。在non-GCB亚型中,免疫化疗组5年OS明显优于化疗组(73.3% vs 42.9%,P=0.02,图5)。
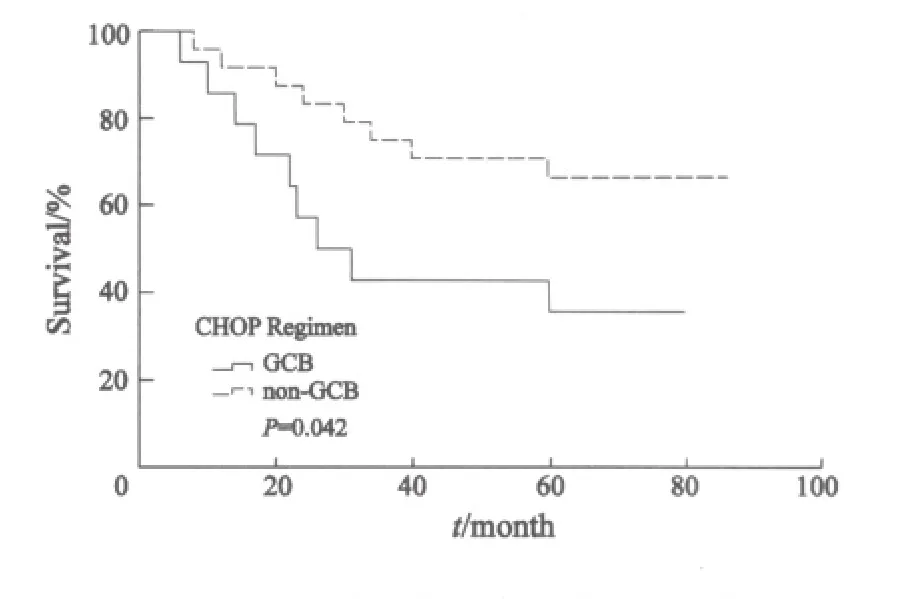
图3 化疗组两种免疫亚型生存曲线Fig.3 Overall survival of DLBCL of two immunological subtypes (GCB and non-GCB) in CHOP regimen group
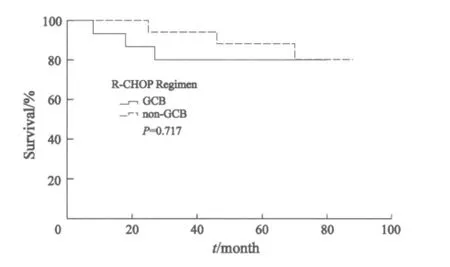
图4 免疫化疗组两种免疫亚型生存曲线Fig.4 Overall survival of DLBCL of two immunological subtypes (GCB and non-GCB) in R-CHOP regimen group
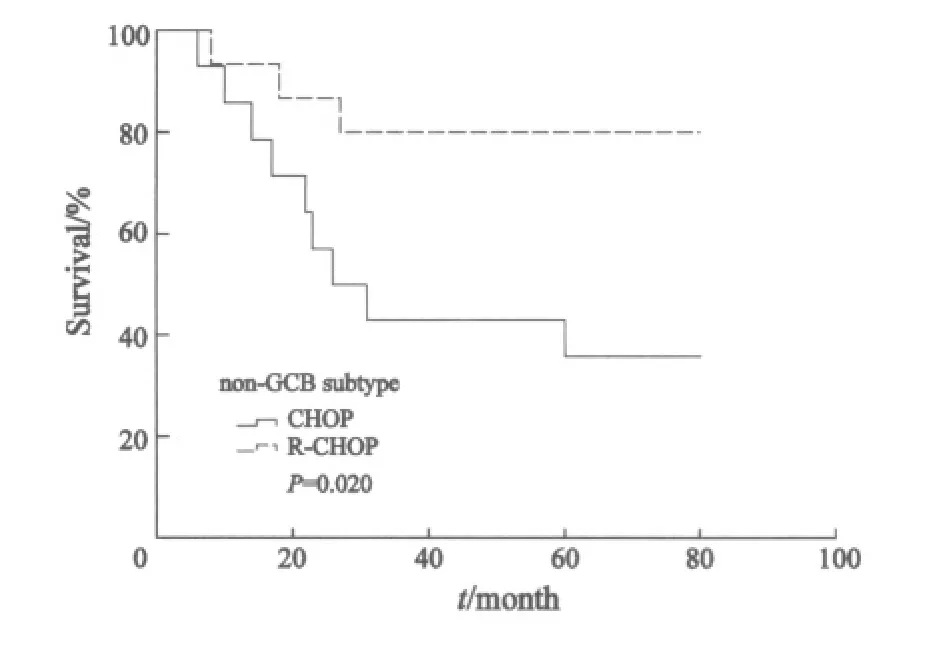
图5 non-GCB型两种治疗方案生存曲线Fig.5 Overall survival of DLBCL patients received different therapeutic modes in non-GCB subtype group
各临床因素与OS的关系:单因素分析表明年龄≥60岁、Ⅲ期、血清LDH升高、B症状和IPI≥3分均是预后不良的因素(P<0.05)。将以上与OS相关的指标代入Cox多因素回归模型分析,结果显示IPI评分对OS的影响有统计学意义(P<0.01),是独立的预后因素(表1)。

表1 临床因素与OS的关系Tab.1 Clinical characters and their effect on OS
3 讨 论
DLBCL是侵袭性淋巴瘤,免疫化疗能提高疗效。但DLBCL临床病理学上的异质性要求治疗个体化,就需要研究能指导治疗的预后因素。IPI评分系统对判断预后有一定价值,但并不能完全反映肿瘤的分子生物学本质,因而作为指导治疗、提高疗效的作用并不理想。随着基因芯片技术的运用,根据基因表达模式(GEP)的差异,可以将DLBCL分成有两种不同预后的亚型:GCB和non-GCB,GEP能更好地反映其分子生物学特性[6-7]。尽管GEP已作为新的分型标准,但价格昂贵,技术复杂,难于临床推广使用。2004年,Hans等[5]应用TMA免疫组化技术检测CDl0、BCL-6和MUM-l的表达,将152例DLBCL分成GCB型64例和non-GCB型88例,两者的5年生存率分别为76%和37%,提示GCB型预后明显优于non-GCB型。本研究的结果并没有提示GCB型预后明显优于non-GCB型。这是由于Hans研究组采用的治疗是CHOP方案,而本组46%患者采用R-CHOP治疗,利妥昔单抗可以提高non-GCB型的疗效,从而导致本组中两亚型的长期生存无明显差异。但在本研究中进一步分析发现,化疗组GCB型患者5年OS明显优于non-GCB型患者(P<0.05),说明GCB型的预后明显优于non-GCB型。因此,本研究与国内外文献报道一致[5,8-9],证明免疫组化法将DLBCL分成两种免疫亚型对于判断预后、指导治疗有重要意义。
IPI是判断DLBCL预后的重要指标[10-11]。本研究应用Cox多因素回归模型分析,结果显示IPI评分对OS的影响有统计学意义(P<0.01),是本组患者的独立预后因素。IPI评分为中、高危的DLBCL,提示预后差,采用高剂量强度化疗可延长患者的生存期。
利妥昔单抗为人鼠嵌合的抗CD20单克隆抗体。利妥昔单抗联合化疗治疗DLBCL,取得了令人满意的效果,已成为治疗DLBCL的一线标准方案[11-12]。本研究结果表明,利妥昔单抗能明显延长DLBCL的生存期。并能克服non-GCB亚型对化疗的抵抗,从而提高这部分患者的疗效。
[1] MORTON L M, WANG S S, DEVE S A , et al. Lymphoma incidence patterns by WHO subtype in United States, 1992-2001 [J]. Blood, 2006, 107(1): 265-276.
[2] FEUGIER P, VAN HOOF A, SEBBAN C, et al. Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: a study by the Groupe d’Etude des Lymphomes de l’Adulte [J]. J Clin Oncol, 2005, 23(18): 4117-4126.
[3] PFREUNDSCHUH M, TRUMPER L, PETTENGEL R, et al.CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group [J].Lancet Oncol, 2006, 7(5): 379-389.
[4] PFREUNDSCHUH M, SCHUBERT J, ZIEPERT M, et al. Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomized controlled trial (RICOVER-60)[J]. Lancet Oncol, 2008, 9(1):105-116.
[5] HANS C P, WVISENBURGER D D, GREINER T C, et al.Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray [J]. Blood, 2004, 103: 275-282.
[6] ALIZADEH A A, EISEN M B, DAVIS R E, et a1. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling [J]. Nature, 2000, 403(6769): 503-511.
[7] ROSENWALD A, WRIGHT G, CHAN W C, et a1. Lymphoma/leukemia molecular profiling project. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma [J]. N Engl J Med, 2002, 346(26):1937-1947.
[8] 杜尊国, 包芸, 唐峰, 等. 弥漫大B细胞淋巴瘤的免疫学亚型与预后的关系 [J].复旦学报(医学版), 2009, 36(3):281-287.
[9] 韩泽, 严智昌, 张彦芳. 弥漫大B细胞淋巴瘤原发部位和预后与免疫分型的相关性研究 [J]. 肿瘤预防与治疗,2009, 22(3): 254-256.
[10] 王晶, 克晓燕, 赵灵芝, 等. 74 例弥漫大B 细胞淋巴瘤的预后相关因素分析 [J]. 中华血液学杂志, 2007, 28(10):667-669.
[11] 谢彦, 朱军, 郑文, 等. 利妥昔单抗联合化疗治疗弥漫型大B细胞淋巴瘤的临床观察 [J]. 肿瘤, 2009, 29(1): 53-57.
[12] PFREUNDSCHUH M, SCHUBERT J, ZIEPERT M, et al. Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomized controlled trial (RICOVER-60)[J]. Lancet Oncol, 2008, 9(1): 105-116.
