Erufosine对胃癌细胞及骨髓细胞增殖抑制的影响
2011-08-14贺建宇张利能
贺建宇 张利能
1.上海市第六人民医院奉贤分院肿瘤科,上海 201400;2.复旦大学上海医学院生物化学与分子生物学教研室,上海 200032
烷基磷脂(alkyphosholipids,APLs)和烷基磷酸胆碱(alklphosphocholine,APCs)作为新一代膜信号PI3K/Akt传导抑制剂,已成为国内外研究的热点[1-2]。研究表明,APLs和APCs能抑制多种肿瘤细胞增殖并诱导肿瘤细胞凋亡,具有明显抑制肿瘤生长作用,其机制尚未完全阐明[3-4]。本研究将观察APCs类药物Erufosine (erucylphophohomocholine or erucylphospho-N,N,N-trimethylpropylammonium)对胃癌细胞及骨髓细胞的增殖、凋亡的影响,并探讨此种影响与Akt蛋白表达的关系。
1 材料和方法
1.1 材料
人胃癌AGS细胞系购于上海细胞库;人骨髓细胞、M3534 Metho- Cult培养基和H4534 MethoCult培养基购自StemCell公司;8周龄BALB/c小鼠购自中科院上海动物所;Erufosine为美国波士顿大学临床医学中心姚敏博士惠赠,用0.9%NaCl溶液配置成20 mmol/L工作母液。RPMI 1640培养液购于美国GIBCO BRL公司;胎牛血清为杭州四季青生物工程材料研究所产品;MTS{tetrazolium compound[3-(4,5-dimethylthia-zol-2-yl)-5-(3-carbo-xymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetra-zolium, inner salt;]}为美国Promega公司产品;兔抗Akt抗体、内参β-actin和辣根过氧化物标记抗兔二抗购于Santa Cruz公司;硝酸纤维素膜购自Invitrogen公司;Matrigel购自BD公司;胶原酶和弹性蛋白酶购自Roche公司。
1.2 方法
1.2.1 细胞培养
胃癌AGS细胞常规方法复苏,接种于含5%胎牛血清的RPMI 1640培养液瓶中,每毫升培养液含青霉素和链霉素均为100 U,置于37 ℃、CO2体积分数为5%的饱和湿度培养箱内培养,生长至覆盖70%培养瓶时,用0.25%的胰酶消化传代,取对数期的细胞进行实验。
1.2.2 鼠骨髓细胞的收集
雄性8周龄BALB/c小鼠用CO2吸入法处死。在无菌层流洁净工作台上用70%乙醇喷雾消毒小鼠。完整干净切取小鼠胫腓骨,切除长骨末端的骨骺端至骨髓腔。取一平头27 G注射器针头插入骨髓腔,注入含5%胎牛血清的无菌RPMI1640培养液2 mL,然后再抽出至骨干颜色变苍白,收集的细胞悬液注入50 mL的圆锥瓶中保持在湿冰上备用。
1.2.3 MTS比色法测定Erufosine对胃癌AGS细胞和骨髓细胞增殖的影响[5]
收集对数生长期的AGS细胞及上述收集的骨髓细胞,调整细胞浓度至5×105/mL。用抛硬币法将细胞随机分为实验组与空白对照组,每组设3个平行孔。取实验组细胞悬液接种于96孔板内,每孔加100 μL细胞悬液,温育24 h后再分别加入8个倍比稀释浓度梯度的Erufosine,调整每孔终体积至200 μL;以不含Erufosine的200 μL RPMI 1640完全培养液为空白对照组;96孔培养板置于37 ℃,CO2体积分数为5%的细胞培养箱内温育24 h后,每孔加入MTS (5 mg/mL)20 μL,继续温育4 h后,于酶标仪上以490 nm波长测定各孔吸光度(D)值。取3个平行孔的平均D值计算细胞增殖率。细胞增殖抑制率(%)=[1-(D实验组平均值/D对照组平均值)]×100%;以药物浓度对数为横轴,抑制率为纵轴,作量-效曲线,得半数抑制率(IC50)及90%抑制率(IC90)。
1.2.4 骨髓克隆形成实验(colony forming unitgranulocyte-macro phage,CFU-GM)
人骨髓细胞和新鲜分离的鼠骨髓细胞分别培养于H4534 MethoCult培养基和M3534 MethoCult培养基中。用20×的实验药物制成150 μL不同浓度的Erufosine与150 μL人及鼠骨髓细胞加至含3 μL解冻的MethoCult培养基的试管中,立即混匀,调节鼠骨髓细胞至每管4×104、人骨髓细胞每管8×104,试管稳定15 min直至气泡消失。然后将每1 mL细胞悬液移至100 cm2培养皿中央,轻轻旋转培养皿使细胞悬液平坦覆盖整个培养皿底面,然后置37 ℃,CO2体积分数为5%的培养箱,鼠骨髓细胞培养13 d,人骨髓细胞培养15 d。含30个或更多细胞被认定为一个克隆。每组设4个平行孔,不同浓度Erufosine组的克隆数与不加Erufosine的对照组的比值为该组的克隆抑制率。
胃癌AGS细胞培养于含5%胎牛血清的RPMI 1640培养液中。AGS细胞加不同浓度的Erufosine药至3 mL,在MethoCult培养液中培养。AGS细胞与MethoCult培养液充分混匀后,以1.1 mL加至35 mm培养皿(每个培养皿含1 000个AGS细胞),然后置37 ℃,CO2体积分数为5%的培养箱培养7 d,最后用甲醇固定,结晶紫染色并计数,每组设4个平行孔,取其均数作为该浓度的值。
AGS肿瘤细胞培养后,取5×106个细胞溶于200 mL RPMI 1640∶Matrigel为1∶1混合液中,皮下种植于雌性BALB/c裸鼠。肿瘤生长至7~10 mm时,于鼠尾静脉注射Erufosine,给药量为120 mg/kg,以10 μL的0.9%NaCl溶液溶解上述药量。24 h后处死裸鼠并收集骨髓细胞行上述CFU-GM实验,用手术刀切取种植肿瘤并切碎,用含4 mg/mL胶原酶0.4 mg/mL弹性蛋白酶和1%FBS的RPMI 1640在37 ℃消化,制成单细胞悬液。
收集的上述几种细胞用含1% FBS的RPMI 1640洗2遍,处理好的AGS加入上述的CFU-GM实验。
1.2.5 Western blot检测
AGS细胞培养在5%FBS的RPMI 1640培养液中,加Erufosine作用12及24 h后,细胞经胰酶消化后再经裂解缓冲液裂解。取50 μg蛋白加样至SDS-聚丙烯酰胺凝胶电泳,分离湿转膜法采用5%脱脂牛奶封闭2 h后,使用TBS洗膜,再用兔源抗Akt和内参β-actin抗体作用,4 ℃过夜,加入辣根过氧化物标记的抗兔二抗作用1 h,洗脱后显影。根据预期相对分子质量大小区域出现的特异性条带判断蛋白表达量的高低,然后图形系统扫描。
1.3 统计学处理
2 结 果
2.1 Erufosine对胃癌AGS细胞和骨髓细胞增殖的影响
胃癌AGS细胞和人及鼠骨髓细胞经Erufosine作用后,细胞增殖受抑制,并且这种抑制效应随浓度的上升而增大。AGS细胞的IC50和IC90分别为(5.8±2.6)μmol/L和(13.5±4.6)μmol/L,人骨髓细胞的IC50和IC90分别为(96.5±32.6)μmol/L和(232.8±42.8)μmol/L,与AGS细胞的IC50及IC90相比差异均有显著统计学意义(P<0.01);鼠骨髓细胞的IC50和IC90分别为(65.5±28.6)μmol/L和(228.8±54.8)μmol/L,与人骨髓细胞的IC50及IC90相比差异无统计学意义(P>0.05,图1)。
2.2 Erufosine对胃癌AGS细胞和骨髓细胞CFU-GM的影响
CFU-GM抑制效应随Erufosine浓度的上升而增大。荷瘤鼠种植胃癌AGS细胞的CFU-GM IC50和IC90分别为(4.8±1.6)μmol/L和(7.5±2.4)μmol/L;AGS细胞的CFU-GM IC50和IC90分别为(7.8±2.5)μmol/L和(13.6±3.6)μmol/L;两组间IC50及IC90的差异均有统计学意义(P<0.01)。人骨髓细胞的IC50和IC90分别为(86.5±18.6)μmol/L和(250.8±48.8)μmol/L,与AGS细胞的IC50及IC90相比差异有统计学意义(P<0.01);鼠骨髓细胞的IC50和IC90分别为(76.5±20.6)μmol/L和(242.8±44.8)μmol/L,荷瘤鼠骨髓细胞的IC50和IC90分别为(68.8±18.6)μmol/L和(242.8±44.8)μmol/L。人与鼠骨髓细胞IC50和IC90、鼠与荷瘤鼠骨髓细胞的IC50和IC90差异无统计学意义(P>0.05,图2)。

图1 人胃癌AGS细胞及人和鼠骨髓细胞经Erufosine作用后增殖受抑制Fig.1 Proliferation of human gastric cancer AGS cell,human and mouse bone marrow cells were inhibited after treated with Erufosine
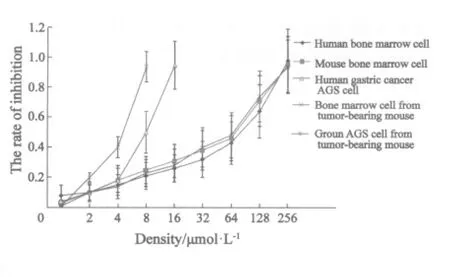
图2 不同浓度Erufosine对各种细胞CFU-GM的影响Fig.2 The CFU-GM of several cells were changed treated with different concentration of Erufosine.
2.3 Erufosine对胃癌AGS细胞Akt蛋白表达的影响
AGS细胞经Erufosine 8 μmol/L作用12及24 h,其Akt蛋白表达明显下降,且与作用时间明显相关(图3)。
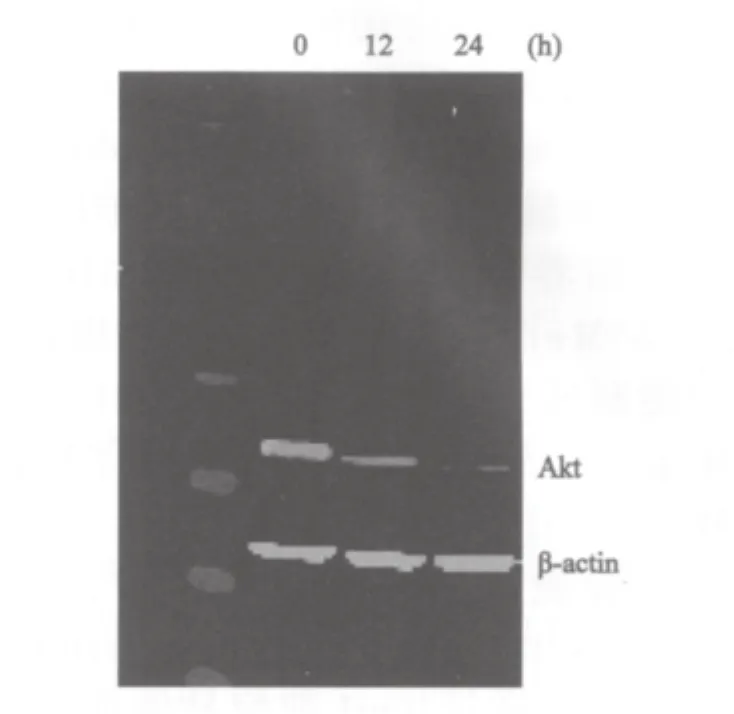
图3 Erufosine对胃癌细胞Akt蛋白表达的影响Fig.3 The expression of Akt protein of gastric cancer cell was changed after treated with Erufosine
3 讨 论
磷脂类化合物定位于细胞膜,能干预细胞膜的信号传递、抑制细胞增生和诱导细胞凋亡[6-9]。由于磷脂类化合物在体内的快速代谢限制了其临床应用,故通过切除一个甘油基团而合成了新一代APCs。虽然多种烷基溶血卵磷脂化合物均具有明显的抗肿瘤作用,但因胃肠道或溶血的不良反应而无法应用临床[10-11]。再次改变结构的APCs药Erufosine明显降低了溶血的不良反应[12-14]。有研究结果证实,Erufosine能选择性抑制多发性骨髓瘤、乳腺癌和胰腺癌细胞,其癌细胞与骨髓细胞的IC50和IC90分别相差近20倍及50倍,癌细胞对Erufosine更敏感,其IC90值为9.5~44.0 μmol/L,而人和鼠骨髓细胞的IC90约200~220 μmol/L,这巨大的差异使Erufosine作为抗癌药应用时具有更低的不良反应并能全身应用[15-16]。Erufosine的Ⅰ期临床试验数据显示对大多数肿瘤均有效[4,6,17-18]。
本研究在Erufosine对细胞的增殖抑制实验(MTS)中发现,胃癌AGS细胞在Erufosine作用下其增殖抑制率随浓度上升而加大,从2 μmol/L时AGS增殖抑制率约为10%至16 μmol/L时AGS增殖抑制率竟近达对照组的90%。而人和鼠骨髓细胞在16 μmol/L Erufosine浓度下,其增殖抑制率约为30%,差异无统计学意义(P>0.05)。在CFU-GM实验中,荷瘤鼠AGS与培养AGS瘤细胞的CFU-GM实验,其IC50及IC90均约降低2倍(P<0.01),说明荷瘤鼠已预先给药处理也影响后续在Methocult培养基上的CFU-GM结果。而荷瘤鼠骨髓与正常鼠骨髓细胞的CFU-GM数相差约4%,差异无统计学意义(P>0.05)。120 mg/kg鼠质量的Erufosine剂量对后续鼠骨髓细胞增殖实验几乎没有影响,说明Erufosine能选择性作用于癌细胞并能选择性保护骨髓细胞,与国外结果相似,但机制尚未明确,值得进一步研究。同时是否会出现延时不良反应及其他器官功能影响,也需继续观察。初步证明一定剂量的Erufosine动物全身给药是安全的,不破坏宿主的骨髓功能并能有效抑制癌细胞的增殖,与文献报道相符[3-4]。
Erufosine的作用机制尚未完全阐明,有报道Erufosine能裂解和代谢细胞膜磷脂,导致PI3K/Akt膜信号传导通路阻断及细胞的凋亡改变[3-4,8,12,17,19-20],并能抑制神经胶质瘤U87细胞的Akt信号传导通路。Runder等[18]报道Erufosine通过降低473-Akt丝氨酸磷酸化水平诱导肿瘤细胞凋亡。在PI3K/Akt信号传导通路中,PI3K介导PIP3形成对生长因子介导的Akt激活起了重要的作用,不断增加的PIP3可引起磷脂酰次黄嘌呤核苷酸相关的丝氨酸/苏氨酸激酶PDK1激活和Akt分子活化。在细胞质膜激活的PDK1催化Akt对苏氨酸308位氨基酸磷酸化,而充分激活Akt需要Akt分子上473位氨基酸的磷酸化支持。Erufosine能降低慢性髓性白血病(CML)的融合蛋白P210(BCLABL)的表达,同时诱导Rb蛋白表达、增加P27蛋白的表达并抑制蛋白激酶C[3-4]。本研究初步探讨了Erufosine对胃癌AGS细胞的Akt蛋白表达的影响,在20 μmol/L作用12、24 h时,对癌细胞的Akt磷酸化有明显抑制,24 h比12 h明显,但是否随时间的延长继续抑制或到一定时间达到完全抑制,和抑制的量化程度尚需进一步研究。
[1] WEN W M, ALEX A A. Novel agents on the horizon for cancer therapy [J]. CA Cancer J Clin, 2009, 59: 111-137.
[2] VICTOR V L, WILFRIED K. Synergistic inhibition of mitochondrial respiration by anticancer agent erucylphosphohomocholine and cyclosporin A [J]. J Biol Chem, 2007,282: 37303-37307.
[3] MARTELLI A M, PAPA V, TAZZARI P L, et al.Erucylphosphohom-ocholine, the first intravenously applicable alkylphosphocholine, is cytotoxic to acute myelogenous leukemia cells through JNK- and PP2A-dependent mechanisms [J]. Leukemia, 2010, 24(4): 687-698.
[4] KÖNIGS S K, PALLASCH C P, LINDNER L H, et al.Erufosine, a novel alkylphosphocholine, induces apoptosis in CLL through a caspase- dependent pathway [J] . Leuk Res, 2010, 34(8): 1064-1069.
[5] FAN S, WU F, MAARTINIUK F,et al. Protective effects of anti-ricin A-chain RNA aptamer against ricin toxicity[J].World J Gastroenterol, 2008, 14(41): 6360-6365.
[6] ZAREMBERG V, GAJATE C, CACHARRO L M, et al.Cytotoxicity of an anti-cancer lysophospholipid through selective modification of lipid raft composition [J]. J Biol Chem, 2005, 280(45): 38047-38058.
[7] OBERLE C, MASSING U, KRUG H F. On the mechanism of alkylphosph-ocholine (APC) induced apoptosis in tumour cells [J]. Biol Chem, 2005, 386(3): 237-245.
[8] BERGER M R, TSONEVA I, KONSTANTINOV S M, et al. Induction of apop-tosis by erucylphospho-N,N,N-trimethylammonium is associated with changes in signal molecule expression and location [J]. Ann N Y Acad Sci,2003, 1010: 307-310.
[9] ARGIRIS A, COHEN E, KARRISON T, et al. A phase Ⅱtrial of perifosine, an oral alkylphospholipid, in recurrent or metastatic head and neck cancer [J]. Cancer Biol Ther,2006, 5(7): 766-770.
[10] CRUL M, ROSING H, DE KLERK G J, et al. Phase Ⅰ and pharmacological study of daily oral administration of perifosine(D-21266) in patients with advanced solid tumors [J]. Eur J Cancer, 2002, 38(12): 1615-1621.
[11] ERNST D S, EISENHAUER E, WAINMAN N, et al. PhaseⅡ study of perifosine in previously untreated patients with metastatic melanoma [J]. Invest New Drugs, 2005, 23(205):1-7.
[12] GHOBRIAL I M, ROCCARO A, HONG F, et al. Clinical and translation studies of a phase Ⅱ trial of the novel oral Akt inhibitor perifosine in relapsed or relapsed/refractory Waldenstrom’s macroglobulinemia [J]. Clin Cancer Res,2010, 16 (3): 1033-1041.
[13] FIEGL M, LINDNER L H, JERGENS M, et al. Erufosine, a novel alkylphosphocholine, in acute myeloid leukemia: single activity and combination with other antileukemic drugs [J].Cancer Chemother Pharmacol, 2008, (62): 321-329.
[14] YOSIFOV D Y, TODROV P T, ZAHARIEVA M M, et al.Erucylphospho-N,N,N-trimethylpropylammonium(Erufosi ne) is a potential anti-myeloma drug devoid of myelotoxicity[J]. Cancer Chemother Pharmacol, 2011, 67(1): 13-25.
[15] REBECCA B, CECILE R, LESLIE K, et al. Evaluation of Erufosine, an alkylphosphocholine, on malignant cells and bone marrow CFU-GM[C]. AACR Meeting Abstracts,2008: 5703.
[16] ADWAN H, BäUERLE T, NAJAJREH Y, et al. Decreased levels of osteopontin and bone sialoprotein Ⅱ are correlated with reduced proliferation, colony formation, and migration of GFP-MDA-MB- 231 cells [J]. Int J Oncol, 2004, 24(5):1235-1244.
[17] MOHAMED R, ERIN R, YUN D, et al. Coadministration of histone deacetylase inhibitors and perifosine synergistically induces apoptosis in human leukemia cells through Akt and ERK1/2 inactivation and the generation of ceramide and reactive oxygen species [J]. Cancer Res, 2005, 65: 2422-2432.
[18] RUDNER J, RUINER C E, HANDRICK R, et al. The Aktinhibitor Erufosine induces apoptotic cell death in prostate cancer cells and increases the short term effects of ionizing radiation[J]. Radiat Oncol, 2010, 5: 108.
[19] GILLIS J J, DENNIS P A. Perifosine: update on a novel Akt inhibitor [J]. Curr Oncol Reports, 2009, 11(2): 102-110.
[20] HIDESHIMA T, CATLEY L, YASUI H, et al. Perifosine,an oral bioactive novel alkylphospholipid, inhibits Akt and induces in vitro and in vivo cytotoxicity in human multiple myeloma cells [J]. Blood, 2006, 107(10): 4053-4062.
