癌睾丸抗原OY-TES-1在脑胶质瘤中的表达及其抗体血清学分析
2011-08-14李希圣严峻罗彬贺菽嘉范蓉林永达罗昱肖绍文谢小薰
李希圣 严峻 罗彬 贺菽嘉 范蓉 林永达罗昱 肖绍文 谢小薰,4
1.广西医科大学第一附属医院神经外科,广西 南宁 530021;2.广西医科大学组胚教研室,广西 南宁 530021;3.广西中医学院组胚教研室,广西 南宁 530021;4.广西医科大学基础医学中心实验室,广西 南宁 530021
*:现工作单位为滨州医学院附属医院神经外科,山东 滨州 256600
胶质瘤是最常见的原发性恶性脑肿瘤,目前的治疗仍以手术为主,放、化疗为辅。尽管这些传统的治疗方法已有了很多改进,但是患者的中位生存期仍不足1年[1]。免疫治疗是一种新的辅助治疗方法,目前已用于肿瘤治疗,具有一定的临床疗效[2]。中枢神经系统一直被认为是一个免疫豁免区,但近年来的许多研究发现,恶性脑肿瘤常伴有血-脑脊液屏障破坏,免疫细胞穿越血-脑脊液屏障进入脑组织,以及脑组织的主要组织相容性复合体(major histocompatibility complex,MHC)表达上调,这一现象提示开展脑肿瘤免疫治疗具有一定的可能性[3]。
癌睾丸(cancer-testis,CT)抗原是一类在多种肿瘤组织表达的抗原[4]。目前一些CT抗原如Mage-A1、A3的肿瘤疫苗已进入临床实验,在一些颅外肿瘤的治疗中收到了较好的疗效[5]。由于胶质瘤低表达或不表达这些CT抗原而制约了将其用于胶质瘤免疫治疗。因此,有必要对一些新筛选出的CT抗原做进一步的研究,探讨哪些CT抗原具有用于胶质瘤免疫治疗的可能性。
OY-TES-1是CT抗原家族中的一员[6]。根据它在CT抗原数据库中的排名,又称为CT23。最近的研究发现,OY-TES-1蛋白与有丝分裂纺锤体蛋白NuMA相互作用,导致细胞恶性转化,抵抗化疗药物紫杉醇的作用[7]。为了解OY-TES-1在胶质瘤的表达情况及是否具有免疫原性,本研究初步检测了OY-TES-1 mRNA和血清抗体,并结合临床病理指标进行分析。
1 材料和方法
1.1 标本和主要试剂
胶质瘤患者肿瘤标本及配套血清51例,其中男性32例,女性19例,年龄8~65岁,中位年龄35岁,均来自广西医科大学第一附属医院神经外科2004年—2008 年的住院患者;所有肿瘤标本均经病理检测确认,收集血清标本之前患者均未接受任何治疗。健康人血清107例来自广西医科大学学生。
RNA提取试剂盒(北京天根生化公司),逆转录试剂盒和Taq DNA聚合酶(日本TaKaRa公司),Cellstar 96孔酶标板(Greiner bio-one公司),生物素-山羊抗人IgG单克隆抗体和辣根过氧化物酶标记的链霉亲和素(HRP-streptavidin)(美国KPL公司),TMB(美国Sigma公司)。
1.2 总RNA提取与cDNA合成
取50~100 mg于-80 ℃保存的组织,迅速加入裂解液,电动匀浆仪匀浆,步骤按公司提供的说明书进行。所得RNA溶于无RNA酶的纯水中,电泳检测RNA质量,无明显18 S和28 S者予以舍弃。取2 μg总RNA,进行cDNA合成,所得的cDNA用P53引物作PCR扩增以检测其质量。P53引物序列及PCR反应条件参照文献[8]。
1.3 目的基因RT-PCR扩增
PCR反应体系为30 μL,包括1 μL cDNA、上下游引物各1 μL、dNTPs、Taq DNA聚合酶及PCR缓冲液等,置反应物于PCR仪。OY-TES-1引物序列及PCR反应条件参照文献[6],引物由生工生物工程(上海)有限公司合成。每轮RT-PCR反应中,采用正常睾丸cDNA为阳性对照,同时设立不加模板的空白对照,以排除假阳性的可能性。
1.4 OY-TES-1融合蛋白制备
带麦芽糖结合蛋白(maltose binding protein,MBP)标签的OY-TES-1重组质粒由本课题组构建[9]。将OY-TES-1重组质粒转化感受态细胞(42 ℃热休克法),接种单菌落于含0.2%葡萄糖、100 μg/mL氨卞青霉素的LB培养液,37 ℃剧烈振荡至D600为0.5~0.7,取1 mL菌液作为诱导前对照,加入IPTG终浓度为0.5 mmol/L,30 ℃诱导表达2 h。收集菌液,4 ℃以5 000 r/min离心10 min(Sigma公司3K15离心机),每克菌体沉淀加入3 mL过柱平衡液(20 mmol/L Tris-HCl,200 mmol/L NaCl,1 mmol/LEDTA,10 mmol/L β-巯基乙醇)和50 mmol/L的苯甲基磺酰氟(PMSF) 8 μL,反复冻融3次,冰浴超声裂解细菌,在4 ℃以12 000 r/min离心20 min(Sigma公司3K15离心机),收集上清液并加入Amylose Resin亲和层析柱中,随后加入12倍柱床体积的过柱平衡液,以洗去非特异结合的蛋白,最后用10 mmol/L麦芽糖洗脱缓冲液过亲和层析柱,收集含OYTES-1融合蛋白洗脱液。测定D280,SDS-PAGE电泳鉴定纯度,将含有融合蛋白的洗脱液合并收集,待浓缩冻干。
1.5 ELISA检测
将1.0 mg/L的OY-TES-1融合蛋白加入酶标板(100 μL/孔),4 ℃包被过夜。用PBST(PBS含0.05% Tween-20)在室温下洗板3次,50 g/L脱脂奶于37 ℃封闭1 h,上待检血清(1∶400)于37 ℃温育1 h,随后用IgG单克隆抗体(1∶10 000)于37 ℃温育1 h,洗板后加入HRP-streptavidin(1∶1 000),37 ℃温育30 min,再次洗板加TMB避光显色15 min,用1 mol/L硫酸终止反应。酶标仪(美国Thermo公司)测定D450值。以包被MBP为阴性对照,进行统计学分析。以大于健康人平均吸光度值3个标准差者为阳性。
1.6 统计学处理
应用SPSS13.0统计分析软件进行数据分析,样本率的比较用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 OY-TES-1 mRNA在脑胶质瘤组织中的表达
脑胶质瘤OY-TES-1 mRNA阳性率为80.4%(41/51),统计学分析显示OY-TES-1 mRNA表达与脑胶质瘤患者的性别、年龄、肿瘤大小、病理分级等参数无关(图1,表1)。
2.2 血清抗体的检测结果
ELISA检测107例健康人血清抗体,吸光度均值为0.686±0.125;以健康人D450均数加3个标准差值为Cut-off值(1.061),判定抗体阳性的血清。在所检测健康人血清中无一例抗体阳性(图2)。
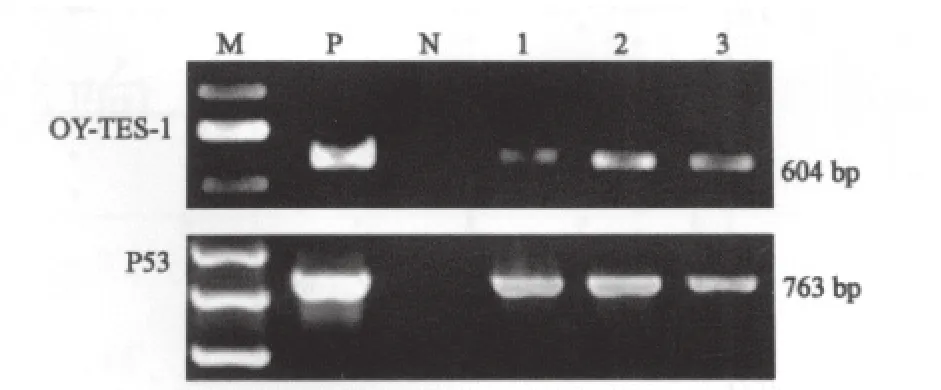
图1 OY-TES-1 PCR产物电泳图Fig.1 Electrophoresis of OY-TES-1 PCR products of glioma tissues
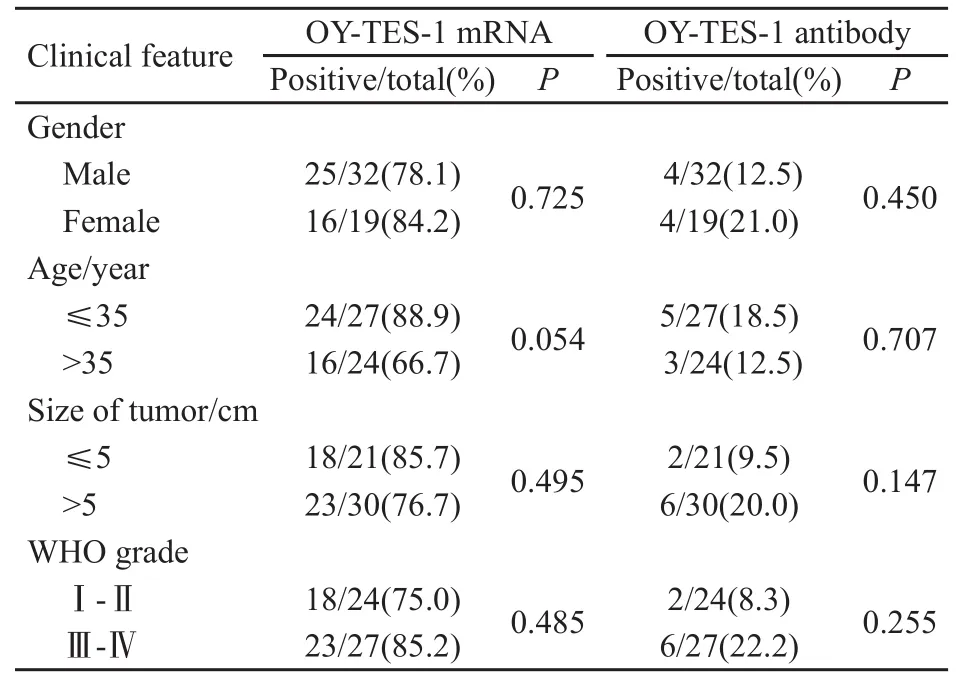
表1 OY-TES-1mRNA及其抗体与胶质瘤相关临床指标的关系Tab.1 Correlation between ACRBP/OY-TES-1 mRNA expression, sera antibody and clinicopathological features in glioma
51例脑胶质瘤患者血清OY-TES-1抗体阳性率为15.7%(8/51)。抗体D50均值为0.811±0.283,明显高于健康人血清抗体均值(P<0.01)。在各种病理类型的胶质瘤中,OYTES-1抗体阳性率各异;其中Ⅰ~Ⅱ级星型细胞瘤患者抗体阳性率为25%(4/16)、Ⅱ~Ⅲ级星型细胞瘤患者为11.1%(1/9);1/2室管膜瘤、1/11多形性胶质母细胞瘤和1/1髓母细胞瘤患者可检测到OY-TES-1抗体;而间变性星型细胞瘤等6种胶质瘤患者未检测到OY-TES-1抗体(图2)。

图2 ELISA 检测血清OY-TES-1抗体Fig.2 Detection of sera OY-TES-1 antibody with ELISA
3 讨 论
本研究结果证实在脑胶质瘤中OY-TES-1 mRNA亦有较高的阳性率。由于基因的转录还涉及到诸多调节机制,故mRNA的表达不能完全代表其蛋白的表达情况;目前有关OYTES-1蛋白在卵巢癌中表达率为69%[10],在肝细胞癌中为40%[11]。因此,下一步尚需了解OY-TES-1蛋白在胶质瘤中表达情况。
本研究结果同时证实胶质瘤血清OYTES-1抗体的阳性表达率为15.7%(8/51),同时再次证实在健康人血清中无相应的抗体,表明OY-TES-1抗体具有肿瘤特异性。尽管统计学分析显示OY-TES-1抗体的出现与临床指标无关联,但值得注意的是,恶性程度高(Ⅲ~Ⅳ级)的胶质瘤更易产生OY-TES-1抗体,这可能与肿瘤浸润生长快、损伤血-脑脊液屏障严重有关。下一步需要扩大病例数,尤其是恶性程度高的胶质瘤,同时需要对抗体进行动态的观测,才能真正了解其临床意义。此外,OYTES-1作为一种抗原能在胶质瘤患者体内引起体液免疫反应,但当它被MHC I类分子呈递至肿瘤细胞的表面时,也有可能诱导产生细胞免疫反应。最近已有研究鉴定出一个OY-TES-1的HLA-A24 限制性抗原肽,用该抗原肽诱导的细胞毒T细胞(cytotoxic T cell,CTL)能在体外特异性地杀伤OY-TES-1 mRNA阳性的肺癌细胞株[12]。虽然这是一个体外实验的研究,但提示OY-TES-1在体内可引起细胞免疫反应。
本研究结果显示,OY-TES-1 mRNA在胶质瘤中具有较高的阳性率,并能在胶质瘤患者体内引起体液免疫反应,提示OY-TES-1用于胶质瘤免疫治疗具有潜在的临床应用价值。
[1] GURNEY J G, KADAN-LOTTICK N. Brain and other central nervous system tumors: rates, trends, and epidemiology [J].Curr Opin Oncol, 2001, 13(3): 160-166.
[2] UEDA Y, SHIMIZU K, ITOH T, et al. Induction of peptidespecific immune response in patients with primary malignant melanoma of the esophagus after immunotherapy using dendritic cells pulsed with MAGE peptides [J]. Jpn J Clin Oncol, 2007, 37(2): 140-145.
[3] YAMANAKA R. Dendritic-cell- and peptide-based vacination strategies for glioma [J]. Neurosurg Rev, 2009,32(3): 265-273.
[4] CABALLERO O L, CHEN Y T. Cancer/testis (CT) antigens:potential targets for immunotherapy [J]. Cancer Sci, 2009,100(11): 2014-2021.
[5] UEDA Y, SHIMIZU K, ITOH T, et al. Induction of peptidespecific immune response in patients with primary malignant melanoma of the esophagus after immunotherapy using dendritic cells pulsed with MAGE peptides [J]. Jpn J Clin Oncol, 2007, 37(2): 140-145.
[6] ONO T, KURASHIGE T, HARADA N, et al. Identification binding protein sp32 precursor as a human cancer/testis antigen [J]. Proc Natl Acad Sci U S A, 2001, 98(6): 3282-3287.
[7] WHITEHURST A W, XIE Y, PURINTON S C, et al. Tumor antigen acrosin binding protein normalizes mitotic spindle function to promote cancer cell proliferation [J]. Cancer Res, 2010, 70(19): 7652-7661.
[8] GURE A O, STOCKERT E, ARDEN K C, et al. CT10: a new cancer-testis (CT) antigen homologous to CT7 and the MAGE family, identified by representational difference analysis[J]. Int J Cancer, 2000, 85(5): 726-732.
[9] 王峰, 范蓉, 莫发荣, 等. 癌睾丸抗原OY-TES-1基因的克隆、表达及纯化 [J]. 中国免疫学杂志, 2006, 22(12):16-19.
[10] TAMMELA J, UENAKA A, ONO T, et al. OY-TES-1 expression and serum immunoreactivity in epithelial ovarian cancer [J]. Int J Oncol, 2006, 29(4): 903-910.
[11] 范蓉, 黄巍, 肖绍文, 等. OY-TES-1在肝细胞癌中的表达及抗体血清学分析[J]. 世界华人消化杂志, 2009,17(32): 3307-3312.
[12] OKUMURA H, NAGUSHI Y, UANAHA A, et al. Identification of an HLA-A24-restricted OY-TES-1 epitope recognized by cytotoxic T cell [J]. Microbiol Immunol, 2005, 49(11):1009-1016.
