三种肝保存液低温保存生物人工肝用C3A细胞的效果比较*
2011-08-13李庆勇蒋知新张鋆歆张清华
林 虎,李庆勇,蒋知新,张鋆歆,彭 凌,杜 平,张清华△,高 毅
(1.解放军第三〇五医院老年病中心,北京 100017;2.南方医科大学珠江医院肝胆二科,广州 510262)
大量功能好的肝细胞是生物人工肝支持系统(bioartificial liver support system,BALSS)的核心[1],所以探索出一种可靠的肝细胞低温保存方法,建立一个肝细胞库是BALSS推广的基础[2]。UW液(University of wisconsin solution)、CS液(Celsior solution)和 HTK液(Histidine-tryptophan-ketoglutarate solution)是目前较常用的供肝保存液,但供肝的保存混杂有缺血再灌注损伤的影响,不能完全反应对肝细胞的保存效果[3]。C3A细胞是一种人源性高分化肝肿瘤细胞,具备氨基清除和清蛋白分泌等功能,以C3A细胞为生物材料的体外肝辅助装置(extracorporeal liver-assist device,ELAD)系统已经进入了Ⅲ期临床试验[4]。但C3A细胞分别于 UW液、CS液、HTK液低温保存后细胞存活率及功能有无差异,是否满足BLASS的需要未见相关文献报道。因此,本研究分别采用UW液、CS液和HTK液于4℃常规低温保存生物人工肝用C3A细胞72 h,以比较其保存效果。
1 材料与方法
1.1 材料 C3A细胞(ATCC,美国);DM EM/F-12培养基、优级胎牛血清(FBS)、青霉素/链霉素溶液(×100)、0.25%胰酶及PBS缓冲液(Invitrogen,美国);UW 液(Bristol-myers quibb);50 mL培养瓶、6孔培养板(Costar Corning);氯化铵(Sigma);人清蛋白ELISA试剂盒(R&D,美国),Mode1450型酶标仪(Bio-Rad,美国);CK2型倒置显微镜(Olympus,日本);Live/Dead试剂盒(Invitrogen,美国);乳酸测定试剂盒(Boehringer Mannhein),Du530型分光光度仪(Beckman,德国);DXC800型全自动生化仪及FACScan型流式细胞仪(Beckman coulter,美国);MIR-151型微电脑程控低温培养箱-10.1~60.1℃及MCO-175型二氧化碳培养箱(SANYO,日本);海尔智能温度记录仪-100.1~120.1℃。超净工作台(北京昌平长城空气净化工程公司)。
1.2 分组 C3A细胞悬液分3组(n=8):UW液保存组(UW液组)、Celsior液保存组(CS液组)、HTK 液保存组(HTK 液组)。
1.3 细胞培养 取C3A细胞约 1×106个,接种到50 mL培养瓶,所用培养基为DM EM/F-12加10%FBS及1%青霉素/链霉素溶液;将培养瓶置于37℃、5%CO2、100%湿度的培养箱内培养;每24 h换液1次,倒置显微镜观察直至内壁长满。
1.4 低温保存及复温 倾去培养瓶内的培养基,PBS液洗涤3次后分别置换为5 mL UW液、CS液和HTK液,于4℃保存72 h后,将保存液液置换为培养基5 mL,培养30 min。
1.5 复温后指标测定 取一瓶细胞,吸出培养基,0.25%胰酶消化,制备成浓度约1×106/mL细胞悬液。(1)取细胞悬液1 mL,加到1 mL含4 mmol/L氯化铵培养液的6孔培养板中,培养箱内培养24 h后,取上清,1000 r/min离心20 min,测定尿素的浓度、丙氨酸氨基转移酶(ALT)浓度、人清蛋白含量(按人清蛋白ELISA试剂盒说明)。(2)取细胞悬液 1 mL,按照三磷酸腺苷(ATP)试剂盒的说明,于全自动酶标仪测定细胞内ATP含量。(3)剩余的细胞悬液于1000 r/min离心2 min,沉淀细胞按Live/Dead试剂盒说明,于流式细胞仪测定细胞存活率、死亡率。
2 结 果
2.1 不同组低温保存72 h后细胞存活率、死亡率 新鲜细胞的存活率是(94.96±2.16)%,死亡率是(5.04±2.16)%。低温保存72 h后,细胞存活率较新鲜细胞降低,UW液组细胞存活率显著高于HTK液组(P<0.001),同CS组无差异;细胞死亡率较新鲜细胞增加,UW液组细胞死亡率显著低于HTK液组(P<0.001),但同 CS液组差异无统计学意义(P>0.05)。见表 1、图1~4。
表1 不同组低温保存72 h后细胞存活率和死亡率(,%)
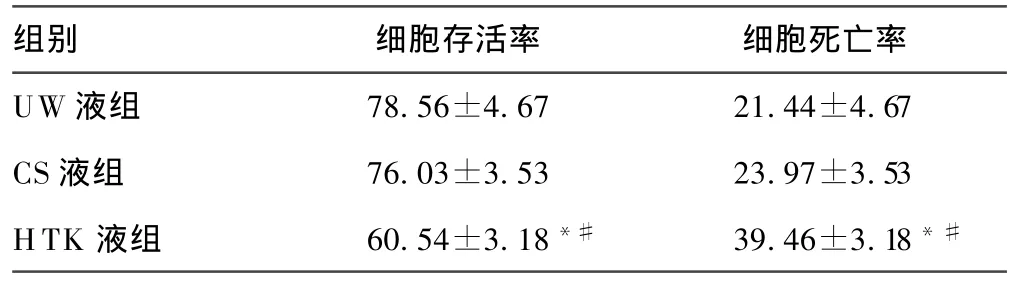
表1 不同组低温保存72 h后细胞存活率和死亡率(,%)
*:P<0.05,与同时间点UW液组比较;#:P<0.05,与同时间点CS液组比较。
组别 细胞存活率 细胞死亡率UW液组 78.56±4.67 21.44±4.67 CS液组 76.03±3.53 23.97±3.53 HTK液组 60.54±3.18*# 39.46±3.18*#
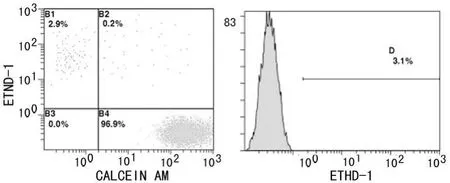
图1 新鲜细胞流式图
低温保存72 h后流式细胞仪测定细胞存活率和死亡率。Calcein AM/Ethidium homodimer-1双染,Calcein AM可将存活细胞染成绿色,Ethidium homodimer-1可与死亡细胞核结合,呈红色。流式细胞仪分析,获得4个象限的直方图和峰状图。直方图B4:Calcein AM+表示正常细胞;B1:Ethidium homodimer-1+表示死亡细胞;B2与B3:(An-PI+)表示操作过程中损伤的细胞。峰状图:Ethidium homodimer-1阴性和阳性百分比(细胞存活率和死亡率)。

图2 UW液组流式图
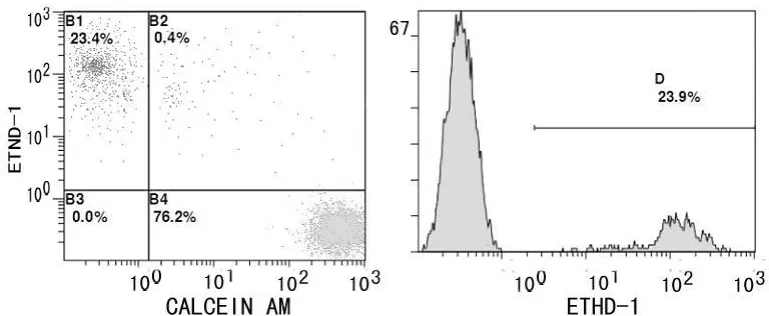
图3 CS液组流式图

图4 HTK液组流式图
2.2 不同组低温保存72 h后细胞ALT与乳酸释放 新鲜细胞释放的ALT是(3.45±0.66)U/L,乳酸释放是(2.55±1.04)μ g/106cells。低温保存72 h后,细胞ALT释放及乳酸释放较新鲜细胞增加,但UW 液组、CS液组乳酸脱氢酶(LDH)释放及乳酸释放均显著低于HTK液组(P<0.01),UW液组同CS液组ALT释放(P=0.459)及乳酸释放(P=0.935)无差异。见表2。
表2 不同组低温保存72 h后细胞ALT与乳酸释放()

表2 不同组低温保存72 h后细胞ALT与乳酸释放()
*:P<0.05,与同时间点UW 液组比较;#:P<0.05,与同时间点CS液组比较。
组别 A LT释放(U/L) 乳酸释放(μ g/106cells)UW 液组 5.73±1.09 10.48±1.13 CS液组 6.08±0.78 10.39±1.85 HTK液组 8.25±1.12*# 17.89±3.54*#
表3 不同组低温保存72 h后细胞尿素合成与清蛋白分泌()

表3 不同组低温保存72 h后细胞尿素合成与清蛋白分泌()
*:P<0.05,与同时间点UW 液组比较;#:P<0.05,与同时间点CS液组比较。
分组 尿素合成(mmol/L) 清蛋白分泌(g/L)UW 液组 0.52±0.11 1.79±0.26 CS液组 0.51±0.06 1.75±0.21 HTK液组 0.32±0.05*# 1.20±0.17*#
2.3 不同组低温保存72 h后细胞尿素合成功能及清蛋白分泌功能 新鲜细胞尿素合成是(0.99±0.20)mmol/L,清蛋白分泌是(2.23±0.33)g/L。低温保存72 h后,细胞尿素合成功能下降,但 UW液组尿素合成功能优于 HTK液组(P=0.002),同CS液组无差别(P=0.917);细胞清蛋白分泌功能下降,但UW液组清蛋白分泌优于HTK液组(P<0.01),同CS液组无差异(P=0.724)。见表3。
3 讨 论
BALSS要代替肝脏,除细胞材料必须具有肝脏特异性功能外,还需要大量肝细胞,即约109个数量级才有临床意义。为了满足临床对肝细胞数量的需求,传统上采取传代培养或者微载体高密度培养的方法,但其工作量大、易污染、费用高且肝细胞经多次传代后活性下降。所以探索一种可靠的肝细胞低温保存方法,建立一个肝细胞库以克服肝细胞多次传代培养的缺点,是短期内获得大量肝细胞的较好方法[5]。本文分别采用UW液、CS液和HTK液4℃常规低温保存生物人工肝用C3A细胞72 h,使用流式细胞仪分析发现UW液组细胞存活率显著高于HTK液组,细胞死亡率则相反;同时发现UW液组的反应细胞损伤程度的ALT释放及反应低温代谢水平的乳酸释放显著低于HTK液组;UW液组的肝细胞尿素合成功能和清蛋白分泌功能优于HTK液组,但同CS液组相比无差别,具体可能的原因分析如下。
3.1 从渗透压成分分析UW液中添加了羟乙基淀粉、密三糖和乳糖醛酸等非渗透性保护剂,而CS液和HTK液以甘露醇为非渗透性保护剂,另外Celsior液含有乳糖醛酸。羟乙基淀粉、低分子右旋糖酐和甘露醇等是比较常用的非渗透性保护剂,具体保护机制目前仍然不明确,可能是与冻存过程中减少细胞内冰晶形成及复苏时减轻由于渗透压改变引起的细胞肿胀有关。另外大量的研究显示低温保存液中添加膜稳定剂糖类物质可提高复温后肝细胞存活率:(1)Miyamoto等[6]发现在冻存介质中添加葡萄糖(单糖)、海藻糖(双糖)、麦芽糖(三糖)或者长链糖均可明显提高复温后肝细胞的存活率,减轻肝细胞冻存损伤。(2)海藻糖是一种双糖,Katenz等[7]在10%二甲基亚砜(DMSO)基础上添加不同浓度的海藻糖-156℃冻存原代人肝细胞7 d。结果显示,同单用10%DMSO相比,添加海藻糖可以明显提高复苏后肝细胞存活率[(62.9±13)%,(46.9±11)%,P<0.01],更好的维持清蛋白分泌、尿素合成能力及Ⅰ相、Ⅱ相细胞代谢能力,降低LDH、AST释放;海藻糖的最合适浓度是0.2 mmol/L。(3)Limaye和 Kale[8]在 10%DMSO基础上分别添加海藻糖和抗氧化剂过氧化氢酶于-80℃或者-196℃冻存人胎肝细胞发现,海藻糖和过氧化氢酶均明显提高了冻存复苏后肝细胞的存活率及生物转化功能,而且两者于-196℃可产生协同作用,-80℃未观察到协同效应。综上,UW液中联合应用羟乙基淀粉、密三糖和乳糖醛酸等非渗透性保护剂及同CS液和HTK液相比,可能更适合肝细胞的低温保存。
3.2 从缓冲系统分析UW液以磷酸盐为缓冲系统防止细胞酸中毒,UW液的pH值为7.4;而HTK液则加入了强有力的酸碱缓冲系统-组氨酸缓冲系统,其中CS液的组氨酸含量较低同时含有OH-以防止细胞内酸中毒,CS液和HTK液的pH值分别为7.3、7.2。尽管组氨酸有强大的缓冲能力,可以有效地减轻H+的聚集,解除糖酵解的抑制,使ATP和乳酸有较大的生成率,但Bahde等[9]发现使用HTK液低温保存鼠肝,复温后因大量氧自由基产生,可引起大量肝细胞凋亡。而组氨酸则增加肝细胞凋亡的发生,通过减少组氨酸含量,使用N-乙酰组氨酸替代优化HTK液可明显减轻肝细胞的凋亡指数。从抗氧化剂和能量底物分析,UW液含谷胱甘肽及别嘌呤醇等抗氧化剂,CS液含谷胱甘肽,HTK液无抗氧化剂。大量研究发现,在低温保存液添加生物抗氧化剂[10](如还原性谷胱甘肽[11]、氮乙酰半胱氨酸[12]、过氧化氢酶[8]等),可以提高冻存肝细胞存活率,减轻低温保存复温后大量氧自由基生成引起的细胞凋亡。综上,HTK液的强大酸碱缓冲系统-组氨酸缓冲系统可能并不是很适宜肝细胞的低温保存,同时UW液、Celsior液含有抗氧化的还原性谷胱甘肽可能是对肝细胞的低温保存效果优于HTK液的原因。
总之,同HTK液相比,使用UW液或者CS液4℃保存肝细胞可明显的提高复温后C3A细胞存活率,降低低温损伤引起的ALT释放和乳酸释放,有效的保护C3A肝细胞尿素合成功能和清蛋白分泌功能。UW液或者Celsior液4℃保存C3A肝细胞仍然可以满足BLASS的需要,但不宜超过72 h。
[1]Demetriou AA,Brown RS Jr,Busuttil RW,et al.Prospective,randomized,multicenter,controlled trial of a bioartificial liver in treating acute liver failure[J].Ann Surg,2004,239(5):660-667.
[2]Fiegel HC,Kaufmann PM,Bruns H,et al.Hepatic tissue engineering:from transplantation to customized cell-based liver directed therapies from laboratory[J].J Cell Mol Med,2008,12(1):56-66.
[3]Ambros JT,Herrero-Fresneda I,Borau OG,et al.Ischemic preconditioning in solid organ transplantation:from experimental to clinics[J].Transpl Int,2007,20(3):219-229.
[4]Filippi C,Keatch SA,Rangar D,et al.Improvement of C3A cell metabolism for usage in bioartificial liver support systems[J].J Hepatol,2004,41(4):599-605.
[5]龚独辉,潘明新,姚坤厚,等.苦参碱联合DMSO大规模冻存人胎肝细胞的实验研究[J].广东医学,2009,30(4):512-514.
[6]Miyamoto Y,Suzuki S,Nomura K,et al.Improvement of hepatocyte viability after cryopreservation by supplementation of long-chain oligosaccharide in the freezing medium in rats and humans[J].Cell Transplant,2006,15(10):911-919.
[7]Katenz E,Vondran FW,Schwartlander R,et al.Cryopreservation of primary human hepatocytes:the benefit of trehalose as an additional cryoprotective agent[J].Liver Transpl,2007,13(1):38-45.
[8]Limaye LS,Kale VP.Supplementation of conventional freezing medium with a combination of catalane and trehalose results in better protection of surface molecules and functionality of hematopoietic cells[J].J Hematother Stem Cell Res,2003,12(5):553-564.
[9]Bahde R,Palmes D,Gemsa O,et al.Attenuated cold storage injury of rat livers using a modified HTK solution[J].J Surg Res,2008,146(1):49-56.
[10]Guha M,Kumar S,Choubey V,et al.Apoptosis in liverduring malaria:role of oxidative stress and implication of mitochondrial pathway[J].FASEB J,2006,20(8):1224-1226.
[11]Stevenson DJ,M organ C,M cLellan LI,et al.Reduced glutathione levels and expression of the enzymes of glutathione synthesis in cryopreserved hepatocyte monolayer cultures[J].Toxicol In Vitro,2007,21(3):527-532.
[12]Martin H,Abadie C,Heyd B,et al.N-acetylcysteine partially reverses oxidative stress and apoptosis exacerbated by Mg-deficiency culturing conditions in primary cultures of rat and human hepatocytes[J].J Am Coll Nutr,2006,25(5):363-369.
