SLE患者骨髓间充质干细胞生物学特性的研究
2011-08-13叶艳芬谭国珍曾凡钦
叶艳芬 谭国珍 曾凡钦
骨髓间充质干细胞(Marrow Mesenchymal Stem Cells,MSC)具有高度自我更新和多向分化的潜能,并具有支持造血和免疫负调节作用[1]。大量的体外细胞培养实验[2,3]证明它具有诱导免疫耐受和免疫抑制的特性。MSC移植在SLE治疗中具有较广阔的应用前景。了解SLE患者自身MSC是否异常是判断选择自体或异体MSC移植治疗SLE的重要依据。SLE患者MSC的体外扩增及其生物学特性是协助我们评价SLE患者MSC是否存在缺陷的重要方面。
1 资料与方法
1.1 一般资料 9例SLE患者均符合1997年美国风湿病学会修订的SLE分类诊断标准,SLE疾病活动评分(SLEDAI)判断疾病的活动程度。9例患者的资料见表1。另选5例性别、年龄匹配的健康者作为对照组。

表1 SLE患者临床资料及BM-MSC体外扩增的基本情况
1.2 骨髓MSC分离培养 采用羟基淀粉沉淀联合Ficoll密度梯度离心法和贴壁筛选法分离培养MSC。具体方法无菌操作下抽取骨髓液10 ml,以5×105U/ml肝素钠抗凝,先用羟基淀粉按1∶4体积加入,静置20 min,通过自然沉降去除下沉的大量红细胞,剩余的含大量红细胞的下层液体,再用淋巴细胞分离Ficoll-Hypaque常规分离单个核细胞。将上述两步分离所得的骨髓单个核细胞充分混匀,悬浮于体积分数为10%的胎牛血清DMEM-LG培养液中,按约1×106/ml密度接种于25 cm2培养瓶,置37℃、体积分数为5%的 CO2饱和湿度的培养箱中。当显微镜下观察细胞已达90%融合时,则可传代。用0.5%胰酶/乙二胺四乙酸(EDTA)(Gibco,美国)消化贴壁细胞,收集细胞并悬浮于完全培养液中,按104/cm2的密度接种于新的培养瓶中,置37℃、5%CO2饱和湿度细胞培养箱中培养,每3~4天更换1次培养液,约1周待细胞生长密度达90%左右时,进行再次传代。
1.3 MTT法检测MSC的生长情况 MTT比色法检测SLE患者第2代MSC的生长情况,作传代细胞培养的生长曲线分析。
1.4 流式细胞术检测MSC表面分子的表达 细胞培养扩增到第三代时,分别取100 ul细胞悬液与鼠抗人CD29、CD44、CD34、CD45抗体室温反应30 min。流式细胞仪检测。
2 结果
2.1 MSC的传代情况及形态 本实验进行了9例SLE患者和5例健康对照者MSC体外培养。5例健康对照者MSC均能成功体外扩增。9例患者中,5例MSC能传代扩增,传代率为55.6%。其中女性4例,男性1例,年龄16~26岁,平均年龄21.8岁;病程3~24月,平均病程9.8月;DAI评分为15~21,平均评分为18.6。5例SLE患者均合并有肾损害,其中1例合并有血液系统损害。MSC体外扩增不成功的4例SLE患者,均为女性,年龄26~45岁,平均年龄38.2岁;病程6~60月,平均病程37.5月;DAI评分为13-22,平均评分为18.5。4例SLE患者均合并有肾损害,其中2例合并有严重血液系统损害。每例患者的临床资料及MSC体外培养基本情况见表1。
2.1.1 体外扩增成功者 5例MSC体外扩增成功的SLE患者,MSC生长情况与健康对照组相比较:原代培养时,细胞形态上与健康对照组相似,但纺锤形、梭形细胞的出现稍晚,一般于2~4 d,健康对照组的一般出现于1~2 d内;随后逐渐见集落形成,原代培养的时间平均为(14.2±1.45)d,与健康对照组比较差异无统计学意义(P>0.05),细胞呈长梭形旋涡样生长(图1);传代后细胞生长较旺盛,平均传代时间(5.8±0.44)d,与健康对照组比较差异无统计学意义(P>0.05)。消化传代的细胞于24 h内完全贴壁,形态与健康对照组相似(图2)。

图1 原代培养14 d后,细胞呈长梭形旋涡样生长,几乎铺满了瓶底
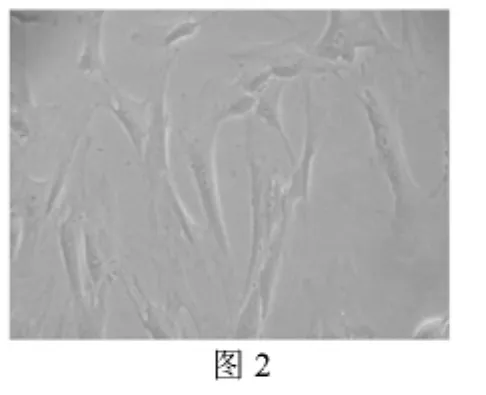
图2 消化传代的细胞于24 h内完全贴壁,形态与原代细胞相似
2.1.2 体外扩增不成功者 MSC生长情况与健康对照组相比较:同等骨髓量分离得到的单个核细胞数量与健康对照组相比明显减少,且贴壁的纺锤形、梭形细胞的出现时间明显较晚,一般于6~7 d,且仅零星分布,不成集落生长,随着培养时间的延长,其中2例可见细胞少量扩增,培养至第15天,约见20% ~30%融合的短梭形细胞生长(图3),至第30天,细胞基本自行凋亡;另2例至第18天,见部分长梭形细胞零星分布,融合少于10%(图4),至第30天细胞基本自行凋亡(图5)。

图3 原代培养15 d后,可见个别短梭形细胞生长集落

图4 原代培养18 d后,长梭形细胞零星分布,融合少于10%

图5 原代培养30 d后,部分细胞自行凋亡
2.2 MSC表面分子的表达 流式细胞术检测BM-MSC细胞表面抗原,结果显示体外扩增成功的SLE患者BM-MSC均高表达 CD29、CD44,而不表达 CD34、CD45,第 3 代 BM-MSC 纯度达95%以上,且各表面标志的表达与健康对照组相比较差异无统计学意义(P>0.05)。
2.3 MSC的生长情况 SLE患者第2代MSC生长趋势与健康对照组相似,第3~4天生长活跃,第4天后生长渐缓,第5-6进入生长平台期。见图6。

图6 SLE患者与健康对照组第二代MSC生长曲线
3 讨论
MSC是骨髓中具有高度自我更新和多向分化潜能的一群干细胞,体外培养易纯化、扩增迅速,具有支持造血、免疫调节和诱导免疫耐受的作用。本实验进行了9例SLE患者和5例健康对照者MSC的体外培养。健康对照者MSC均能成功体外扩增。9例SLE患者中,5例可以传代扩增,传代率为55.6%。有4例SLE患者MSC不能成功传代扩增,说明部分SLE患者MSC存在缺陷。另一方面,我们发现能成功传代的5例SLE患者MSC无论是从细胞形态、原代培养所需时间、平均传代时间及表面特异性分子表达均与健康对照组无明显差异,所培养、扩增的细胞能达到临床应用的要求。提示这部分SLE患者MSC生物学特性基本正常。
对两组扩增情况不同的SLE患者的临床资料进行比较,我们发现未能成功体外扩增的SLE患者具有如下的临床特征:①年龄较大。②病程较长。③合并有较严重的血液系统损害。④长期大剂量应用免疫抑制剂。
大量实验发现,MSC的生物学特性与年龄密切相关。骨髓中MSC的含量、质量以及细胞活性随着年龄的增长而下降[4,5]。骨髓中MSC的克隆数随着年龄的增长而逐渐减少,且 BM-MSC 分泌 SCF、FLT-3L、IL-6、TGF-β1 及 SDF-1 等与自我更新密切相关的细胞因子的能力逐渐下降,导致BM-MSC的增殖能力逐渐减弱。另外,也有研究者指出[6],病情较重的SLE患者,从骨髓中可提取的单个核细胞数原本就较少,所含MSC就更少。然而SLE病情轻重、病程长短及不同药物治疗是否会影响SLE患者MSC的体外扩增、生物学特性及功能,目前尚未能明确。
我们实验说明SLE患者MSC存在一定的异质性,因此应用MSC治疗SLE前,了解患者自身MSC是否存在缺陷是必需的。如果患者MSC本身存在缺陷,为避免治疗失败或复发,异体MSC输注为首选;如果 MSC本身基本正常,自体MSC输注将是有效的。SLE患者MSC的体外扩增及其生长特性是协助我们评价SLE患者MSC是否存在缺陷的重要方面,为SLE患者MSC移植的治疗方法提供了理论依据。
[1]Haynesworth SE.Baber MA Caplan.Al Surface antigen on human marrow-derived mesenchymal stem cells are detected by monoclonal antibodies.Bone,1992,13:69-80.
[2]Tse WT,Pendleton JD,Beyer,et al.Suppression of allogeneic T-cell proliferation by human marrow stromal cells:implications in transplantation.Transplantation,2003,(75):389-397.
[3]Tse WT,Pendleton JD,Beyer et al.Suppression of allogeneic T-cell proliferation by human marrow stromal cells:implications in transplantation.Transplantation,2003,(75):389-397.
[4]Kotev Emeth S,Savion N,Pri2 chen S,et al.Effect of maturation on the osteogonic response of cultured stromal bone marrow cells to basic fibroblast grow th factor.B one,2000,27:777-783.
[5]Service RF.Tissue engineering build new bone.Science,2000,289(5484):1498-1500.
[6]孙凌云,侯业义,范乐明,等.骨髓间质干细胞的初步研究.中华风湿病学杂志,2005,9(10):586-589.
