放化疗前后晚期卵巢癌中NF-κB和p53的表达及意义
2011-08-13夏玉兵魏岚赵玉霞张远航张民杰
夏玉兵 魏岚 赵玉霞 张远航 张民杰
卵巢癌是导致妇女癌症死亡的第四大主要原因。核转录因子кB(nuclear factor,кB)广泛存在位点)结合,调控多种基因表达,并被证实与许多恶性肿瘤的发病有关。近年发现,放疗治疗肿瘤的机制之一是通过p53依赖途径诱导细胞凋亡,p53基因在放疗诱导的细胞凋亡过程中起着十分重要的作用[1]。二者联合检测在卵巢癌中少有报道。本文通过应用免疫组化检测NF-кB和p53表达观察放化疗疗效。
1 资料与方法
1.1 一般资料 收集开封市肿瘤医院2006年5月至2010年9月选择Ⅲ、Ⅳ期卵巢癌卵巢癌患者43例(其中Ⅲ期32例及Ⅳ期11例),为全组患者均完成治疗前活检或细针穿刺诊断及放化疗后手术切除治疗者。按病理类型分为浆液性囊腺癌组(23例)、粘液性囊腺癌组(11例)及其他上皮癌组(包括子宫内膜样癌及未分类癌)9例。患者平均年龄53.8岁(37~75岁);全部病例均经病理及细胞学检查证实为卵巢上皮性恶性肿瘤。
1.2 治疗方法 给予直线加速器 体外15 m-X线局部野+盆腔野,第一阶段大野到DT 35~45 Gy后缩野,缩野后照射盆腔范围为肿块周围外2~3 cm,DT:180~200CGy/次,5次/周,总剂量达到50~60 Gy/5.5~6.5周。放疗同时给予顺铂40 mg/m2,阿霉素30 mg/m2,环磷酰胺0.6 g/m2静脉注射,每周1次,共3~6次,并同时水化,支持治疗。
1.3 疗效评价 按WHO实体肿瘤评价标准:完全缓解(CR)肿瘤完全消失超过4周,部分缓解(PR)肿瘤缩小50%以上不少于4周;稳定(SD),肿瘤缩小不到50%或增大不超过25%;进展(PD),肿瘤增大超过25%或出现新病灶,CR+PR合计为有效,SD+PD为无效。
1.4 统计学处理 采用SPSS 17.0软件包进行统计学分析,组间率的比较采用χ2检验,相关性分析采用Spearman相关分析,检验水准α=0.05。
2 结果
2.1 全部病例放疗结束1个月后复查,患者自觉症状都有明显好转。经B超或CT示:肿块消失32例,占74.42%;肿块缩小一半以上者8例,占18.60%;稳定2例和进展1例。
2.2 卵巢上皮的恶性肿瘤浆液性癌、粘液性癌与其他上皮性癌对同步放化疗有效性三者之比差异无统计学意义(P>0.05)。
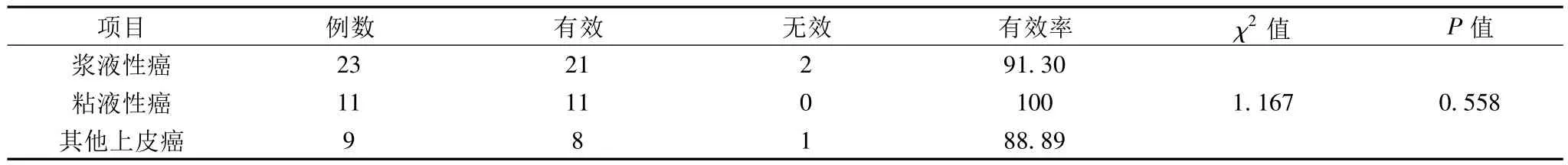
表1 不同亚型的上皮性卵巢癌对放化疗后疗效情况(例,%)
2.3 放化疗后上皮性卵巢癌NF-кB的阳性表达率明显高于治疗前,差异具有统计学意义(P=0.039)。
2.4 放化疗疗后P53的阳性表达率明显高于治疗前,差别具有统计学意义(P=0.007)。

表2 43例晚期卵巢癌患者中治疗前后NF-кB表达情况

表3 43例晚期卵巢癌患者中治疗前后p53表达情况
2.5 上皮性卵巢癌放化疗后p53和NF-кB/p65在癌中表达的相关性 在38例p53阳性浆液性卵巢癌中,NF-кB/p65有31例为阳性,p53阴性的5例浆液性卵巢癌中,NF-кB/p65有3例为阳性,两者无相关性(r=0.255,P=0.099)。
3 讨论
卵巢癌是以手术和放化疗为主要治疗手段,其中化疗加放疗在晚期卵巢癌治疗中起着越来越重要的作用[1]。近年来,放疗联合化疗治疗晚期卵巢癌后一些临床病理指标的改变少见报道。放疗作为化疗的补充对局部病灶的控制起到关键的作用,卵巢上皮癌对放射治疗属于低中度敏感。关于卵巢上皮性腺癌的放射治疗,国内已有报道,尤其是局部压迫的改善效果较好,虽然大部分患者在放疗开始1~2周出现白细胞和血小板的减少以及恶心、呕吐症状,但经给予对症支持治疗后,患者均能坚持放疗。
近年研究发现NF-кB可调控多种生长因子、黏附分子、细胞因子的表达,抑制细胞凋亡,促进肿瘤的发生和转移[2]。有研究发明抑制前列腺癌细胞中NF-кB的活化可以明显减少裸鼠肿瘤的发生率及降低肿瘤浸润、转移[3]。Wang等[4]的研究发现,在具有抗胸苷酸合酶抑制剂(如5-氟尿嘧啶)抗性的肿瘤细胞株中,存在有激活的NF-κB信号可明显增加其治疗敏感性并诱导细胞凋亡。对核转录因子NF-κB引起化疗耐药机制的研究发现,抗癌药在诱导细胞凋亡的同时通过活化核转录因子NF-κB建立细胞的快速防御机制,在凋亡启动阶段就阻断死亡信号的传递。本文研究显示放化治疗后上皮性卵巢癌NF-κB的阳性表达率明显高治疗前,差别具有统计学意义(P=0.039)。提示NF-κB在上皮性卵巢癌中高表达可能放疗和化疗药物共同作用的结果,间接的促进卵巢癌的凋亡过程。
p53基因编码的核酸蛋白通常结合于DNA的特殊区域,在DNA转录、细胞的生长和增殖以及许多新陈代谢过程中中起着重要的作用。现已证实放疗治疗肿瘤的机制之一是通过p53依赖途径诱导细胞凋亡来实现对肿瘤细胞的杀伤。放疗使肿瘤细胞的DNA受损伤,损伤的DNA与p53蛋白结合,启动p53基因,使细胞进入G1期生长抑制并诱导损伤严重的细胞进入凋亡状态[5]。本文研究显示p53基因在放疗后表达高于放疗前,差异有统计学意义。提示可能是细胞损伤激活p53表达并参与了细胞的凋亡。与韩素夏等[6]p53在宫颈细胞癌放疗后增高结果相一致。
郑成义等[7]在化疗食管鳞癌中发现NF-кB和p53呈正相关。本研究发现NF-кB和p53虽在治疗后的上皮性卵巢癌组织中都呈现递增趋势,但二者并没相关性。可能不同的组织中二者时空表达不同。
[1]刘丽影.卵巢癌综合治疗的进展与现状.癌症进展杂志,2003,1(3):120-125.
[2]Bharti AC,Aggarwal BB.Nuclear factor-kappa B and cancer:its role in prevention and therapy.Biochem Pharmacol,2002,64(5-6):883-888.
[3]Huang S,Pettaway CA,Uehara H,et al.Blockade of NF-kappa B activity in human prostate cancer cells is associated with suppression of angiogenesis,invasion,and metastasis.Oncogene,2001,20(31):4188-4197.
[4]WangW,Cassidy J.Constitutive nuclear factor-kappa B mRNA,protein overexp ression and enhanced DNA-binding activity in thymidylate synt hase inhibitor resistant tumor cells.Br J Cancer,2003,88(4):624-629.
[5]Belinsky SA,Middleton SK,Picksley SM,et al.Analysis of the K-ras and p53 pathways in X-ray-induced lung tumors in the rat.Radiat Res,1996,145(4):449.
[6]韩素夏,朱青,李明众,等.放疗前后宫颈癌细胞凋亡及Fas、p53及 bcl-2的表达 .西安医科大学学报,2001,22(6):543-545.
[7]郑成义,王朝阳,闻吉军,等.食管鳞癌中NF-кB、p53的表达及其新辅助化疗敏感性的关系.现代肿瘤医学,2009,17(12):2328-2330.
