输注表达VEGF的成纤维细胞和rAAV-VEGF基因对大鼠脑缺血保护作用的比较研究
2011-08-11邵林华孙青芳卞留贯陈亦华程振宇俞建华张晨冉顾吕伟
邵林华, 孙青芳, 卞留贯, 陈亦华, 程振宇, 郑 龙, 俞建华, 张晨冉, 顾吕伟
VEGF是一种促进血管形成和分化的重要调节因子,同时具有神经保护和神经营养的特性[1],同时它是一种分泌性蛋白,即使少量表达也能取得理想的生物学效应,因此被认为是可减轻脑缺血损伤的潜在的治疗方法[2]。但由于直接输注外源性的细胞因子,有着半衰期短、剂量大、反复操作易感染的缺点;以质粒为载体的VEGF基因转染效率一般又较低(通常小于1%),此外,如果脑缺血梗死区的神经元和星形细胞损伤较为严重,即使转染效率不低,也会导致蛋白合成障碍[3],所以VEGF基因治疗脑缺血很难在临床实际工作中展开。如何使外源性VEGF高表达,就成了国内外研究的焦点。
受到国外学者将血管生长素-1和VEGF基因修饰的骨髓间充质干细胞移植入MACO大鼠模型用以治疗脑缺血尝试的启发[4],我们想到或许可以借移植细胞来解决脑缺血区域质粒转染效率低下或转染后蛋白表达低下的问题。由于成纤维细胞能分泌多种与血管形成有关的活性肽,移植后继续生长、增殖,可能对移植处的血管化具有重要作用[5]。于是,本次实验我们就拟通过比较定向移植输注表达VEGF的成纤维细胞和原位注射rAAV-VEGF基因对大鼠脑缺血的疗效,为如何进行VEGF基因治疗急性脑缺血疾病提供实验依据。
1 材料与方法
1.1 材料 健康成年雄性SD大鼠30只,SPF级,体重250~350g,月龄10个月,由上海斯莱克实验动物有限责任公司提供。每笼饲养6只,饲养室温度控制在20℃ ~22℃ ,明暗光照每日各12h。随机分为5组:(1)假手术组,切开左侧旁正中皮肤,用直径为0.265mm的尼龙线从颈外动脉(ECA)残瑞插入约1cm到达颈内动脉(ICA)与翼腭动脉(PPA)分叉处,缝合皮下组织及皮肤后,放笼内精心饲养;(2)MCAO组,按Longa等[6]描述的大脑中动脉线栓闭塞法(MCAO)制备大鼠局灶性脑缺血动脉闭塞;(3)移植输注组;(4)直接注射组,都先按照上述方法制成MCAO,术后24h内,于大鼠前囟偏左5mm、向后3mm处钻一小孔,用微量注射器进针约3.5mm,分3个注射点注入共100μl表达 VEGF的成纤维细胞(1.0×106cells/ml)或 rAAV-VEGF载体,病毒滴度均为2.0×1012vg(vector genomes)/ml;(5)正常对照组。
1.2 方法
1.2.1 VEGF-成纤维细胞的制备
1.2.1.1 重组腺相关病毒载体 rAAV-VEGF购自上海瑞鹿生物技术有限公司,均含有CMV启动子。
1.2.1.2 成纤维细胞的制备 1个月龄SD大鼠后肢脱毛、消毒、取皮、去除皮下结缔组织,PBS反复冲洗后剪成约0.5mm3,培养、传代,实验用第3~4代的细胞。
1.2.1.3 成纤维细胞的转染和鉴定 感染前24h胰酶消化细胞,按1×105接种至6孔培养板中,待细胞约70%融合时转染。加入病毒上清,转染成纤维细胞,同时加入800μg/ml的polybrene,使其终浓度为16μg/ml,8h后换800μg/ml G418的新鲜液DMEN(10%FCS)进行筛选,直至阳性克隆出现。消化细胞,用Trizol试剂进行总RNA的抽提,用RTPCR法检测VEGF的表达,VEGF引物序列上游:5’-GGTACCTCCGAAACCATGAACTTT-3’,下游:5’-GGATCCTTCATTTCAGGTTTCTGG-3’,目的片段大小为464bp。GAPDH作为内参,引物序列:上游5’-gcaagagagaggccctcag-3’,下游 5’-tgtgagggagatgctcagtg-3’,目的片段大小为205bp。
1.2.2 VEGF mRNA 检测
1.2.2.1 脑组织总 RNA的抽提用Trizol试剂进行总RNA的抽提,使用ND-1000核酸蛋白测定仪(美国Nano Drop公司)测定RNA的浓度和质量,琼脂糖凝胶电泳检查总RNA抽提的质量。
1.2.2.2 逆转录和PCR扩增取2μg总RNA样品,根据TAKARA RT-PCR一步法试剂盒的说明进行逆转录和PCR扩增,PCR反应条件为94℃预变性 5min;94℃45s、60℃45s、72℃1min,共 25 个循环;再72℃10min,4℃保存。扩增结束后取PCR产物上样,在1%琼脂糖凝胶上进行电泳,应用凝胶成像系统对条带进行扫描分析,根据各组样本GAPDH内参的PCR产物条带的灰度值进行标准化,再比较各组VEGF基因PCR产物的相对表达量。
1.2.3 免疫组织化学染色
1.2.3.1 标本制作 术后14d,各组大鼠均断头取脑,从额端向枕端连续做脑正中冠状面切片,每片2mm,并迅速放入4%多聚甲醛固定液中,置4℃~6℃ 固定2d。常规脱水、石蜡包埋,8μm厚度切片。LDP法免疫组化染色。
1.2.3.2 操作步骤 石蜡切片常规脱蜡至水;用高压锅加热法,0.01mol/L pH 6.0柠檬酸进行抗原修复;3%过氧化氢消除内源性过氧化物酶15min;加第一抗体(VEGF)室温30min,PBS洗3次;加第二抗体(EnVision-HRP)孵育30min,PBS洗3次;DAB显色;苏木素复染胞核;常规脱水、透明、封片。
1.2.3.3 阳性细胞计数 每个标本在梗死灶边缘区或假手术组的皮质区各取10个视野统计VEGF免疫反应阳性细胞数,其均值即为该标本的阳性细胞数密度。
1.2.4 大鼠脑梗死的染色 术后14d,各组大鼠均断头取脑,取脑正中冠状面,每片2mm,切下后迅即放入37℃ 的4%TTC溶液中染色30min。观察各脑片首尾两面的梗死情况。
1.2.5 统计学处理 采用 SPSS 12.0软件包进行统计学分析,各组内数据用均数±标准差()表示,各组间差异显著性的比较采用ANOVA方法,设定P<0.05认为差异有统计学意义。
2 结果
2.1 VEGF表达的检测 根据5组大鼠大脑样本GAPDH内参的PCR产物条带灰度值标准化后,比较各组VEGF基因PCR产物的相对表达量(见图1)。结果发现:假手术组和正常对照组的VEGF表达量基本相同,移植输注组和直接注射组的VEGF基因表达均明显增高,但移植输注组增高更显著,而MCAO组VEGF基因的表达量较正常对照组低。
2.2 脑缺血边缘区 VEGF阳性细胞检测VEGF免疫组织化学染色的着色部位在细胞浆,呈黄褐色,即为VEGF阳性细胞。脑梗死后,缺血边缘区会有较多的神经细胞和内皮细胞以及少量的胶质细胞表达VEGF蛋白;而正常脑组织中只有极少数的神经细胞、胶质细胞和内皮细胞表达。本次实验中,直接注射组、移植输注组中的VEGF蛋白表达水平显著增强,MCAO组则较弱(见表1)。
2.3 大鼠缺血脑组织坏死情况 正常脑组织经TTC染色后呈均匀鲜红色,而脑缺血后的梗死区则呈灰白色。正常对照组和假手术组基本相同,而MCAO组脑梗死体积百分比较大,直接注射组、移植输注组和联合治疗组的脑梗死体积百分比明显缩小,其中联合治疗组减小最明显(见图2)。
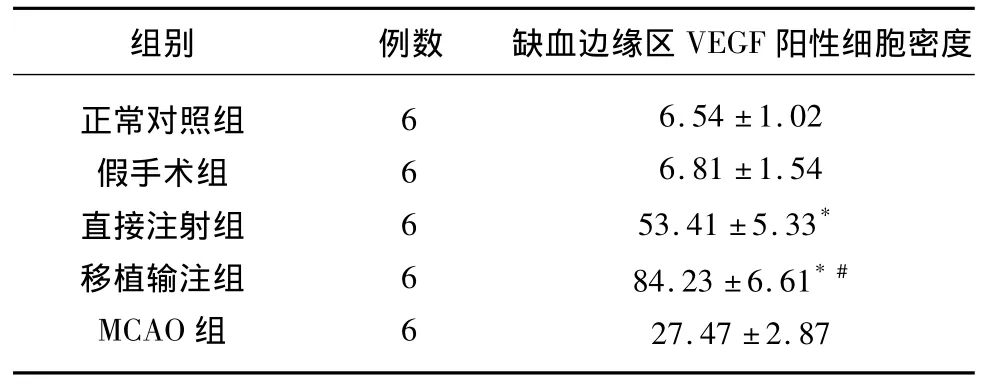
表1 各组大鼠脑缺血边缘区VEGF阳性细胞密度
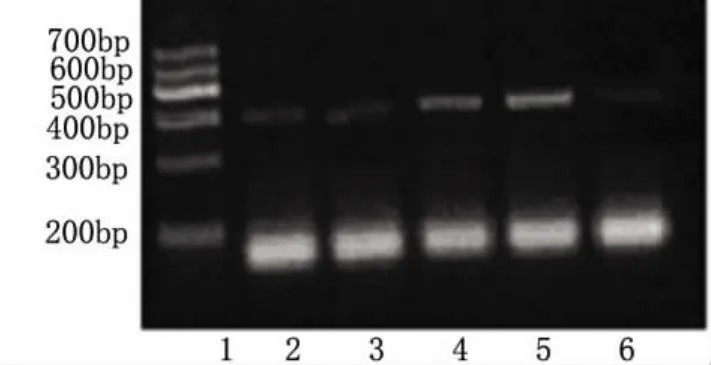
图1 5组大鼠脑组织VEGF和GAPDH mRNA表达
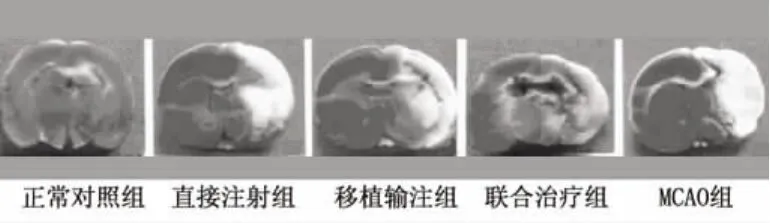
图2 各组大鼠脑梗死面积比较
3 讨论
目前,缺血性脑血管病的治疗方法主要还是通过溶栓、抗凝、抗血小板聚集等,防治血栓和扩张血管等传统方法来改善血液供应。创伤修复的现代概念认为,创伤修复是多种细胞、生长因子和细胞外基质之间相互作用的复杂的动态过程,成纤维细胞可以通过自分泌和旁分泌机制产生生长因子,作用于自身及其它细胞,调控修复过程,在整个修复过程中起着基础与关键的作用[7]。VEGF是一种促进血管形成和分化的重要调节因子,同时具有神经保护和神经营养的特性,因此给予外源性VEGF被认为是可减轻脑缺血损伤的潜在的治疗方法[8]。本次实验把转染了VEGF基因的成纤维细胞移植入脑进行缺血区域的治疗。实验结果显示,正常对照组和假手术组大鼠的脑组织中有少量的血管内皮细胞表达VEGF;MCAO组大鼠的缺血脑组织尤其是缺血边缘区的血管内皮细胞、神经细胞的VEGF表达增强,但增强的程度有限,可能仅是一种反应性的增强。而大鼠脑缺血后通过移植转染VEGF基因的成纤维细胞和直接注射导入rAAV-VEGF后,缺血边缘区的血管内皮细胞、神经细胞和胶质细胞的VEGF表达则显著增强,表明导入的外源性VEGF基因能够在缺血脑组织中表达出VEGF;此外,脑组织坏死情况也有减轻、脑梗死体积缩小,这提示导入的外源性VEGF能促进脑缺血边缘区新生血管的形成和侧支循环建立,通过改善脑血流进而保护神经元,达到减轻缺血性脑损伤的作用。移植转染VEGF基因的成纤维细胞较直接注射rAAV-VEGF组的效果更为显著,这可能与缺血区域的细胞功能受到不同程度的损伤从而影响了蛋白合成,而缺血部位移植的转染VEGF基因的成纤维细胞未受此影响有关。但此治疗手段效果与转染效率和输入细胞量有着明显的关系;此外,对新生血管功能的评价等,都有待于进一步研究。
综上所述,通过移植转染VEGF基因的成纤维细胞治疗脑缺血能够取得良好的效果,可能会成为一种较为合适而有效的治疗途径。
[1]Carmeliet P.Mechanisms of angiogenesis and arteriogenesis[J].Nat Med,2000,6(3):389-395.
[2]Sun Y,Jin K,Xie L,et al.VEGF-induced neuroprotection,neurogenesis,and angiogenesis after focal cerebral ischemia[J].J Clin Invest,2003,111:1843-1851.
[3]Losordo DW,Vale PR,Symes JF,et al.Gene therapy for myocardial angiogenesis:initial clinical results with direct myocardial injection of phVEGFl65 as sole therapy for myocardialischemia[J].Circulation,1998,98(25):2800-2804.
[4]Toyama K,Honmou O,Harada K,et al.Therapeutic benefits of angiogenetic gene-modified human mesenchymal stem cells after cerebral ischemia[J].Exp Neurol,2009,216(1):47-55.
[5]Lekic P,Mcculloch CA.Periodontal ligament cell populations:the central role of fibroblasts in creating a unique tissue[J].Anat Rec,1996,245(2):327-341.
[6]Longa EZ,W eistein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7]傅小兵,孙同柱,王亚平,等.表皮细胞生长因子与碱性成纤维细胞生长因子促进创面修复效应的比较性研究[J].中国修复重建外科杂志,1999,13(5):278.
[8]Yasuhara T,Shingo T,Kobayashi K,et al.Neuroprotective effects of vascular endothelial growth factor(VEGF)upon dopaminergic neurons in a rat model of Parkinson's disease[J].Eur J Neurosci,2004,19(6):1494-1504.
