国产与进口地塞米松棕榈酸酯注射液的人体生物等效性研究
2011-08-10朱艳荣周伦丁莉坤赵培西常瑛冯娟王婧雯文爱东第四军医大学西京医院药剂科西安市710032
朱艳荣,周伦,丁莉坤,赵培西,常瑛,冯娟,王婧雯,文爱东(第四军医大学西京医院药剂科,西安市710032)
地塞米松棕榈酸酯(Dexamethasone palmitate)为长效糖皮质激素类药,具有抗炎、抗过敏、抗休克及抗毒等作用,临床上可用于自身免疫性疾病、过敏性疾病、血液系统疾等的治疗[1]。制剂中以卵磷脂作乳化剂,将地塞米松棕榈酸酯溶解于乳糜微粒中,进入体内,乳糜微粒被巨噬细胞吞噬,使药物在病灶部位浓集;另一方面,地塞米松棕榈酸酯是由地塞米松与棕榈酸经酯化反应制得,在体内经酯酶作用缓慢水解,释放出活性物质地塞米松,从而起到持久的消炎作用和免疫抑制作用。在本研究中,笔者采用液-质联用(LC-MS)法测定人血浆中地塞米松棕榈酸酯和地塞米松的浓度,并将其应用于人体药动学及生物等效性研究中。
1 材料
1.1 仪器
1200液相色谱仪,包括真空脱气机、二元泵、自动进样器、柱温箱(美国Agilent公司);6410三重四极杆串联质谱仪,包括MassHunter工作站(美国Agilent公司);TDL80-2B低速离心机(上海安亭科学仪器厂);XW-80A涡旋仪(海门市其林贝尔仪器制造有限公司);TGL-16C高速离心机(上海安亭科学仪器厂)
1.2 试药
地塞米松对照品(批号:0129-9702)、泼尼松对照品(内标,批号:0199-9401)均为中国药品生物制品检定所提供;受试制剂:地塞米松棕榈酸酯注射液(西安力邦制药有限公司,规格:每支5 mg或10 mg,批号:070501);参比制剂:地塞米松棕榈酸酯注射液(日本三菱制药株式会社,批号:P015)。甲醇为色谱纯,乙酸铵、二氯甲烷为分析纯;试验用水为去离子水。
2 方法[2]与结果
2.1 色谱及质谱条件
色谱柱:Akasil C8(150 mm×4.6 mm,5 μm);流动相:甲醇-10 mmol·L-1醋酸铵溶液(93.5∶6.5);流量:1 mL·min-1;柱温:35 ℃;进样量:5 μL。
检测方式:气动辅助电喷雾离子化(ESI);离子极性:正离子;离子检测方式:多反应监测(MRM);地塞米松棕榈酸酯:m/z631.4→373.3,碰撞能:25 eV,裂解电压:110 V;地塞米松:m/z393.3→147.3,碰撞能:25 eV,裂解电压:90 V;泼尼松:m/z359.3→147.2,碰撞能:25 eV,裂解电压:110 V。
2.2 研究对象选择
20名健康受试者被纳入试验。经体检证明肝、肾功能、心电图、血常规、尿常规、血生化检查均无异常后签署知情同意书。试验前2周及试验期间未服用任何其他药物。试验期间统一饮食。
2.3 剂量分组及给药方案
采用标准二阶段交叉设计(Two-period Crossover Design)自身对照试验方法,将20例受试者随机分为A、B组,第1阶段A组静脉注射受试制剂,B组静脉注射参比制剂,剂量均为单剂量静脉注射1 mL(4 mg);经清洗期1周后2组交换给药品种进行第2阶段试验。试验期间禁止剧烈活动,禁止吸烟、饮酒或含药物、酒精的饮料等。每次试验前1天19∶00后即禁食。静脉注射药物前抽取空白血样5 mL,在给药后5、10、20、30 min及1、1.5、2、3、4、6、8、12、24 h时分别采静脉血5 mL置无菌肝素抗凝试管中,离心分离出血浆置无菌试管中,于-20℃保存,待测。
2.4 血浆样品的测定
2.4.1 血样处理:取含药血浆样品1 mL,加入内标(1 μg·mL-1泼尼松)溶液50 μL,涡旋混匀,再加入乙醚5 mL,涡旋3 min,于4 000 r·min-1离心10 min。取上清液于另一离心管中,于30℃水浴中氮气流吹干,流动相120 μL复溶。16 000 r·min-1离心3 min,取上清液转移至进样瓶中,进样分析。
2.4.2 特异性考察:在本试验所采用的色、质谱条件下,地塞米松、地塞米松棕榈酸酯、内标泼尼松的出峰时间分别为2.29、4.6、2.26 min。地塞米松棕榈酸酯、地塞米松和内标峰形良好,无杂峰干扰测定,表明本方法具有较高的特异性,灵敏度较高。液-质联用图谱见图1。
2.4.3 标准曲线:取10 mL塑料离心管数支,加入空白血浆1 mL,再分别加入不同量的地塞米松棕榈酸酯、地塞米松标准溶液,配成浓度分别为5.32、10.64、31.92、106.4、319.2、1 596 ng·mL-1的地塞米松棕榈酸酯以及 2.138、5.345、10.69、32.07、106.9、320.7 ng·mL-1的地塞米松含药血浆,并按“2.4.1”项下方法操作,复溶后吸取上清液转移至自动进样瓶中,进行分析。记录色谱图,分别记录地塞米松棕榈酸酯、地塞米松的峰面积As和内标峰面积Ai,计算峰面积的比值f(f=As/Ai),将f对浓度(c)作权重回归,得地塞米松棕榈酸酯、地塞米松标准曲线方程分别为:f=0.008 156c-0.015 261(r=0.999 0)、f=0.016 16c-0.008 24(r=0.999 0)。结果表明,地塞米松棕榈酸酯、地塞米松血药浓度分别在5.32~1 596 ng·mL-1、2.138~320.7 ng·mL-1范围内线性关系良好。最低定量限(LLOQ)分别为5.32、2.138 ng·mL-1。
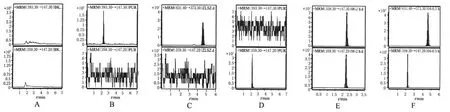
图1 液-质联用图谱A.空白血浆;B.地塞米松标准溶液;C.地塞米松棕榈酸酯标准溶液;D.内标溶液;E.地塞米松血浆样品;F.地塞米松棕榈酸酯血浆样品Fig1 LC-MS chromatogramsA.blank plasma;B.dexamethasone control;C.dexamethasone palmitate control;D.internal standard;E.dexamethasone plasma sample;F.dexamethasone palmitate plasma sample
2.4.4 精密度与回收率试验:取空白血浆1 mL,按“2.4.3”项下方法配制低、中、高3种浓度(地塞米松棕榈酸酯为10.64、53.2和532 ng·mL-1;地塞米松为5.345、32.07和213.8 ng·mL-1)的质量控制(QC)样品,各5个样本,连续测定3 d,测得地塞米松棕榈酸酯3种浓度的日内RSD<14.56%,日间RSD<7.55%,回收率分别为86.98%、85.37%、93.94%。测得地塞米松低、中、高3种浓度的日内RSD<7.96%,日间RSD<7.41%,回收率分别为81.43%、95.96%、83.78%。
2.4.5 稳定性试验 :分别配成浓度为10.64、532 ng·mL-1的地塞米松棕榈酸酯血浆及浓度为5.345、213.8 ng·mL-1的地塞米松血浆各12份(n=2),其中3份于配制好后立即按“2.4.1”项下方法操作;3份处理好的样品在室温放置6 h后按同法操作;3份于3次反复冻融后行稳定性测定;3份密封后放入冰箱中-20℃保存30 d后行稳定性测定。结果,地塞米松棕榈酸酯含量RSD为4.18%、6.19%;地塞米松含量RSD分别为5.7%、8.2%,表明样品在血浆中稳定。
2.5 药动学
20例受试者静脉滴注2种注射液后,地塞米松棕榈酸酯及地塞米松的药动学参数相近,平均药动学参数见表1。20例受试者静脉滴注2种注射液后平均药-时曲线见图2。
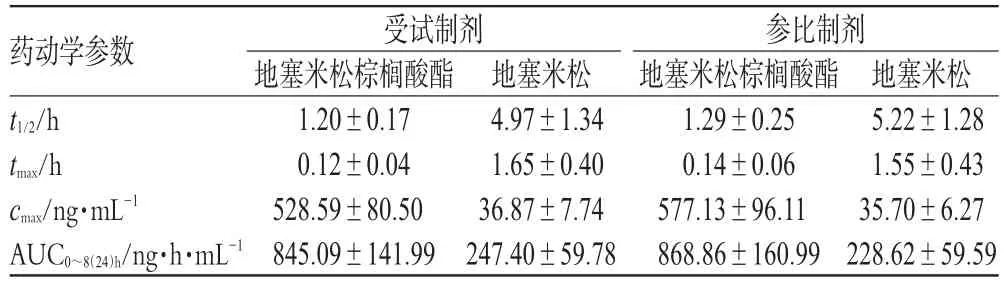
表1 20例受试者静脉滴注2种注射液后平均药动学参数(n=20)Tab1 Mean pharmacokinetic parameters of 2 kinds of injections in 20 healthy volunteers with intravenous administration(n=20)
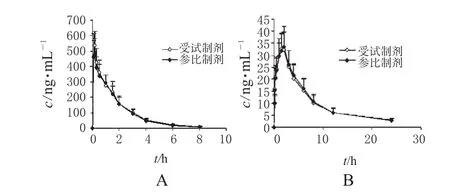
图2 20例受试者静脉滴注2种注射液后平均药-时曲线(n=20)A.地塞米松棕榈酸酯;B.地塞米松Fig2 Mean concentration-time curves of 2 kinds of injections in 20 healthy volunteers with intravenous administration(n=20)A.dexamethasone palmitate;B.dexamethasone
将受试制剂和参比制剂的AUC及cmax经对数转换后,以双单侧t检验法进行生物等效性评价,结果表明上述2个参数无显著性差异(P>0.05);对2种地塞米松棕榈酸酯及地塞米松的tmax采用非参数Wilcoxon法统计,结果无显著性差异(P>0.05)。表明受试制剂和参比制剂生物等效。
3 讨论
本试验采用LC-MS法测定血浆样品中地塞米松棕榈酸酯及地塞米松的浓度。所测定的药动学数据与报道相差不大,本方法快速、灵敏、专属性强、检测灵敏度高,可用于人体药动学及生物等效性研究。
[1]Yamamoto H,Fukuda M,Miyamoto Y,et al.A new trial liposteroid(dexamethasone palmitate)therapy for intractable epileptic seizures in infancy[J].Brain&Development,2007,299(7):421.
[2]Yan YA,Hao LA.Simultaneous quantitation of dexamethasone palmitate and dexamethasone in human plasma by liquid chromatography/tandem mass spectrometry[J].J Chromatogr B,2008,862(1):119.
