2种硫酸氢氯吡格雷片在健康人体内的药动学及生物等效性研究
2011-08-10吴寅栗艳丁黎王婧雯贾艳艳刘渝杨林文爱东第四军医大学西京医院药剂科西安市7003中国药科大学药物分析教研室南京市0009
吴寅,栗艳,丁黎,王婧雯,贾艳艳,刘渝,杨林,文爱东#(.第四军医大学西京医院药剂科,西安市 7003;.中国药科大学药物分析教研室,南京市 0009)
氯吡格雷(Clopidogrel)是继噻氯匹定后第2个噻吩并吡啶药物,其可选择性地、不可逆地与血小板膜表面一种嘌呤性二磷酸腺苷(ADP)受体结合,是一种高选择性ADP受体阻滞药。氯吡格雷阻滞ADP对腺苷酸环化酶的抑制作用,从而促进腺苷-3',5'-环化一磷酸(cAMP)依赖的、前列腺素E1(PGE1)刺激的舒血管物质刺激磷酸蛋白(VASP)的磷酸化[1],抑制纤维蛋白原受体(GPⅡb/Ⅲa)活化进而抑制血小板聚集。此外,氯吡格雷可降低血小板选择蛋白(P-selectin,CD62)的表达,表明其可抑制血小板的活化。临床上广泛应用于心肌梗死、脑梗死等心脑血管疾病的治疗,但剂量需要个体化。本试验研究国产与进口氯吡格雷片在健康人体内的药动力,并评价2种片剂的生物等效性,旨在为新药报批与临床合理用药、实施个体化用药方案提供理论依据。
1 材料
1.1 仪器
Agilent 1200液相色谱-质谱联用仪,含双高压泵、自动进样器、柱温箱、电喷雾离子化接口、四极杆质谱检测器及Agilent Chemstation(A.10.02)(美国Agilent公司);BT255电子天平(瑞士Sartorius公司);Milli-Q纯水仪(美国Millipore公司);TG16-WS型离心机(上海卢湘仪仪器厂);XW-80A涡旋振荡混合器(上海医科大学仪器厂)。
1.2 试药
受试制剂:硫酸氢氯吡格雷片(深圳信立泰药业股份有限公司,规格:每片25 mg,批号:090501S);参比制剂:硫酸氢氯吡格雷片(商品名:波立维,杭州赛诺菲安万特民生制药有限公司,规格:每片75 mg,批号:2364);氯吡格雷对照品(中国药品生物制品检定所,纯度:99.4%,批号:100819-200601);内标:米非司酮对照品(美国Sigma-Aldrich公司,纯度:98%,批号:M8046-100MG)。甲醇为色谱纯,乙醚、甲酸为分析纯,试验用水为去离子纯净水。
2 方法
2.1 色谱及质谱条件
色谱柱:Hanbon Hedera ODS-2(150 mm×2.1 mm,5 μm);流动相:甲醇-0.1%甲酸水溶液(梯度洗脱);流速:0.25 mL·min-1;柱温:35 ℃;进样量:5 μL。
离子检测方式:多重反应监测(MRM);离子极性:正离子(positive);离子化方式:气动辅助电喷雾离子化(ESI);检测对象:氯吡格雷m/z322.1→212.1,裂解电压:105 V,碰撞能量:12 eV;内标(米非司酮)m/z430.3→372.3,裂解电压:105 V,碰撞能量:20 eV;干燥气流速:10 L·min-1;雾化室压力:40 psi;干燥气温度:350℃。全扫描质谱图见图1。
图1 全扫描质谱图A.氯吡格雷;B.内标米非司酮Fig1 Full scan mass spectrumA.clopidogrel;B.mifepristone
2.2 受试者选择
选择健康男性志愿者20名,年龄18~40岁,平均(34.5±2.0)岁,体重(62.1±2.6)kg(标准体重(1±10%)),体重指数(BMI)在19~24 kg·m-2范围内,身高160~180 cm。于试验前进行全面的体格检查,肝肾功能、心电图、血尿常规均正常。受试者无既往病史和药物过敏史,精神状态良好。受试前4周内未服用过其他药物。受试者在服药后禁止剧烈活动,采血期间禁烟、酒和含咖啡因类饮料。在临床医师的监护下,观察受试者的耐受性和不良反应的发生情况以及一般状况。一旦出现严重不良反应,应采取相应的急救措施和治疗。试验方案经第四军医大学西京医院医学伦理委员会批准通过,受试者均自愿签署知情同意书。
2.3 给药方案及血样采集
20名受试者随机分为2组,每组10人。试验前禁食过夜,次日晨空腹单剂量口服受试制剂或参比制剂各75 mg,用250 mL温开水送服,服药后2 h内不饮水,4 h后进食统一食物(低脂肪饮食)。受试者于服药前0 h及服药后0.25、0.5、0.75、1、1.5、2、3、4、6、8、11、14、24、36 h时自肘静脉分别采血约4 mL,置肝素化离心管中,3 000 r·min-1离心15 min取血浆,-20 ℃保存,供血药浓度测定使用。经过清洗期1周后,进行交叉试验。
2.4 试验溶液的配制
2.4.1 氯吡格雷标准溶液:准确称取硫酸氢氯吡格雷对照品13.11 mg(含氯吡格雷10.02 mg),置于10 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得浓度为1.002 mg·mL-1的氯吡格雷贮备液。精密量取该贮备液1.0 mL置于10 mL容量瓶中,加入甲醇稀释至刻度,摇匀,即得浓度为100.2 μg·mL-1的氯吡格雷甲醇溶液;再依次稀释,配成浓度为10.02、1.002、501.2 、100.2、50.12、10.02、5.012 、1.002、0.5012、0.1002 ng·mL-1的系列氯吡格雷甲醇标准溶液。
2.4.2 内标溶液:准确称取非司酮对照品10.06 mg的,置于10 mL容量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得浓度为1.006 mg·mL-1的内标贮备液。精密量取该贮备液1.0 mL,置于10 mL容量瓶中,加入甲醇稀释至刻度,摇匀,即得浓度为100.6 μg·mL-1米非司酮甲醇溶液;再依次稀释,配成浓度为10.06、1.006 、100.6 ng·mL-1的内标甲醇溶液。
2.5 血浆样品处理
于10 mL离心管中,加入血浆样品1 mL,加入内标(10.06μg·mL-1米非司酮)溶液 10 μL,涡旋混匀,加入乙醚4 mL,涡旋3 min。于4 000 r·min-1离心10 min,吸取上层有机相至另一10 mL离心管中,于25℃水浴以氮气流吹干。残渣以150 μ L流动相(甲醇-0.1%甲酸水溶液)(90∶10)溶解,涡旋2 min,转移至1.5 mL离心管中,15 600 r·min-1离心5 min,取上清液至自动进样器样品瓶中,进样5 μL,进行液-质联用(LC-MS)分析。
2.6 方法学验证
2.6.1 专属性考察:在“2.1”项色谱条件下测得空白血浆、空白血浆加氯吡格雷对照品和内标及受试者服药1.5 h后血浆样品的色谱图见图2。在本试验所采用的LC-MS条件下,氯吡格雷酸出峰时间在2.7 min,内标出峰时间在2.4 min。氯吡格雷酸和内标峰形良好,无杂峰干扰测定(见图2)。本方法测定血浆中氯吡格雷,具有较高的专属性。

图2 典型多反应监测色谱图A.空白血浆;B.空白血浆+内标+氯吡格雷对照品;C.血浆样品;1.氯吡格雷;2.米非司酮Fig2 Typical multiple reaction monitoring chromatogramsA.blank plasma;B.blank plasma+internal standards+clopidogrel;C.plasma sample;1.clopidogrel;2.mifepristone
2.6.2 标准曲线的制备:精密吸取不同量“2.4.1”项下各浓度氯吡格雷甲醇标准溶液,各置于10 mL玻璃离心管中,精密加入空白血浆1 mL,涡旋混匀,配成含氯吡格雷浓度分别为0.005、0.02、0.1、0.3、1.0、3.0、6.0、10.0 ng·mL-1的血浆样品。按“2.5”项下方法操作,并进行色谱分析,记录氯吡格雷峰面积(As)和内标峰面积(Ai)的比值f。以比值f(f=As/Ai)对血药浓度(c)进行回归分析,得标准曲线方程:f=0.332 4×c+0.000 804 6(r=0.998 7,n=5),权重系数w=1/c2。结果表明,氯吡格雷血药浓度在0.005~10.0 ng·mL-1范围内线性关系良好,其中最低定量限(LLOQ)为0.005 ng·mL-1。
2.6.3 精密度与准确度试验:按“2.6.2”项下方法配制氯吡格雷低、中、高3种浓度(0.01、0.6、9.0 ng·mL-1)的血浆样品各5份。同法操作,进行LC-MS分析,测定血浆中氯吡格雷日内、日间精密度及提取、方法回收率。结果,氯吡格雷提取回收率>70%,日内和日间RSD均<15%,表明回收率和精密度良好。精密度及回收率试验结果见表1。
2.6.4 稳定性考察:按“2.6.2”项下方法配制氯吡格雷低、中、高(0.01、0.6、9.0 ng·mL-1)3种浓度的血浆样品。按“2.5”项下方法同法操作,3份于配制好后立即处理,进行LC-MS分析,记录色谱图;3份配制好后反复冻融3次后分析;3份于室温放置9 h后分析;3份配制好后放入-20℃冰箱中冰冻保存1.5个月后取出化冻分析;3份配制好后放入-20℃冰箱中冰冻保存2.5个月后取出化冻,进行分析。结果(见表2)表明,氯吡格雷血浆样品在室温下放置9 h、反复3次冻融、冰冻放置1.5个月和2.5个月条件下均稳定性良好。
表1 精密度及回收率试验结果(±s,n=5)Tab 1Results of precision and recovery test(±s,n=5)
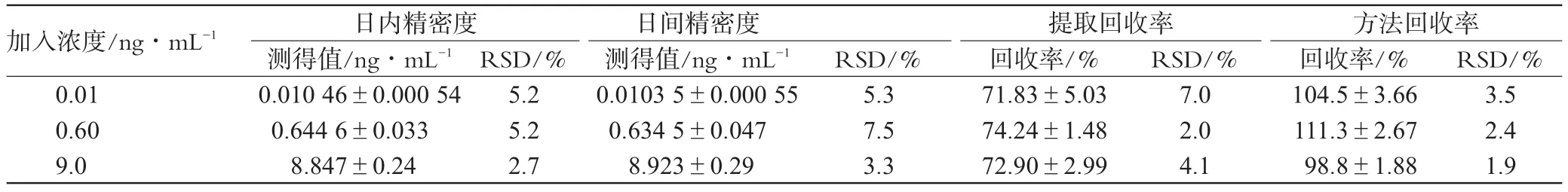
表1 精密度及回收率试验结果(±s,n=5)Tab 1Results of precision and recovery test(±s,n=5)
0.01 0.60 9.0 0.010 46±0.000 54 0.644 6±0.033 8.847±0.24 5.2 5.2 2.7 0.0103 5±0.000 55 0.634 5±0.047 8.923±0.29 5.3 7.5 3.3 71.83±5.03 74.24±1.48 72.90±2.99 7.0 2.0 4.1 104.5±3.66 111.3±2.67 98.8±1.88 3.5 2.4 1.9
表2 稳定性考察结果(±s ,n=3)Tab 2Results of stability test(±s ,n=3)
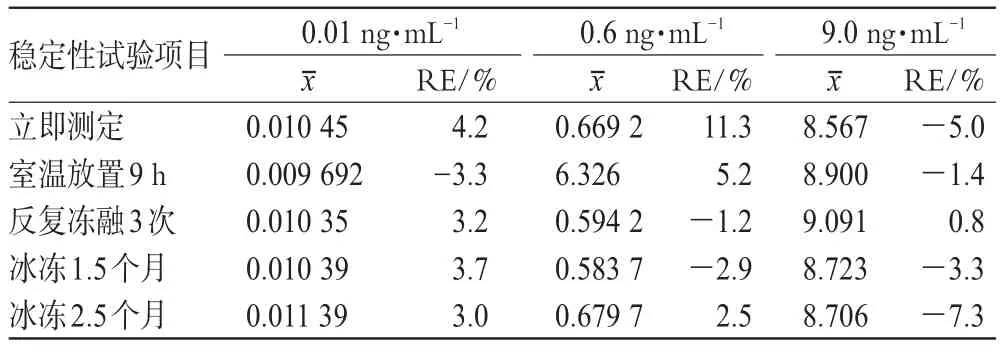
表2 稳定性考察结果(±s ,n=3)Tab 2Results of stability test(±s ,n=3)
立即测定室温放置9 h反复冻融3次冰冻1.5个月冰冻2.5个月0.010 45 0.009 692 0.010 35 0.010 39 0.011 39 4.2-3.3 3.2 3.7 3.0 0.669 2 6.326 0.594 2 0.583 7 0.679 7 11.3 5.2-1.2-2.9 2.5 8.567 8.900 9.091 8.723 8.706-5.0-1.4 0.8-3.3-7.3
3 结果
3.1 药-时曲线
20名健康男性志愿者随机交叉单剂量口服硫酸氢氯吡格雷片受试制剂或参比制剂75 mg后,平均药-时曲线见图3。
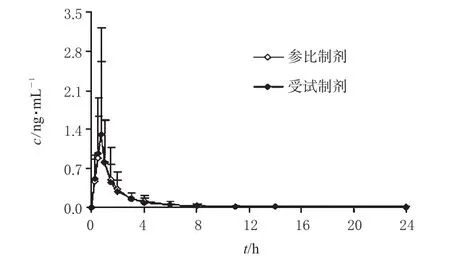
图3 20名健康志愿者单剂量口服2种硫酸氢氯吡格雷片75 mg后的平均药-时曲线Fig3 Mean plasma concentration-time curves of clopidogrel in 20 healthy volunteers after single oral dose of Clopidogrel hydrogen sulfate tablets 75 mg
3.2 数据处理
数据处理采用BAPP 3.0软件,以非房室依赖型方法进行计算。cmax和tmax为实测值;消除相半衰期(t1/2)、清除率(CL/F)、表观分布容积(Vd/F)、曲线下面积(AUC)等分别用公式计算。有关药动学参数见表3。
3.3 生物等效性评价
20名健康男性志愿者口服硫酸氯吡格雷片受试制剂或参比制剂75 mg后,相对生物利用度以氯吡格雷计为(108.9±52.2)%。对受试制剂和参比制剂的药动学参数cmax、AUC0~36h经对数转换后,先用双交叉试验设计的方差分析,再进行双单侧t检验和90%置信区间法进行生物等效性评价。结果表明,氯吡格雷的cmax、AUC0~36h、AUC0~∞在 2 制剂间均无显著性差异,均拒绝生物不等效假设。受试制剂中氯吡格雷的cmax、AUC0~36h、AUC0~∞的 90%置信区间分别为 96.0%~130.2%、84.5%~117.5%、86.2%~118.2%。对氯吡格雷的tmax采用非参数法(Wilcoxon符号秩检验)检验法进行评价,2制剂氯吡格雷的tmax经非参数法检验无显著性差异(P>0.05)。以上结果表明,受试制剂与参比制剂生物等效。
表3 20名健康志愿者单剂量口服2种硫酸氢氯吡格雷片75 mg的主要药动学参数(±s ,n=20)Tab3 Main pharmacokinetics parameters of clopidogrel in 20 healthy volunteers after single oral dose of Clopidogrel hydrogen sulfate tablets 75 m(g±s ,n=20)

表3 20名健康志愿者单剂量口服2种硫酸氢氯吡格雷片75 mg的主要药动学参数(±s ,n=20)Tab3 Main pharmacokinetics parameters of clopidogrel in 20 healthy volunteers after single oral dose of Clopidogrel hydrogen sulfate tablets 75 m(g±s ,n=20)
t1/2/h tmax/h cmax/ng·mL-1 CL/F/L·h-1 Vd/F/L AUC0~36 h/ng·h·mL-1 AUC0~∞/ng·h·mL-1 F/%6.6±4.9 0.64±0.21 1.724±1.38 51.87±34.12 461.4±354.4 1.996±1.223 2.114±1.209 108.9±52.2 6.3±7.0 0.68±0.27 1.752±1.856 53.58±33.2 436.3±449.3 2.112±1.493 2.177±1.500
4 讨论
氯吡格雷作为一种血小板聚集抑制剂,在临床上广泛应用。但由于氯吡格雷是一种前体药物,在肝脏代谢后,血浆中大约85%是对血小板聚集并无影响的羧酸盐衍生物,母体化合物的血浆浓度很低,所以检测困难。常见测定方法主要有高效液相色谱法和LC-MS法[2,3],但均具有优缺点。本研究建立以LC-MS法测定人血浆中氯吡格雷浓度的方法,灵敏度高、专属性好、分析时间短,满足氯吡格雷浓度分析及测定生物利用度的要求。
目前国内尚未见关于氯吡格雷生物等效性的报道,本研究中,20名健康受试者单剂量口服2种氯吡格雷制剂75 mg后,2组之间各主要药动学参数均无显著性差异(P>0.05),说明2种制剂具有生物等效性。20例受试者的cmax和AUC0~36h个体间的差异较大,但同一受试者服用受试制剂或参比制剂的cmax和AUC0~36h较相近,这提示氯吡格雷存在一定的个体差异,这一特点在临床使用时应加以注意。
[1]Geiger J,Brich J,Honig-Liedl P,et al.Specific impairment of human platelet P2Y(AC)ADP receptor-mediated signaling by the antiplatelet drug clopidogrel[J].Arteriascler Thromb Vascbiol,1999,25(Suppl 2):S9.
[2]季宏建,周小华,邹建军,等.LC-MS/MS法测定人血浆中氯吡格雷的浓度及其药动学研究[J].中国药房,2009,20(8):584.
[3]樊宏伟,邹建军,林 松,等.LC-MS/MS法同时测定人血浆中氯吡格雷及其羧酸代谢物的浓度[J].中国新药与临床杂志,2008,27(11):811.
