丹参制剂中丹参不同提取方法的合理性评价Δ
2011-08-10胡鹏翼岳鹏飞伍振峰江西中医学院现代中药制剂教育部重点实验室南昌市330004
郑 琴,胡鹏翼,杨 明,岳鹏飞,伍振峰,王 芳(江西中医学院现代中药制剂教育部重点实验室,南昌市330004)
丹参为唇形科植物丹参Salvia miltiorrhizaBge.的干燥根及根茎。近年来,随着对丹参基础及临床药理学研究的不断深入,以丹参为主药的单方或复方制剂品种繁多,如丹参片、复方丹参片、复方丹参滴丸、冠心丹参片、冠心丹参胶囊等。这些品种均由丹参、三七加减药味组成,其功能主治大致相同,均用于治疗心脑血管疾病。但其中丹参的提取工艺却不尽相同,如丹参片、复方丹参片、复方丹参滴丸中的丹参采用热回流提取,而冠心丹参片采用先渗漉再热回流提取;复方丹参滴丸采用丹参与三七合煎,而丹参片、复方丹参片、冠心丹参片均采用丹参单提[1]。提取工艺不同可能导致药效物质不同,从而影响最终产品的疗效[2,3]。本文通过比较不同工艺对丹参有效成分(丹参酮ⅡA、丹酚酸B)的影响,通过对浓缩过程中丹参有效成分含量的变化进行监测,找出影响有效成分含量的关键步骤,为改进丹参制剂中丹参的生产工艺提供理论依据,从而保证制剂的质量和疗效。
1 仪器与试药
1200高效液相色谱(HPLC)仪(美国Aligent公司);UV2500紫外检测器(日本岛津公司);B-490BVCHI旋转蒸发器(厦门精艺兴业科技有限公司);HH-4数显恒温水浴锅(常州国华仪器有限公司);KDM控温电热套(鄄城华鲁电热仪器有限公司);BS124S分析天平(德国赛多利斯科学仪器(北京)有限公司);ZRS-8G智能溶出仪(天津市天大天发科技有限公司)。
丹参饮片(购于北京同仁堂(亳州)饮片有限责任公司,经江西中医学院现代中药制剂教育部重点实验室刘荣华教授鉴定为唇形科植物丹参S.miltiorrhigaBge.的干燥根及根茎);丹参酮ⅡA、丹酚酸B对照品(中国药品生物制品检定所,批号分别为110766-200417、852-9903);甲醇、乙腈为色谱纯,水为重蒸馏水。
2 方法
2.1 不同提取方法对丹参制剂中丹参有效成分的影响[1]
2.1.1 丹参片中丹参的提取 取丹参45 g,加8倍量90%乙醇,75℃回流1.5 h,滤过,滤液于50℃减压浓缩至稠膏(20℃,相对密度为1.2);药渣加8倍量水煎煮1 h,滤过,滤液50℃减压浓缩至稠膏(20℃,相对密度为1.2),即得。
2.1.2 复方丹参片中丹参的提取 取丹参45 g,加8倍量95%乙醇,75℃回流1.5 h,滤过,滤液于50℃减压浓缩至稠膏(20℃,相对密度为1.2);药渣加8倍量50%乙醇,热回流1.5 h,滤过,滤液于50℃减压浓缩至稠膏(20℃,相对密度为1.2);药渣加8倍量水热回流2 h,滤过,滤液于50℃减压浓缩至稠膏(20℃,相对密度为1.2),即得。
2.1.3 复方丹参滴丸中丹参的提取 取丹参45 g、三七粗粉14.1 g,加8倍量水热回流1.5 h,滤过,药渣继续加8倍量水热回流1.5 h,滤过,合并2次提取液,50℃水浴中蒸发至稠膏(20℃,相对密度为1.1),加乙醇至溶液含醇70%,4℃静置12 h,4 000 r·min-1离心15 min,取上清液,50 ℃减压浓缩至稠膏(20℃,相对密度为1.2),即得。
2.1.4 冠心丹参片中丹参的提取 取丹参(中粉)45 g,用90%乙醇作溶剂进行渗漉,流速为1 mL·min-1,收集渗漉液约315 mL,滤液于50℃减压浓缩至稠膏(20℃,相对密度为1.2);药渣加8倍量水煎煮2次,每次1 h,合并煎液,滤过,滤液于50℃减压浓缩至稠膏(20℃,相对密度为1.2),即得。
2.1.5 色谱条件 (1)丹参酮ⅡA:色谱柱为Hypemil ODS C18(250 mm×4.6 mm,5 μm),流动相为甲醇-水(73∶27),检测波长为270 nm,流速为1 mL·min-1,柱温为30℃,进样量为20 μL。(2)丹酚酸B:色谱柱为Agilent C18(250 mm×4.6 mm,5 μm),流动相为甲醇∶乙腈∶甲酸水(1∶59)=25∶10∶65,检测波长为286 nm,流速为1.0 mL·min-1,柱温为30℃,进样量为20 μL。
2.1.6 线性关系考察 (1)精密称取丹参酮ⅡA对照品4.80 mg,置于10 mL量瓶中,加入甲醇溶解稀释至刻度作为母液。分别取适量母液,加甲醇稀释至浓度为4.80、9.60、19.20、38.40、57.60、96.0 μg·mL-1的溶液,作为丹参酮ⅡA系列对照品溶液。分别取上述溶液各20 μL进样,以峰面积积分值(Y)对进样量(X)进行线性回归,得回归方程为Y=105.41X-19.951(r=0.999 5,n=6)。结果表明,丹参酮ⅡA进样量在0.096~1.920 μg范围内与峰面积积分值呈良好线性关系。(2)精密称取丹酚酸B对照品5.01 mg,置10 mL量瓶中,加入甲醇溶解稀释至刻度作为母液。分别取适量母液,加流动相稀释至浓度为5.01、10.02、20.04、30.06、40.08、50.10 μg·mL-1的溶液,作为丹酚酸B系列对照品溶液。分别取上述溶液各20 μL进样,以峰面积积分值(Y)对进样量(X)进行线性回归,得回归方程为Y=19.971X-1.243 9(r=0.999 6,n=6)。结果表明,丹酚酸B进样量在0.1~1.0 μg范围内与峰面积积分值呈良好线性关系。
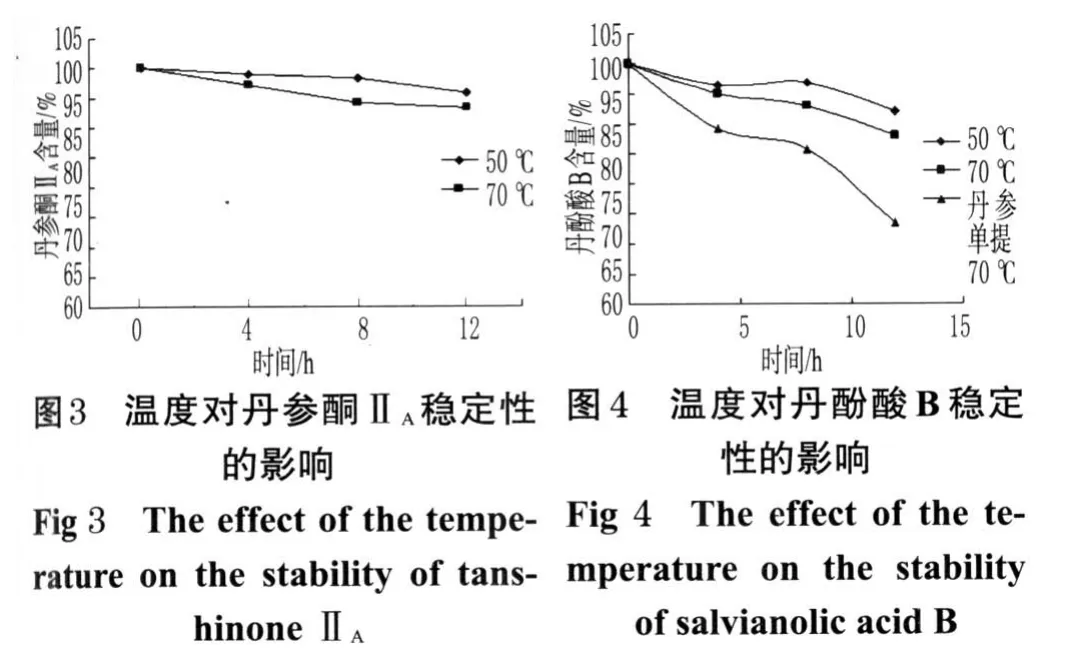
2.2 浓缩温度对提取液中有效成分稳定性的影响
取“2.1”项下复方丹参片中丹参95%醇提液5 mL(若干份),分置若干个试管中,再置于50、70℃水浴中,分别于4、8、12 h取出,按上述色谱条件测定丹参酮ⅡA含量。分别取“2.1”项下复方丹参滴丸中丹参水提液、丹参片中丹参水提液5 mL(若干份),分置若干个试管中,再置于50、70℃水浴中,分别于4、8、12 h取出,按上述色谱条件测定丹酚酸B含量。
2.3 丹参提取液浓缩前后有效成分含量变化
2.3.1 丹参酮ⅡA含量的变化 将丹参95%和90%醇提液滤过,精密量取续滤液1 mL,置于25 mL量瓶中,加甲醇稀释至刻度,摇匀,按上述色谱条件测定丹参酮ⅡA的含量;将丹参50%醇提液滤过,取续滤液,同法测定丹参酮ⅡA的含量。精密称取95%、90%醇提取浓缩得到的丹参浸膏约0.4 g,置具塞棕色瓶中,精密加入甲醇25 mL,密塞称定重量,超声处理15 min,放冷,再称定重量,用甲醇补足失重,摇匀,滤过,取续滤液,同法测定丹参酮ⅡA的含量;精密称取50%醇提取浓缩得到的丹参浸膏约0.8 g,置具塞棕色瓶中,精密加入甲醇10 mL,密塞称定重量,超声处理15 min,放冷,再称定重量,用甲醇补足失重,摇匀,滤过,取续滤液,同法测定丹参酮ⅡA的含量。
2.3.2 丹酚酸B含量的变化 精密量取丹参95%、90%醇提液续滤液1 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,按上述色谱条件测定丹酚酸B的含量;将丹参的50%醇提液及水提液滤过,精密量取续滤液1 mL,置25 mL量瓶中,加水稀释至刻度,摇匀,同法测定丹酚酸B的含量。另精密称取90%、95%醇提取浓缩得到的丹参浸膏约1.0 g,置10 mL量瓶中,加水适量,超声处理30 min,放冷,加水至刻度,摇匀,滤过,取续滤液,同法测定丹酚酸B的含量;精密称取50%醇及水提取浓缩得到的丹参浸膏约0.5 g,置25 mL量瓶中,加水适量,超声处理30 min,放冷,加水至刻度,摇匀,滤过,取续滤液,同法测定丹酚酸B的含量。
3 结果
3.1 不同提取方法下各丹参制剂的丹参提取液中有效成分的含量比较
不同方法提取的丹参提取液,有效成分的含量差异较大。渗漉法提取的丹参酮ⅡA和丹酚酸B含量均最高。不同提取液中丹参酮ⅡA含量见图1;不同提取液中丹酚酸B含量见图2。

3.2 浓缩温度对提取液中丹参酮ⅡA、丹酚酸B稳定性的影响
丹参酮ⅡA在95%醇提液中较稳定,温度对其影响较小。丹酚酸B在水溶液中稳定性较差,温度越高损失越大,因此选择浓缩的温度为50℃,从而降低丹酚酸B的含量损失。丹参片、复方丹参片、冠心丹参片中丹参均采用单提的方法,而复方丹参滴丸采用丹参和三七合提的方法,温度对丹参和三七合提液中丹酚酸B的稳定性影响较丹参单提液中丹酚酸B的稳定性影响小,因此推断三七能增加丹酚酸B的稳定性。温度对丹参酮ⅡA、丹酚酸B稳定性的影响分别见图3、图4。
3.3 丹参提取液浓缩后有效成分含量变化
浓缩对丹酚酸B含量变化影响较大,各种浓缩液中其含量均不同程度的降低。复方丹参片提取液中的丹酚酸B则相对稳定,浓缩后损失率为3.53%。而对于丹参酮ⅡA,则醇浓度越高其损失量越小:丹参片、冠心丹参片均采用90%醇提,浓缩后丹参酮ⅡA的损失率分别为15.29%、25.87%;复方丹参片采用95%醇提,浓缩后丹参酮ⅡA基本无损失。浓缩对丹参酮ⅡA、丹酚酸B含量的影响分别见图5、图6。

4 讨论
丹参中的有效成分丹酚酸B含有多个酚羟基、酯键以及羟基,在受热情况下容易发生分解、氧化以及脱羟基的反应。有文献表明,丹参药材水提液随着加热时间的延长,丹酚酸B等大分子物质水解为丹参素,含量降低[4]。本试验也表明,由于渗漉法无需加热,故提取的丹酚酸B的含量明显高于热回流法,与文献报道一致;由于丹酚酸B在水溶液中稳定性较差[5,6],因此丹参提取液浓缩后丹酚酸B含量损失较大,建议可采用低温浓缩或减少受热时间的喷雾或微波干燥。
2010年版《中国药典》(一部)中规定丹参药材中含丹参酮ⅡA不得少于0.20%。据此,按复方丹参片处方推算,薄膜衣片每片相当于丹参药材0.45 g,则丹参酮ⅡA含量的理论值应为每片不低于0.9 mg,而复方丹参片的规定值为每片不低于0.2 mg,仅为理论值的22%。同样,冠心丹参胶囊中丹参酮ⅡA为每粒不低于0.3 mg,为理论值的75%,这可能与冠心丹参片中丹参活性成分的提取率较高有关,且本文试验结果也证明了丹参采用渗漉法提取,其丹参酮ⅡA提取率较高。
据文献报道[7,8],丹参酮ⅡA醇提液随着温度升高,降解速度加快;随着醇浓度降低,降解速度加快。因此,复方丹参片中丹参酮ⅡA采用95%醇提,醇浓度较高,丹参酮ⅡA较为稳定,浓缩时含量变化较小;而冠心丹参片、丹参片提取的乙醇浓度为90%,醇浓度稍低,因此浓缩时丹参酮ⅡA的含量明显降低。
渗漉法提取的丹参酮ⅡA、丹酚酸B的含量均最高,且丹参酮ⅡA在95%乙醇中较稳定,因此丹参的提取采用95%乙醇渗漉或动态逆流冷提工艺,再采用不同浓度的醇或水提,并在低温(<50℃)下进行浓缩,有利于保证有效成分的含量和稳定性。
[1]国家药典委员会编.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:905、965.
[2]姬晓鹏,蒋 斌,潘 琳,等.复方丹参片与丹参片对冠状动脉粥样硬化患者血小板活化抑制作用的比较[J].中国药房,2010,21(19):1 805.
[3]陈日来,李玉珍,陈晓凯,等.复方丹参片与滴丸中丹酚酸B和丹参酮ⅡA含量的比较研究[J].中国药房,2005,16(20):1 595.
[4]汤丽萍.复方丹参片中丹参的提取干燥工艺的初步研究[J].海峡药学,2008,20(3):17.
[5]富志军,林以宁,亢俊伟.浓缩、精制及干燥对复方丹参提取液中水溶性成分的影响[J].安徽中医学院学报,2003,22(2):52.
[6]熊志玲.复方丹参片中丹酚酸B保留率影响因素考察及工艺改进研究[D].广州:广州中医药大学,2008.
[7]贾艳宁,吴丽红,张 庆.复方丹参片丹参提取物质量的影响[J].黑龙江医药,2004,5(17):365.
[8]韩晓珂,刘汉清,张 明,等.渗漉法和回流法提取丹参药渣中脂溶性成分的比较研究[J].现代中药研究与实践,2009,23(1):61.
