非病毒诱导体系高效诱导脐带来源间充质干细胞向胰岛细胞分化
2011-08-09赵春华
李 晶,朱 莉,赵春华
中国医学科学院 北京协和医学院 基础医学研究所组织工程研究中心,北京 100005
国内外研究已经使用胚胎干细胞及诱导多潜能干细胞在一定条件下体外诱导分化成为胰岛素分泌细胞,且获得的细胞具有一定体内外分泌功能[1-3],该类研究为细胞替代移植治疗糖尿病提供了思路,但细胞来源少,细胞成瘤性及伦理限制等问题限制了其向临床转化。本课题组以往研究表明,骨髓、脂肪及脐带来源间充质干细胞 (mesenchymal stem cell,MSC)具有亚全能干细胞[4]的特征,其能向多胚层分化且具有低免疫原性的特征[5],同时该种细胞来源广泛并且不受伦理学限制,有望成为临床细胞移植的良好种子细胞。本研究将采用可用于临床的非病毒诱导体系探讨使用UC-MSC获得胰岛细胞的方法,并研究诱导后细胞是否具有与胰岛相似的功能,从而为细胞移植治疗糖尿病提供依据。
材料和方法
试剂 高糖DMEM培养基购自美国Hyclone公司,DMEM/F-12、胎牛血清、青链霉素和胰蛋白酶-EDTA购自美国Gibco公司,维甲酸、exendin-4、尼克酰胺、碱性成纤维细胞生长因子 (basic fibroblast growth factor,bFGF)、表皮细胞生长因子 (epidermal growth factor,EGF)均购自美国Sigma公司,Activin A购自英国Pepro Tech公司,Trizol购自美国 Invitrogen公司,Oligo dT、M-MLV逆转录酶、Taq DNA聚合酶、dNTP和RNA酶抑制剂购自日本Takara公司,小鼠抗人胰岛素单克隆抗体购自美国Santa Cruz公司,兔抗人 C-肽多克隆抗体购自英国ABcam公司,罗丹明标记的山羊抗小鼠IgG、罗丹明标记的山羊抗兔IgG购自北京中杉金桥公司。
UC-MSC的分离、培养、表型鉴定及分化潜能 UC-MSC取自北京协和医院剖腹产足月胎儿脐带,将脐带剪成1 cm后钝性分离脐动脉和脐静脉,将华通氏胶剪碎后采用0.1%的胶原酶消化,过滤离心后重悬计数,调整细胞密度接种于75 cm2培养瓶中,细胞置于37℃、5%CO2、饱和湿度的培养箱中培养,每2 d全量更换培养基。表型鉴定及分化潜能鉴定参考文献 [6]。
UC-MSC向胰岛细胞诱导分化 采用第3代UCMSC作为诱导分化的种子细胞,第1阶段使用含Activin A的低血清高糖DMEM诱导培养细胞,第2阶段更换含高浓度维甲酸、bFGF、EGF的无血清DMEM/F-12培养基,第3阶段改用含exendin-4、尼克酰胺的高糖DMEM培养基至诱导结束,于诱导前及诱导每阶段末取样检测mRNA及蛋白表达变化。
实时定量PCR检测 采用Trizol法提取总RNA,取2μg总RNA经反转录后得到cDNA;RT-PCR法检测不同阶段末期 foxa2、sox17、pdx1、ngn3、pax4、insulin和glut-2的mRNA表达变化,所有引物由美国Invitrogen公司合成。
免疫细胞荧光染色检测 细胞分别于诱导前及诱导每阶段末以80%冰乙醇固定,0.5%Triton X-100透化处理,分别使用1∶50小鼠抗人胰岛素单克隆抗体和1∶100兔抗人 C-肽多克隆抗体4℃过夜反应,洗涤后使用1∶50罗丹明标记的山羊抗小鼠抗体、罗丹明标记的山羊抗兔抗体室温避光作用1 h,冲洗后甘油封片。细胞核染色用1∶10000 Hoechst 33342室温作用1 min。采用 Olympus荧光显微镜观察并采集图像。
细胞胰岛素总量测定 收集未诱导的细胞培养上清及诱导第3阶段末细胞培养上清,400 g离心10 min,留取上清保存于-80℃冰箱中备用,使用胰岛素ELISA检测试剂盒行样品胰岛素测定,具体操作按照试剂盒说明书进行。
细胞C-肽分泌功能测定 诱导第3阶段末细胞,采用PBS洗涤3遍后置于无糖KRBH缓冲液孵育3~6 h,后于含5.5 mmol/L葡萄糖KRBH缓冲液中孵育1 h,收集孵育缓冲液,再于22 mmol/L葡萄糖KRBH缓冲液中孵育1 h,收集孵育缓冲液。使用C-肽ELISA试剂盒测定 C-肽浓度,具体测定方法参考试剂盒说明书。
统计学处理 采用SPSS 13.0统计软件,数据以均数 ±标准差表示,组间比较采用t检验,P≤0.05为差异有统计学意义。
结 果
UC-MSC诱导分化为成熟胰岛细胞形态学变化 选择第3代UC-MSC作为诱导种子细胞,未诱导的UC-MSC呈梭形贴壁生长,诱导第1阶段末观察细胞,90%以上细胞呈卵石样,诱导第2阶段末细胞逐渐聚集成团,诱导第3阶段末可见明显成团聚集的类胰岛结构 (图1)。
UC-MSC诱导分化为成熟胰岛细胞特异性转录因子的表达 为观察UC-MSC在非病毒体外诱导条件下向胰岛细胞方向分化过程,诱导第1阶段末检测了限定性内胚层 (definitive endoderm,DE)相关基因foxa2和sox17的表达,结果显示,诱导后细胞foxa2和sox17的表达均明显高于未诱导细胞 (P均 <0.05)。诱导第2阶段末,诱导细胞胰腺干、祖细胞相关基因pdx1、ngn3和pax4的表达均明显高于未诱导细胞 (P均 <0.05)。诱导第3阶段末,诱导细胞的成熟胰岛细胞标志insulin和glut-2的表达均明显高于未诱导细胞 (P均 <0.05)。
诱导分化成熟胰岛细胞相关蛋白表达 免疫细胞荧光染色结果显示,诱导前UC-MSC不表达胰岛素和C-肽,诱导第3阶段末细胞大量表达胰岛素及C肽,荧光显微镜下计数10个视野的细胞判断其诱导为胰岛细胞的效率可达90%以上 (图2)。
诱导分化后细胞胰岛素及C-肽分泌功能测定为了检测诱导第3阶段末细胞是否具有胰岛素分泌功能,采用胰岛素测定及 C-肽释放实验进行检测,ELISA检测结果显示,诱导第3阶段末细胞胰岛素总量为 (346.3739±32.5149)μ U/ml,明显高于未诱导细胞的 (17.69±1.46)μ U/ml(P <0.01)。葡萄糖刺激胰岛素释放实验结果也显示,诱导置于5.5 mmol/L葡萄糖环境检测基础C-肽释放水平为(195.10±8.88)pmol/L/h(P <0.01),细胞置于22 mmol/L葡萄糖环境的C-肽释放水平为 (340.99±7.91)pmol/L/h(P <0.01)。

图1 各阶段细胞形态学变化 (×100)Fig 1 Morphology change of cells at all stages(×100)
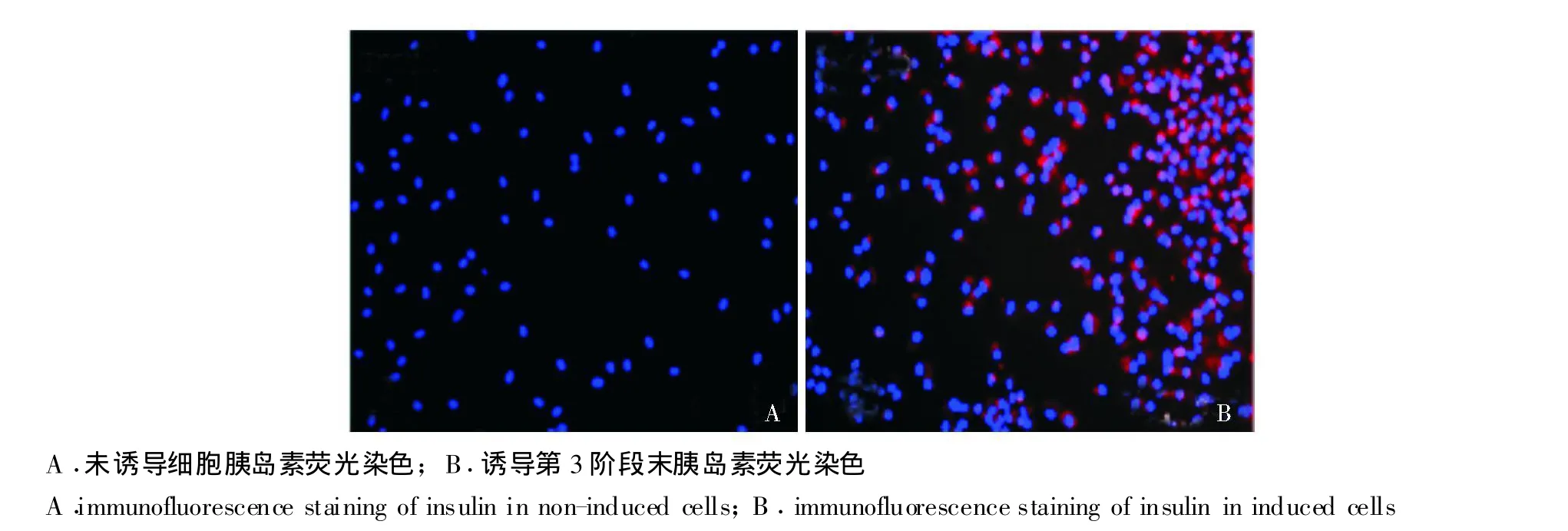
图2 胰岛素和C-肽免疫细胞荧光结果,细胞核 (蓝色)使用hochest33342染色,胰岛素 (红色)为胞浆染色 (×100)Fig 2 Results of immunofluorescence staining of insulin and c-peptide in induced cells and non-induced cells.[cell nuclear staining(blue)with hochest33342 and insulin staining(red)in the cytoplasm](×100)
讨 论
2000年开始,各国研究团队开始研究如何使用鼠或人的胚胎干细胞作为种子细胞,通过相关特异性基因导入[7],添加诱导细胞因子[8]或小分子化合物[9]等方法诱导分化具有一定胰岛素分泌功能的细胞。也有研究者采用肝脏卵圆细胞、胰导管细胞等作为种子细胞,这些细胞被认为可能是器官内存在的干细胞。近年有人采用糖尿患者的骨髓MSC[10],或者使用脂肪来源的MSC作为胰岛素分泌细胞的种子细胞,诱导出具有一定功能的胰岛素分泌细胞。本研究则选择了来源更为广泛方便且不受伦理限制的UC-MSC,通过贴壁特性,表面标志鉴定及成脂、成骨分化潜能确定了细胞为本课题组以前提出的flk-1+“亚全能干细胞”[4],具有该特征的细胞能够在体内外分化为神经细胞、心肌细胞、造血细胞、内皮细胞、肠上皮细胞等三胚层多种组织细胞,因此,本研究将其作为种子细胞进行内胚层来源的胰岛细胞诱导,通过形态学观察、基因表达水平、蛋白水平及分泌功能的评价发现能够成功获得有功能的胰岛素分泌细胞。
胚胎发育中,受精卵分化形成胚胎内细胞团,内细胞团进一步发育成原条,然后进一步分化成中内胚层及外胚层,中内胚层又可分化成中胚层及DE,DE随后发育成胰腺内胚层,胰腺内胚层可发育成胰腺的相关结构,包括:胰腺内分泌细胞、胰腺外分泌细胞及胰腺导管细胞[11-12]。本研究在胰腺胚胎发育过程研究的基础上,参考了以往诱导方案中的优势,以每个发育分化阶段特异性转录因子为标志,建立了适用于UC-MSC的非病毒分阶段体外诱导体系。低血清环境中Activin A参与诱导产生sox17+DE细胞,Activin A被认为能够激活activin/nodal信号通路,该通路在胚胎干细胞干性保持及DE特化中发挥重要作用。随后使用高浓度维甲酸,无血清培养基特化DE细胞成为pdx1+的胰腺内胚层细胞,添加的高浓度维甲酸能够强烈诱导pdx1的表达[13],bFGF则可促使细胞分裂增殖,有利于获得更多pdx1+细胞。最后,采用有利于胰腺内分泌细胞成熟的细胞因子exendin-4联合尼克酰胺促进胰岛细胞进一步分化及成熟,获得的细胞表达胰岛素及C-肽并对葡萄糖刺激产生应答反应。
在对胰腺发育及胚胎干细胞诱导分化分析中得知:DE的特化可看作是形成胰腺组织包括胰腺内分泌细胞的第1步。本研究中使用的UC-MSC通常被认为处于早期中胚层阶段且细胞为一不均一群体,这群细胞经过第1阶段诱导后DE相关基因表达出现明显上调,同时细胞形态呈现出与内胚层细胞系细胞形态的相似性[14],说明UC-MSC可能处于一个比通常认为的早期中胚层细胞更早的阶段,或者这一不完全均一的细胞群中含有比早期中胚层细胞早的细胞亚群,该细胞可能在诱导分子作用下经过了间质-上皮转化后形成DE细胞群,这群细胞为进一步获得胰腺内胚层细胞及成熟的胰岛细胞奠定了基础。
此外,获得的成熟胰岛细胞几乎90%以上均表达C-肽及胰岛素,胰岛素及C-肽检测则进一步证实了细胞的功能性,与之前研究相比,本研究使用了更易获得的细胞来源并且更为高效的获得目的细胞,其体内功能将在体内实验中进一步证实。本研究扩展了成体干细胞体外非病毒联合诱导的思路并为临床移植替代治疗糖尿病带来希望。
[1]Soria B,Roche E,Bern á G,et al.Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabetic mice[J].Diabetes,2000,49(2):157-162.
[2]D'Amour KA,Bang AG,Eliazer S,et al.Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells[J].Nat Biotechnol,2006,24(11):1392-1401.
[3]Zhu FF,Zhang PB,Zhang DH,etal.Generation ofpancreatic insulin-producing cells from rhesus monkey induced pluripotent stem cells[J].Diabetologia,2011,54(9):2325-2336.
[4]Fang BJ,Shi M,Liao L,et al.Multiorgan engraftment and multilineage differentiation by human fetal bone marrow Flk1+CD31-CD34-progenitors[J].J Hematother Stem Cell Res,2003,12(6):603-613.
[5]Guo M,Sun Z,Sun QY,et al.A modified haploidentical nonmyeloablative transplantation without T cell depletion for high-risk acute leukemia:successful engraftment and mild GVHD[J].Biol Blood Marrow Transplant,2009,15(8):930-937.
[6]Fang B,Liao L,Shi M,etal.Multipotency of Flk1+CD34-progenitors derived from human fetal bone marrow[J].J Lab Clin Med,2004,143(4):230-240.
[7]Blyszczuk P,Czyz J,Kania G,et al.Expression of Pax4 in embryonic stem cells promotes differentiation of nestin-positive progenitor and insulin-producing cells[J].Proc Natl Acad Sci USA,2003,100(3):998-1003.
[8]Kroon E,Martinson LA,Kadoya K,et al.Pancreatic endoderm derived from human embryonic stem cells generate glucose-responsive insulin-secreting cells in vivo[J].Nat Biotechnol,2008,26(4):443-452.
[9]Chen S,Borowiak M,Fox JL,et al.A small molecule that directs differentiation of human ESCs into the pancreatic lineage[J].Nat Chem Biol,2009,5(4):258-265.
[10]Sun Y,Chen L,Hou XG,et al.Differentiation of bone marrow-derived mesenchymal stem cells from diabetic patients into insulin-producing cells in vitro[J].Chin Med J(Engl),2007,120(9):771-776.
[11]Roelandt P,Pauwelyn KA,Sancho-Bru P,et al.Human embryonic and rat adult stem cells with primitive endodermlike phenotype can be fated to definitive endoderm,and finally hepatocyte-like cells[J].PLoS One,2010,5(8):e12101.
[12]Tam PP,Loebel DA.Gene function in mouse embryogenesis:get set for gastrulation [J],Nat Rev Genet,2007,8(5):368-381.
[13]Micallef SJ,Janes ME,Knezevic K,et al.Retinoic acid induces Pdx1-positive endoderm in differentiating mouse embryonic stem cells[J].Diabetes,2005,54(2):301-305.
[14]Tada S,Era T,Furusawa C,et al.Characterization of mesendoderm:a diverging point of the definitive endoderm and mesoderm in embryonic stem cell differentiation culture[J].Development,2005,132(19):4363-4374.
