大量制备过继免疫治疗用 γ δ T细胞时培养基的选择
2011-08-09周建华崔莲仙
周建华,康 宁,崔莲仙,何 维
中国医学科学院 北京协和医学院 基础医学研究所免疫学系,北京 100005
治疗恶性肿瘤的传统手段有手术治疗、放射治疗和化学治疗。然而,手术治疗不能清除肿瘤的微转移灶,难以取得根治性疗效;放疗具有剂量依赖性毒性,无法有效清除潜在的转移灶,且部分患者因产生放射抵抗而对放疗不敏感;化疗易引起全身免疫抑制,且部分患者因化疗药物无法有效进入肿瘤组织或对化疗药物产生耐药性而影响疗效。随着对免疫学和肿瘤学研究的不断深入,人们提出了生物治疗的概念,其中过继细胞免疫治疗成为近年来免疫学研究的热点[1]。γ δ T细胞能够以主要组织相容性复合物(major histocompatibility complex,MHC)非限制性方式识别肿瘤抗原,通过穿孔素和颗粒酶等途径杀伤肿瘤细胞,还与其他固有免疫细胞和适应性免疫细胞相互作用,辅助其发挥抗肿瘤作用[2-4]。因此,γ δ T细胞在肿瘤免疫细胞治疗中是一种具有优势的候选细胞[5-6]。为了有效扩增人外周血 γ δ T细胞以满足临床过继免疫治疗的需要,本研究在原有固相抗体体外扩增法的基础上,进行了培养基的比较和选择。
材料和方法
材料 人Burkitt's淋巴瘤细胞Daudi购自中国医学科学院基础医学研究所细胞中心,使用添加10%小牛血清的RPMI-1640培养基进行培养;人外周血单个核细胞 (peripheral blood mononuclear cell,PBMC)分离自健康志愿者外周血,样本采集符合中国医学科学院基础医学研究所伦理委员会的要求。淋巴细胞分离液购自天津TBD生物技术公司,重组人白细胞介素2(interleukin 2,IL-2)购自北京瑞得合通药业有限公司,佛波酯 (phorbol 12-myristate 13-acetate,PMA)、离子霉素 Ionomycin为美国Sigma公司产品,布雷菲德菌素 (Brefeldin A,BFA)购自美国 eBioscience公司 ,纯化抗人 TCR γ δ抗体、FITC 标记的抗人T细胞受体 (T cell receptor,TCR)γ δ单克隆抗体、PE标记的抗人肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抗体、 CD107a抗体购自美国Biolegend公司,RPMI-1640培养基、AIM-V培养基和OpTmizer培养基购自美国Invitrogen公司。Cyto-Tox 96©Non-Radioactive Cytotoxicity Assay试剂盒购自美国Promega公司,细胞内染色的试剂盒Cytofix/CytopermTM Fixation/Permeabilization Kit购自美国BD公司。RPMI-1640/AIM-V/OpTmizer完全培养基为含1%自体血清、200 U/ml IL-2、100U/ml青霉素和100μg/ml链霉素的培养基,细胞毒检测用培养基为含10%小牛血清、100U/ml青霉素和100μg/ml链霉素的RPMI-1640。
人外周血来源 γ δ T细胞的培养 抗凝人外周血以淋巴细胞分离液分离,得到的PBMC分别重悬于RPMI-1640/AIM-V/OpTmizer无血清培养基或完全培养基 , 以 500μl(1μg/ml) 抗人 TCRγ δ单克隆抗体固相包被24孔培养板进行刺激,于37℃、5%CO2条件下培养2周。γ δ T细胞体外扩增效率的计算:
扩增效率 =(培养后细胞总数 ×γ δ T细胞占细胞总数比例)/(PBMC总数 ×γ δ T细胞占PBMC比例)
台盼蓝染色法检测 γ δ T细胞的存活率 细胞用台盼蓝染色后,在显微镜下观察,计数外周4个大格中总细胞数和着蓝色的死细胞数:
细胞存活率 =(总细胞数-死细胞数)/总细胞数×100%
免疫荧光染色和流式细胞术检测 γ δ T细胞的纯度和表型 收集约1×106个细胞,以含1%BSA的PBS洗液洗涤2次。加入适量荧光标记抗体,4℃避光孵育20 min。PBS洗液洗涤 2次,重悬于200μl含1%多聚甲醛的PBS固定液中,用于流式细胞仪分析。
免疫荧光染色和流式细胞术检测 γ δ T细胞表达的杀伤相关分子和分泌的细胞因子 采用细胞毒检测用培养基重悬 γ δ T细胞至1×106个细胞/ml,加入20 ng/ml PMA和 0.5μg/ml Ionomycin;如检测细胞因子,需要同时加入3μg/ml BFA。将细胞置于37℃、5%CO2饱和湿环境孵育6 h;收集细胞,加入适量荧光标记抗体,4℃避光孵育20 min;PBS洗液洗涤2次,用300μl细胞膜固定透化液重悬细胞,4℃孵育30 min~1 h;透化洗液洗2次,加入适量荧光标记抗体,4℃避光孵育20 min;透化洗液洗涤细胞2次,重悬于200μl含1%多聚甲醛的PBS固定液中,用于流式细胞仪分析。
乳酸脱氢酶法检测 γ δ T细胞对肿瘤细胞的杀伤作用 按照试剂盒说明书进行:收集肿瘤细胞Daudi作为靶细胞,以培养2周的人外周血来源 γ δ T细胞为效应细胞 ,效靶比 (E∶T)分别为0.1∶1、0.5∶1、1∶1。效应细胞和靶细胞混合后置于37℃、5%CO2条件下继续培养6 h,收集培养上清用于乳酸脱氢酶释放量的测定。按照下列公式计算杀伤效率:
杀伤效率 =(实验孔值-效应细胞自发释放孔值-靶细胞自发释放孔值)/(靶细胞最大释放孔值-靶细胞自发释放孔值) ×100%
结 果
γ δ T细胞的存活率和纯度比较 3种培养基添加自体血清培养的细胞存活率均略高于无血清培养,其中RPMI-1640培养基添加血清与否对细胞的存活率影响最大,未添加血清的RPMI-1640培养基扩增的细胞存活率随培养时间增加而下降 (图1)。

图1 不同培养基条件下 γ δ T细胞存活率的比较Fig 1 Comparison ofthe survival rate of γ δ T cells cultured in different culture media
6种培养条件下扩增达1周和2周时,除未添加自体血清的RPMI-1640培养基和AMI-V培养基外,其余培养条件下 γ δ T细胞的纯度都逐渐增加;不论添加血清与否,AIM-V和OpTmizer培养基扩增的细胞纯度都明显高于 RPMI-1640(P<0.05或 P<0.01)。第2周时,添加血清的 AIM-V和OpTmizer培养基扩增的细胞纯度都显著高于添加血清的RPMI-1640培养基 (P均 <0.05),但AIM-V和OpTmizer间差异没有统计学意义 (P>0.05);未添加血清的OpTmizer培养基扩增的细胞纯度显著高于RPMI-1640和AIM-V(P均 <0.05),添加血清与不添加血清的OpTmizer培养基培养的细胞的纯度在整个培养过程中差异均没有统计学意义 (P均 >0.05)(图2)。
γ δ T细胞扩增效率的比较 培养2周时,未添加血清的OpTmizer培养基培养的细胞扩增效率显著高于RPMI-1640和AIM-V(P均 <0.05);添加血清的AIM-V培养的细胞扩增效率显著高于RPMI-1640(P<0.05),而添加血清的OpTmizer培养基培养的细胞扩增效率显著高于RPMI-1640(P<0.01)和AIM-V(P<0.05);同种培养基添加血清培养时细胞的扩增效率均显著高于不添加血清培养的细胞 (P<0.05)(图3)。
γ δ T细胞杀伤相关分子的表达及细胞因子的分泌 3种培养条件扩增的 γ δ T细胞经PMA/Ionomycin刺激后,表达杀伤相关分子CD107a及分泌细胞因子TNF-α的细胞比例都明显增加 (P<0.01),3种培养条件扩增的细胞表达相同分子及分泌相同细胞因子的差异没有统计学意义 (P>0.05)(图4)。
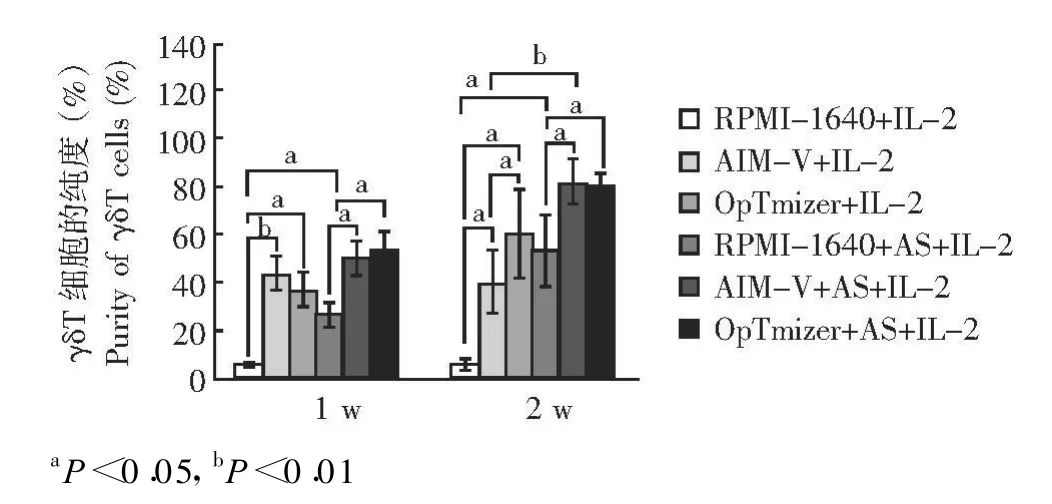
图2 不同培养基条件下 γ δ T细胞纯度的比较Fig 2 Comparison of purity of γ δ T cells cultured in different culture media

图3 不同培养基条件下 γ δ T细胞扩增效率的比较Fig 3 Comparison of the proliferation of γ δ T cells cultured in different culture media

图4 扩增 γ δ T细胞杀伤相关分子的表达及细胞因子的分泌Fig 4 Function-related molecule expression and cytokine release by expanded γ δ T cells
γ δ T细胞对肿瘤细胞的细胞毒作用比较 RPMI-1640培养的细胞对Daudi细胞的杀伤效率显著低于OpTmizer和AIM-V培养的细胞 (P均 <0.05),OpT-mizer和AIM-V培养基培养的细胞对Daudi细胞的杀伤效率差异没有统计学意义 (P>0.05)(图5)。
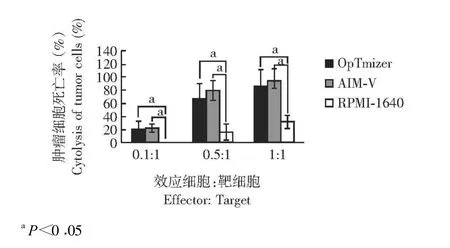
图5 扩增 γ δ T细胞对肿瘤细胞Daudi的细胞毒作用Fig 5 Cytotoxicity against Daudi cells by expanded γ δ T cells
讨 论
在人类外周血中, γ δ T细胞约占CD3+T细胞的1%~10%。根据其表达V γ和Vδ功能区的不同,可将人类 γ δ T细胞分为不同亚群,其中外周血主要包含两个亚群:(1)Vδ 2 T细胞:表达 TCR可变区V γ 9 和 V δ 2 的细胞 亚群 , 在 外 周血 γ δ T 细胞中所占比例较高;(2)Vδ 1 T细胞:表达TCR可变区 Vδ l的细胞亚群,主要定居于上皮组织中,在外周血 γ δ T细胞中所占比例较低[7]。尽管一直以来,大家都认为V δ 2 T细胞主要分布于外周血,对血液系统肿瘤有较好的细胞毒作用,而Vδ 1 T细胞主要分布于上皮组织及上皮相关的淋巴组织中,对上皮来源肿瘤细胞有较好的细胞毒作用[5],但是,越来越多的证据显示,V δ 1 T细胞在抗血液系统肿瘤的过程中同样具有举足轻重的作用[8]。
目前国际上用于过继免疫治疗的 γ δ T细胞主要来自磷酸抗原的体外扩增,该方法扩增的主要是V δ 2 亚型的 γ δ T 细胞[9]。 本课题 组前期 研究证实 ,采用固相化抗 TCRγ δ单克隆抗体扩增法可以使 γ δ T细胞得到大量扩增,扩增的 γ δ T细胞既包括 Vδ 2亚群,也包括Vδ 1亚群,并对多种肿瘤细胞有明显细胞毒作用[10]。这为固相化抗TCR γ δ单克隆抗体扩增的 γ δ T细胞用于过继免疫治疗肿瘤提供了研究基础。
为了使 γ δ T细胞的培养更简便 、更适合临床过继免疫治疗的应用,本研究采用了RPMI-1640、AIM-V和OpTmizer 3种培养基,其中,RPMI-1640是培养T细胞最常用的培养基,培养过程中需要添加一定比例的血清,以补充细胞生长所需的一些未知的细胞因子,而常用作添加的牛血清因为是异种血清不能在临床治疗时使用。人AB血清或者自体血清可以作为牛血清的替代品,但是因为其来源有限而限制了细胞制剂的规模化生产。为此,对血清依赖性低的培养基成为临床治疗用细胞培养的首选。同样广泛应用于T细胞培养的AIM-V培养基被称为无血清培养基,而OpTmizer培养基是在AIM-V的基础上进行改良的新型无血清培养基,内含可以提高细胞内谷胱甘肽水平[11]的N-乙酰-1-半胱氨酸,有利于细胞因子依赖的T细胞扩增[12]。本研究比较了3种培养基分别在添加或不添加自体血清条件下对 γ δ T细胞的扩增能力,以及所扩增的 γ δ T细胞的效应功能。结果显示,不添加血清的条件下,AIM-V和OpTmizer对 γ δ T细胞的扩增能力明显优于传统的RP-MI-1640培养基。添加1%自体血清后,3种培养基的扩增效果都明显增强,但AIM-V和OpTmizer培养基仍然具有明显优势,特别是OpTmizer培养基扩增γ δ T细胞的能力最佳,且对肿瘤细胞具有良好的细胞毒活性。这些结果表明,OpTmizer培养基对血清依赖性最低,扩增的细胞具有良好的效应功能,更适合临床治疗所需 γ δ T细胞制剂的大规模制备。
[1]Long HM,Parsonage G,Fox CP,et al.Immunotherapy for Epstein-Barr virus-associated malignancies[J].Drug News Perspect,2010,23(4):221-228.
[2]Maniar A,Zhang X,Lin W,et al.Human γ δ T lymphocytes induce robust NK cellmediated antitumorcytotoxicity through CD137 engagement[J].Blood,2010,116(10):1726-1733.
[3]Reschner A,Hubert P,Delvenne P,et al.Innate lymphocyte and dendritic cell cross-talk:a key factor in the regulation ofthe immune response[J].Clin Exp Immunol,2008,152(2):219-226.
[4]Brandes M,Willimann K,Bioley G,et al.Cross-presenting human gammadelta T cells induce robust CD8+alphabeta T cell responses[J].Proc Natl Acad Sci USA,2009,106(7):2307-2312.
[5]Kabelitz D,Wesch D,He W.Perspectives of gammadelta T cells in tumor immunology [J].Cancer Res,2007,67(1):5-8.
[6]Moser B,Eberl M. γ δ T-APCs:a novel tool for immunotherapy[J]?Cell Mol Life Sci,2011,68(14):2443-2452.
[7]Maeurer MJ,Martin D,Walter W,et al.Human intestinal Vdelta1+lymphocytes recognize tumor cells of epithelial origin[J].J Exp Med,1996,183(4):1681-1696.
[8]Poggi A,Venturino C,Catellani S,et al.Vδ 1 T lymphocytes from B-CLL patients recognize ULBP3 expressed on leukemic B cells and up-regulated by trans-retinoic acid [J].Cancer Res,2004,64(24):9172-9179.
[9]Sireci G,Espinosa E,Di Sano C,et al.Differential activation of human gammadelta cells by nonpeptide phosphoantigens[J].Eur J Immunol,2001,31(5):1628-1635.
[10]Zhou J,Kang N,Cui L,et al.Anti-γ δ TCR antibody-expanded γ δ T cells:a better choice for the adoptive immunotherapy of lymphoid malignancies[J].Cell Mol Immunol,2011[2011-06-13].http://www.nature.com/cmi/journal/vaop/ncurrent/full/cmi201116a.html.
[11]Flescher E,Fingrut O.Suppression of interleukin 2 biosynthesis by three modes of oxidative cellular stress:selective prevention by N-acetyl cysteine[J].Cytokine,2000,12(5):495-498.
[12]Yim CY,Hibbs JB Jr,McGregor JR,et al.Use ofN-acetyl cysteine to increase intracellular glutathione during the induction of antitumor responses by IL-2[J].J Immunol,1994,152(12):5796-5805.
