细胞外信号激酶蛋白5在卵泡刺激素介导的卵泡颗粒细胞甾体激素生成中的作用
2011-08-09高小博陆彩玲杨伯清彭小忠
高小博,姚 楠,马 旭,陆彩玲,杨伯清,彭小忠
1中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京 100005
2国家人口计生委科学技术研究所遗传室,北京 100081
3中国医学科学院 北京协和医学院 医学信息研究所基层卫生与妇幼保健研究室,北京 100020
卵泡是卵巢的基本组成单位,由卵母细胞、颗粒细胞和膜细胞组成。颗粒细胞随卵泡的发育而增殖和分化,在垂体分泌的促性腺激素卵泡刺激素(follicle-stimulating hormone,FSH)和促黄体生成素(luteotropic hormone,LH)刺激下,颗粒细胞可产生甾体激素雌激素和孕酮,对卵泡发育和怀孕等生殖功能发挥关键的调节作用[1]。甾体激素合成急性调节蛋白StAR参与甾体激素的前体胆固醇由线粒体外膜向线粒体内膜的转运,是甾体激素生物合成的必经途径[2-3]。促性腺激素主要通过G蛋白激活腺苷酸环化酶引起细胞cAMP增加和激酶A(protein kinase A,PKA)激活,随后激活一系列信号通路来诱导调节甾体激素生成基因的表达。有研究表明,细胞外信号激酶蛋白1/2(extracellular signal-regulated protein kinase 1/2,ERK1/2)等经典MAPK通路参与了促性腺激素介导的甾体激素生成[4-6]。细胞外信号激酶蛋白5(extracellular signal-regulated protein kinase 5,ERK5)是近年来发现的MAPK家族成员[7-8],本研究探讨了ERK5在颗粒细胞甾体激素生成过程中的作用。
材料和方法
材料 出生23 d的雌性SD大鼠,体重40~45 g,购自北京大学医学部实验动物中心;孕马血清促性腺激素 (pregnant mare serum gonadotropin,PMSG)干粉购自北京海德创业生物公司,DMEM/F12培养基、胎牛血清 (fetal bovine serum,FBS)、胰蛋白酶、青霉素和链霉素购自美国Hyclone公司,ERK5和StAR抗体购自美国Santa Cruz公司,ERK5特异性磷酸化抗体购自美国Cell signaling公司,β-actin抗体、FSH、碘化丙啶 (propidiumiodide,PI)、牛血清白蛋白 (bovine serum albumin,BSA)购自美国 Sigma公司,蛋白酶抑制剂购自瑞士Roche公司,Bradford蛋白质定量检测试剂购自美国Bio-rad公司,ECL检测试剂购自美国GE Healthcare公司,辣根过氧化物酶(horseradish peroxidase,HRP)和FITC标记的二抗购自北京中杉金桥公司,组成型活性腺病毒MEK5[Ad-MEK5(ca)]、野生型腺病毒ERK5[Ad-ERK5(wt)]、显性负效应腺病毒ERK5[Ad-ERK5(dn)]和绿色荧光蛋白腺病毒Ad-GFP购自美国Cell Biolabs公司。
原代颗粒细胞的分离及培养 将23 d龄SD大鼠经腹腔注射400μl PMSG注射液 (20U/只)刺激卵泡发育,48 h后脱臼处死;取双侧卵巢,置于含5%FBS的DMEM/F12培养基中,修剪卵巢周围组织,清洗3次;体式显微镜下用小号针头刺破卵泡,释放颗粒细胞;1000 r/min(r=18.6 cm)离心10 min后,弃去上清,以含15%FBS的DMEM/F12培养基重悬细胞,稀释至5×105个/ml,分装入培养板培养,24 h后观察细胞贴壁情况;细胞换成无血清培养基过夜后加入含有FSH (50 ng/ml)的无酚红DMEM/F12培养基,分别处理0、6、12、24、48 h后收集细胞行Western blot检测。
Western blot检测 通过胰酶消化收集细胞,PBS清洗后用含有蛋白酶抑制剂的细胞裂解液[10 mmol/L Tris-Cl(pH7.5)+150 mmol/L NaCl+1 mmol/L EDTA(pH8.0)+1%Triton X-100+0.5%脱氧胆酸钠 +0.1%SDS+10 mmol/L氟化钠 +0.2 mmol/L矾酸钠]裂解细胞,收集蛋白并利用蛋白质定量检测试剂盒进行蛋白浓度定量。将50~100μg蛋白用12%SDSPAGE胶分离后转移至硝酸纤维素膜,分别利用抗ERK5、ERKS特异性磷酸化抗体、抗StAR抗体以及辣根过氧化物标记的二抗进行杂交,通过ECL化学发光法进行显色,并以 β-actin抗体杂交作为内对照。
免疫荧光共聚焦 将颗粒细胞在共聚焦专用培养皿中培养,经过FSH处理后,用4%多聚甲醛固定30 min,在室温下以含0.5%Triton X-100的PBS通透细胞10 min;随后细胞用含1%BSA的PBS室温封闭1 h,用PBS以1∶30的稀释比加入ERK5抗体,4℃孵育过夜,用PBS 1∶50稀释的 FITC标记二抗,37 ℃孵育 30 min;用 10μg/ml的碘化丙啶染核,37℃孵育20 min;室温避光晾干,抗猝灭封片剂封片,避光保存。用激光共聚焦显微镜 (Zeiss LSM 510 META,德国Zeiss公司)观察,每次观察时的设置参数保持一致。
腺病毒感染 原代颗粒细胞分离后在含有15%FBS的DMEM/F12培养基中于 CO2培养箱内培养过夜,12 h后用DMEM/F12培养基清洗细胞2~3次,洗去未贴壁的细胞。每个35 mm培养皿中加入1.5 ml不加抗生素的含有10%FBS的DMEM/F12培养基,分别采用Ad-MEK5(ca)(含人MEK5的组成性激活形式,感染颗粒细胞后能够使细胞中MEK5活化形式增加)、Ad-ERK5(wt)(含人ERK5,感染颗粒细胞后能够使细胞中ERK5的总体表达水平增加)和Ad-ERK5(dn)(含人ERK5的显性阴性形式,感染颗粒细胞后细胞内表达大量有正常结合位点而功能位点突变失活的ERK5)3种重组腺病毒,以3×1011颗粒/ml浓度感染颗粒细胞5 h;随后将培养基换为无血清、无抗生素DMEM/F12培养基培养24 h,用含有FSH(50ng/ml)的无酚红DMEM/F12培养基处理感染后的颗粒细胞,12 h后收集上清检测孕酮含量,收集细胞总蛋白进行Western blot检测。
放射免疫法测定孕酮 24孔板每孔中加入约5×105个颗粒细胞 ,用500μl含15%FBS的 DMEM/F12培养基于CO2培养箱内培养,然后用各种试剂进行处理。当培养结束后,收集培养基利用放射免疫法测定孕酮含量。
统计学处理 采用SPSS 13.0统计软件和R统计分析平台,实验结果以均数 ±标准误表示,两组间均数比较采用t检验;两组以上均数的比较首先采用单因素方差分析,然后采用Student-Newman-Keuls进行两两均数间的比较;P<0.05为差异有统计学意义。
结 果
FSH对ERK5表达的影响 Western blot检测结果显示,用50 ng/ml的FSH处理颗粒细胞后,ERK5的表达量随着FSH处理时间增加而逐渐下降,而ERK5活性形式的表达量则随着FSH处理时间增加而逐渐上升 (图1)。
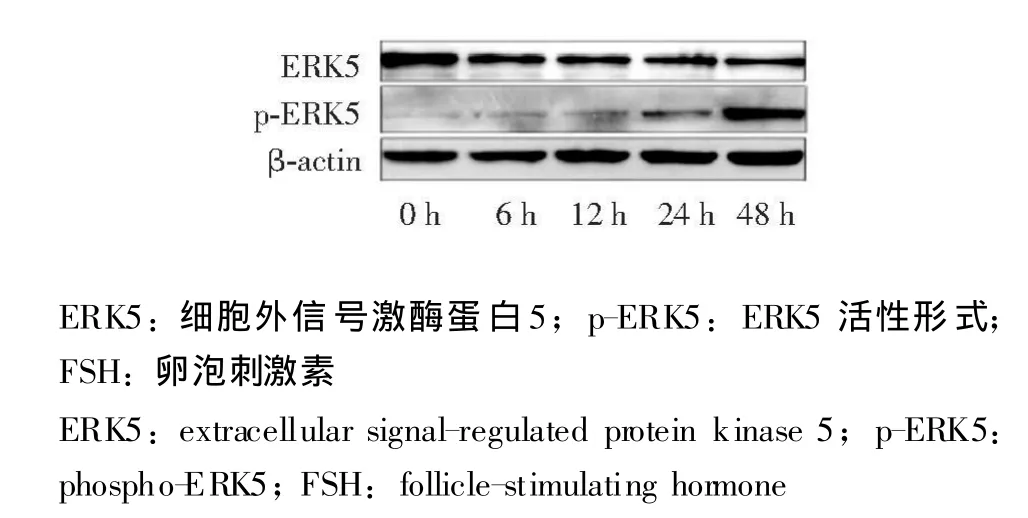
图1 FSH对颗粒细胞ERK5及ERK5活性形式表达的影响Fig 1 Effect of FSH on ERK5 protein levels and phospho-ERK5 protein levels in granulosa cells
FSH对ERK5在颗粒细胞中亚细胞分布的影响激光共聚焦显微镜技术观察结果显示,ERK5主要分布于颗粒细胞的胞浆中,经FSH处理后,ERK5蛋白定位没有发生明显变化 (图2)。

图2 FSH(50ng/ml)处理后ERK5在颗粒细胞的亚细胞分布Fig 2 Effect of follicle-stimulating hormone(50ng/ml)on the subcellular distribution of ERK5 in granulosa cells
ERK5活化对FSH介导颗粒细胞孕酮分泌的影响经FSH(50 ng/ml)处理12 h后,Ad-MEK5(ca)和Ad-ERK5(wt)联合感染组颗粒细胞的孕酮分泌水平及细胞内StAR表达水平明显高于空白对照组和Ad-GFP感染组 (P均 <0.05)。Ad-ERK5(dn)感染组颗粒细胞的孕酮分泌水平明显低于Ad-GFP感染组 (P<0.05),与空白对照相比差异无统计学意义(P=0.051);细胞StAR表达水平明显低于空白对照组和Ad-GFP感染组 (P均 <0.05)(图3)。
讨 论
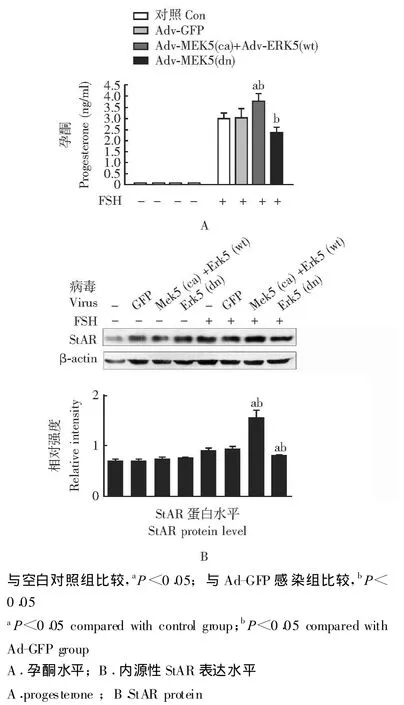
图3 FSH和腺病毒处理后各组颗粒细胞孕酮分泌水平及细胞内StAR表达水平Fig 3 Progesterone and StAR protein in granulosa cells after having been exposed to follicle-stimulating hormone and recombinant adenoviruses
丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)家族在细胞内信号传导和调节中发挥着重要的作用,可调控细胞增殖、分化以及凋亡等各种细胞功能,常见的MAPK家族成员有ERK1/2、c-Jun氨基末端激酶 (c-Jun N-terminal kinase,JNK)和p38MAPK,ERK5是近年发现的MAPK家族新成员[9]。ERK5与 ERK1/2有53%的同源性,其N-末端含有1个高度保守的双磷酸化位点 (Thr219,Tyr221),是激酶活化域,现已证明双磷酸化此位点能激活 ERK5[7-8]。1995年,Lee等[8]研究发现,ERK5能通过其上游激酶MEK5被氧化物刺激及渗透压改变所激活。此后不断有研究证实ERK5能够被某些生长因子激活,如:上皮生长因子、神经生长因子和纤维生长因子-2等[10-12]。FSH是由垂体释放的一类对女性生殖功能有重要作用的激素,调节了卵泡的正常发育直至引发排卵。本研究结果显示,FSH处理颗粒细胞后,ERK5的表达量随FSH处理时间增加而逐渐下降,而ERK5活性形式的表达量则随FSH处理时间的增加而逐渐上升,提示颗粒细胞中ERK5的表达可能受到FSH的复杂调控。
MAPK属于蛋白丝/苏氨酸激酶,MAPK一般可通过接受膜受体转换与传递的信号将其传递至细胞浆中的下游激酶或细胞核内的转录因子而发挥作用。根据细胞类型不同,ERK5在细胞中的分布也不相同,内源性ERK5可能分布于细胞浆,也可能遍布细胞浆和细胞核中。本研究发现,颗粒细胞的内源性ERK5主要定位于细胞浆中,被FSH刺激后并没有表现明显的亚细胞定位的变化,而神经元细胞被脑源性神经营养因子刺激后ERK5可从细胞浆转位至细胞核[13],可见在不同的条件下,ERK5的空间分布受到不同调控。结合FSH刺激颗粒细胞后ERK5总体表达和活性形式表达趋势相反的情况可以看出,在FSH作用于颗粒细胞的过程中,ERK5发挥着极其复杂的生物学作用。FSH刺激甾体激素的生成需要FSH激活颗粒细胞上的FSH受体偶联的G蛋白,使激素敏感的腺苷酸环化酶活化,引起细胞内cAMP升高,进而激活下游PKA信号通路,从而触发各相关信号通路例如ERK1/2、p38MAPK等的活化以调节与甾体激素生成相关基因的表达[5,14-15]。在颗粒细胞中ERK5是否受到FSH刺激的cAMP/PKA通路和MEK5的调节有待进一步研究。
ERK5的激活与细胞生存、增殖及分化等多种生物学行为有关。研究表明,ERK5在心脏和神经发育中发挥重要的作用[16-17]。在FSH刺激颗粒细胞分泌类固醇激素的过程中,MAPK家族的其他成员,如:p38MAPK和ERK1/2均被发现与该生理过程有关,本研究也发现ERK5参与了FSH引起的颗粒细胞生成甾体激素。本研究采用重组腺病毒感染原代颗粒细胞,结果显示细胞内ERK5被大量激活后FSH引起的孕酮分泌和细胞内StAR的表达都升高,而当细胞内ERK5活性被抑制后则出现相反的效应,这一结果说明ERK5的活化在FSH介导的颗粒细胞分泌甾体激素过程中发挥了重要的作用。但是值得注意的是,与ERK1/2和p38MAPK稍有不同,FSH对ERK5的激活效应在48h达到顶峰,而FSH对ERK1/2和p38MAPK的效应则要迅速的多,分别在FSH处理20min和30min后达到顶峰[15,18]。这一现象提示ERK5在上述生理过程中可能发挥着与ERK1/2或p38MAPK不同的作用,这种作用更可能调控较为晚期的生物学效应。
[1]Amsterdam A,Selvaraj N.Control of differentiation,transformation,and apoptosis in granulosa cells by oncogenes,oncoviruses,and tumor suppressor genes[J].Endocr Rev,1997,18(4):435-461.
[2]Stocco DM,Wang X,Jo Y,et al.Multiple signaling pathways regulating steroidogenesis and steroidogenic acute regulatory protein expression:more complicated than we thought[J].Mol Endocrinol,2005,19(11):2647-2659.
[3]Niswender GD.Molecular control of luteal secretion of progesterone[J].Reproduction,2002,123(3):333-339.
[4]Tajima K,Dantes A,Yao Z,et al.Down-regulation of steroidogenic response to gonadotropins in human and rat preovulatory granulosa cells involves mitogen-activated protein kinase activation and modulation of dax-1 and steroidogenic factor-1[J].J Clin Endocrinol Metab,2003,88(5):2288-2299.
[5]Dewi DA,Abayasekara DR,Wheeler-Jones CP.Requirement for erk1/2 activation in the regulation of progesterone production in human granulosa-lutein cells is stimulus specific[J].Endocrinology,2002,143(3):877-888.
[6]Seger R,Hanoch T,Rosenberg R,et al.The erk signaling cascade inhibits gonadotropin-stimulated steroidogenesis[J].J Biol Chem,2001,276(17):13957-13964.
[7]Hayashi M,Lee JD.Role of the bmk1/erk5 signaling pathway:lessons from knockout mice[J].J Mol Med(Berl),2004,82(12):800-808.
[8]Lee JD,Ulevitch RJ,Han J.Primary structure of bmk1:A new mammalian map kinase[J].Biochem Biophys Res Commun,1995,213(2):715-724.
[9]Nishimoto S,Nishida E.Mapk signalling:Erk5 versus erk1/2[J].EMBO Rep,2006,7(8):782-786.
[10]Kato Y,Tapping RI,Huang S,et al.Bmk1/erk5 is required for cell proliferation induced by epidermal growth factor[J].Nature,1998,395(6703):713-716.
[11]Kamakura S,Moriguchi T,Nishida E.Activation of the protein kinase erk5/bmk1 by receptor tyrosine kinases.Identification and characterization of a signaling pathway to the nucleus[J].J Biol Chem,1999,274(37):26563-26571.
[12]Kesavan K,Lobel-Rice K,Sun W,et al.Mekk2 regulates the coordinate activation of erk5 and jnk in response to fgf-2 in fibroblasts[J].J Cell Physiol,2004,199(1):140-148.
[13]Wang Y,Su B,Xia Z.Brain-derived neurotrophic factor activates erk5 in cortical neurons via a rap1-mekk2 signaling cascade[J].J Biol Chem,2006,281(47):35965-35974.
[14]Maizels ET,Cottom J,Jones JC,et al.Follicle stimulating hormone(fsh)activates the p38 mitogen-activated protein kinase pathway,inducing small heat shock protein phosphorylation and cell rounding in immature rat ovarian granulosa cells[J].Endocrinology,1998,139(7):3353-3356.
[15]Yu FQ,Han CS,Yang W,et al.Activation of the p38 mapk pathway by follicle-stimulating hormone regulates steroidogenesis in granulosa cells differentially[J].J Endocrinol,2005,186(1):85-96.
[16]Wang Y.Mitogen-activated protein kinases in heart development and diseases[J].Circulation,2007,116(12):1413-1423.
[17]Liu L,Cundiff P,Abel G,et al.Extracellular signal-regulated kinase(erk)5 is necessary and sufficient to specify cortical neuronal fate[J].Proc Natl Acad Sci USA,2006,103(25):9697-9702.
[18]Yu FQ,Han CS,Yang W,et al.Role of erk1/2 in fsh induced pcna expression and steroidogenesis in granulosa cells[J].Front Biosci,2005,10:896-904.
