人羊膜负载人羊膜间充质干细胞对SD大鼠皮肤创面愈合的影响
2011-08-09霍双枝庞希宁
霍双枝,施 萍,庞希宁
中国医科大学 1细胞生物学卫生部重点实验室干细胞与再生医学研究室 2附属第一医院全科医学教研室,沈阳 110001
皮肤作为一种特殊的器官,是机体免于脱水、损伤和感染的第一道防线,也是维持内环境稳定和阻止微生物、化学物质等侵入的屏障。人羊膜 (human amniotic membrane,HAM)是一种天然高分子生物材料,含胶原、糖蛋白、蛋白多糖等多种成分,能表达多种生长因子,有利于细胞的生长繁殖,促进上皮和新生血管形成,抑制炎症,促进组织修复。人羊膜间充质干细胞 (human amniotic mesenchymal stem cells,hAMSCs)具有高度自我更新能力,易在体外培养、扩增,遗传性状稳定,免疫原性低等特点,存在于羊膜基质中,在羊膜治疗皮肤创伤时是直接接触创面的细胞成分,但其在羊膜治疗皮肤创伤中发挥的作用尚不十分清楚。本研究观察了HAM负载hAMSCs对SD大鼠皮肤创面愈合的影响,初步探讨了羊膜治疗皮肤创伤的机制。
材料和方法
材料和试剂 雄性SD大鼠18只,体重200~240 g,购自中国医科大学动物部;包埋剂 (optimal cutting temperature compound,OCT)购自美国McCormick公司,SABC免疫组织化学试剂盒购自上海Maixin-Bio公司,角蛋白19(cytokeratin 19,CK19)和血管内皮生长因子 (vascular endothelial growth factor,VEGF)多克隆抗体购自美国Santa Cruz公司,其他常规试剂购自沈阳化学试剂采购供应站。
羊膜的制备与负载 取健康剖宫产产妇的羊膜,其乙型肝炎5项、人类丙型肝炎病毒、人类免疫缺陷病毒、梅毒等其他相关传染性指标均呈阴性。在无菌超净台上用PBS液冲洗羊膜上的血迹,钝性分离羊膜,将其置于含1000 U/ml庆大霉素 +2.5μg/ml两性霉素B的生理盐水中浸泡20 min[1];将上述制备的羊膜用无菌棉线在其基质面打结作辨认标记,然后用终浓度2.5 g/L胰蛋白酶于37℃培养箱中消化30 min,去上皮细胞;将消化后的羊膜用PBS反复冲洗,基质面向上剪成合适大小铺于自制玻片上,用细胞刮刀反复刮去残留上皮细胞,放入培养皿中;将hAMSCs以1.54×105/cm2密度种于羊膜上,加入4 ml培养液培养[2]。
CFDA-SE染色 用DMSO制备1 mmol/L CFSE溶液,然后用PBS将其稀释成 10 ~50μmol/L;将1/10细胞培养基体积的CFSE溶液加入细胞培养基中,在37℃条件下培养细胞15 min,用PBS缓冲液洗涤细胞两次,加入DMEM/F12培养基培养[3]。
创伤模型制备及分组 18只SD大鼠常规饲养3 d后,经腹腔注射1%戊巴比妥钠30 mg/kg麻醉,剃去背中部毛,在两侧相同部位做2 cm×2 cm创面,深至皮下,形成机械损伤动物模型;每只SD大鼠的两个创面做相同处理,18只SD大鼠随机分为3组,每组6只:(1)对照组:在鼠背部伤口每日消毒;(2)单纯羊膜组:在鼠背部伤口外敷单纯羊膜;(3)HAM负载hAMSCs组:在鼠背部伤口外敷负载细胞的羊膜。
创面愈合观察及指标
大体情况观察:术后大鼠分笼饲养,每天观察其健康、进食、创面变化、肉芽组织生长和创面愈合等情况。
创面愈合率测定:于创伤后每天用直尺测量创面面积,计算创面愈合率[4]。
HE染色:术后7、14、21 d,活检创缘与正常交界处组织,制成6μm的冰冻切片,行HE染色。
免疫组织化学染色:采用SP法对各组鼠皮肤切片进行免疫组织化学染色。
统计学处理 采用SPSS 11.5统计软件,实验数据以均数 ±标准差表示,组间差异比较行t检验,P<0.05为差异有统计学意义。
结 果
负载羊膜的hAMSC CFDA-SE染色 标记细胞呈绿色荧光,形态良好,增殖能力不受影响 (图1)。
各组大鼠创面愈合情况 所有大鼠均存活,活动自如,进食正常,未见便血和血尿,体重有所增加。创面呈渐进性愈合,毛发沿创周随面积的缩小而逐渐生长。术后3 d,HAM负载hAMSCs组大鼠的伤口开始收缩且出现少许红晕,其他两组大鼠伤口湿润;术后7 d,HAM负载hAMSCs组大鼠创缘皮肤收缩明显,伤口干燥、无感染,创面已基本为肉芽组织所填充,其他两组大鼠羊膜伤口湿润、有渗出,仅见薄层肉芽;术后14 d,HAM负载hAMSCs组大鼠伤口基本愈合,其他两组大鼠伤口愈合欠佳;术后21 d,HAM负载hAMSCs组和单纯羊膜组大鼠的创面愈合,HAM负载hAMSCs组的瘢痕小于单纯羊膜组,对照组创面未完全愈合 (图2)。对照组、单纯羊膜组和HAM负载hAMSCs组大鼠创面的平均愈合时间分别为 (26.4±0.7)、(21.5±1.2)、 (18.3±0.9)d,其中HAM负载hAMSCs组愈合时间明显短于对照组 (P<0.01)和单纯羊膜组 (P<0.05),单纯羊膜组明显短于对照组 (P<0.05)。
各组大鼠创面愈合率的比较 术后11 d和14 d,HAM负载hAMSCs组大鼠的创面愈合率分别为(81.5±7.2)%和 (94.3±3.6)%,明显高于对照组的 (48.5±3.2)%和 (74.3±4.3)%及单纯羊膜组的(68.5 ±4.5)%和 (86.8±4.8)%(P均 <0.01),单纯羊膜组的创面愈合率则明显高于对照组 (P均 <0.05);术后18 d,单纯羊膜组大鼠的创面愈合率为(97.0±4.2)%,明显高于对照组的 (87.5±5.1)%(P <0.05)(表1)。
HE染色结果 术后7 d,对照组可见较多炎性细胞浸润;单纯羊膜组可见少量炎性细胞浸润,肉芽组织中的新生血管含量少;HAM负载hAMSCs组可见肉芽组织中新生血管的数量明显多于单纯羊膜组。术后14 d,对照组可见新生血管增多,炎性细胞减少;单纯羊膜组肉芽组织生长旺盛;HAM负载hAMSCs组可见肉芽组织的毛细血管含量丰富,胶原沉积,组织结构完整。术后21 d,对照组肉芽组织和毛细血管含量丰富,胶原沉积;单纯羊膜组组织结构完整,胶原束变得明显;HAM负载hAMSCs组胶原纤维排列紧密,真皮内有大量血管生成,且新生血管管腔较前明显扩大、管壁增厚 (图3)。
免疫组织化学染色结果 CK19多呈棕黄色颗粒沉淀于表皮基底层,皮脂腺和毛囊隆突部周围 (图4),术后14 d,HAM负载hAMSCs组大鼠皮肤CK19阳性表皮干细胞数为48.2±3.2,明显高于单纯羊膜组的37.7±3.1(P<0.05)和对照组的29.6±2.4(P<0.01);VEGF多呈棕黄色颗粒沉淀于真皮层细胞质和细胞外基质中 (图5),VEGF在各组均持续表达阳性,HAM负载hAMSCs组大鼠皮肤的VEGF阳性颗粒表达数为64.5±4.5,明显高于单纯羊膜组的52.6±3.8(P<0.05)和对照组的40.7±3.1(P <0.01)。
表1 各组大鼠术后不同时间点创面愈合率的比较 (n=6,,%)Table 1 Comparison of the wound healing rates at different time points among different groups(n=6,,%)

表1 各组大鼠术后不同时间点创面愈合率的比较 (n=6,,%)Table 1 Comparison of the wound healing rates at different time points among different groups(n=6,,%)
A组:对照组;B组:单纯羊膜组;C组:HAM负载hAMSCs组;与A组比较,aP<0.05;与C组比较,bP<0.01Group A:blank control group;Group B:amniotic membrane group;Group C:human amniotic membrane load with human amniotic mesenchymal stem cells group;aP <0.05 compared with Group A;bP <0.01 compared with Group C
分组Group 3d 7d 11d 14d 18d 21d 26d A组 Group A 2.0±0.2 13.2±2.3 48.5±3.2b 74.3±4.3b 87.5±5.1 93.5±5.3 100 B组 Group B 4.5±0.3 20.3±2.7 68.5±4.5ab 86.8±4.8ab 97.0±4.2a 100 100 C组 Group C 6.5±0.5 29.8±2.8 81.5±7.2 94.3±3.6 100 100 100
讨 论
随着组织工程学和干细胞生物学的发展,细胞疗法已成为治疗创伤的新策略,其关键问题是寻找合适的种子细胞[5]。理想的种子细胞应具备以下条件:可靠的细胞来源,容易获得,体外可快速扩增培养。本研究中,经胰酶处理后的HAM仍为膜片状,有韧性,便于贴覆创面。将 hAMSCs负载HAM上,细胞易于黏附,生长态势良好,在创面修复过程中不形成异常结构,因此,HAM是负载细胞理想的生物材料。此外,本研究结果显示,HAM负载hAMSCs组大鼠创面的愈合速度明显快于单纯羊膜组和对照组,提示hAMSCs可缩短皮肤损伤愈合时间,促进损伤皮肤的修复。
创伤组织的修复是一个非常复杂的生物学过程,主要经过炎症期、增殖期、组织重构3个阶段[6]。随炎性渗出后,逐渐出现成纤维细胞和毛细血管内皮细胞的增殖。随着肉芽形成,创缘表皮的新生上皮向创面中心推进,填补创口,逐渐覆盖创面,最终愈合[7]。本研究组织学结果显示,HAM负载hAMSCs修复创面可使炎性细胞减少,肉芽组织生长旺盛,表皮生长规整,组织结构完整,证实hAMSCs是通过促进正常的表皮细胞、成纤维细胞及毛细血管再生,促进皮肤损伤愈合。
CK19是表皮干细胞特异标记物,主要分布于表皮基底层,皮脂腺和毛囊隆突部周围[8]。VEGF是目前发现作用最强的促血管生成细胞生长因子,能促使微血管内皮细胞增殖、迁移,有利于新生血管生长[9]。本研究结果显示,HAM负载hAMSCs组大鼠的CK19阳性细胞数和VEGF表达均明显高于单纯羊膜组和对照组,提示hAMSCs可能是通过促进表皮干细胞和毛细血管的再生,促进创伤组织的愈合。
综上,HAM负载hAMSCs明显缩短了皮肤损伤愈合时间,使表皮生长规整、较厚,成纤维细胞排列规整,新生毛细血管含量丰富,并提高了CK19阳性细胞数量,上调了VEGF的表达,表明hAMSCs可加强HAM对皮肤创伤的修复作用,并证实hAMSCs是通过促进正常的表皮细胞、成纤维细胞及毛细血管再生,促进损伤皮肤的修复。但hAMSCs是如何促进皮肤表皮干细胞和毛细血管再生的,还需进一步研究。

图1 hAMSCs CFDA-SE染色呈绿色荧光 (×400)Fig 1 The staining of hAMSCs CFDA-SE shows green fluorescence(×400)

图2 各组大鼠创面愈合变化情况Fig 2 Changes of wound healing in three groups

图3 各组不同时间大鼠创面HE染色 (×10)Fig 3 HE staining of the wound at different time points among different groups(×10)

图4 各组不同时间大鼠创面角蛋白19免疫组织化学染色 (×40)Fig 4 Cytokeratin 19 immunohistochemical staining of the wound at different time points among different groups(×40)
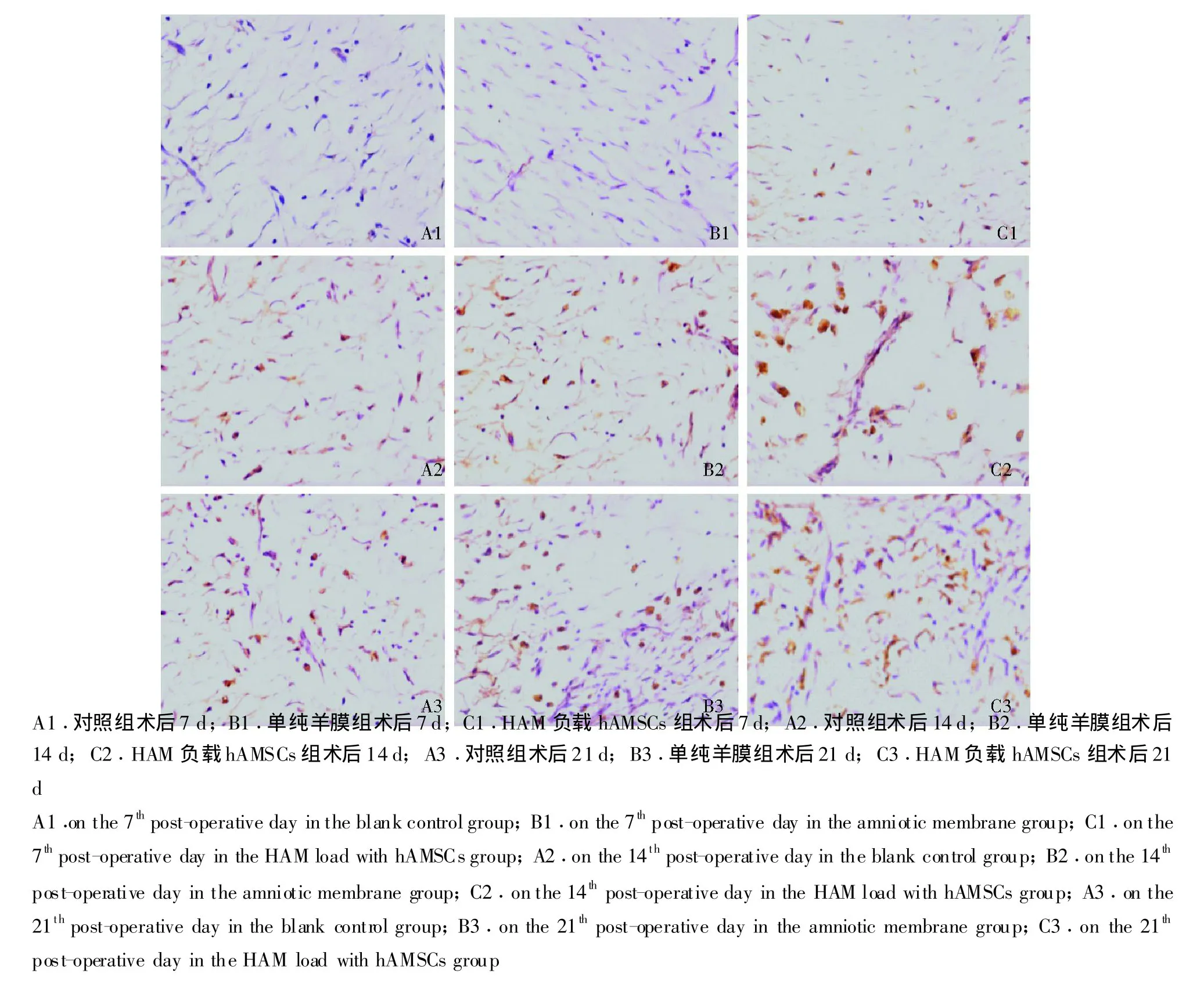
图5 各组不同时间大鼠创面血管内皮生长因子免疫组织化学染色 (×40)Fig 5 Vascular endothelial growth factor immunohistochemical staining of the wound at different time points among different groups(×40)
[1]Han K,Lee JE,Kwon SJ,et al.Human amnion-derived mesenchymal stem cells are a potential source for uterine stem cell therapy[J].Cell Prolif,2008,41(5):709-725.
[2]May SR.The effects of biological wound dressings on the healing process[J].Clin Mater,1991,8(3-4):243-249.
[3]付霞霏,何援利 .大鼠间充质干细胞的体外分离培养及CFSE标记 [J].解放军医学杂志,2007,32(5):464-466.
[4]Gabric N,Mravicic I,Dekaris I,et al.Human amniotic membrane in the reconstruction of the ocular surface [J].Doc Ophthalmol,1999,98(3):273-283.
[5]付小兵,田惠民 .国外创伤研究的新进展 [J].国外医学:骨科学分册,1994,15(3):147-154.
[6]王正国 .创伤后组织修复研究的现状与展望 [J].中华创伤杂志,1995,11(3):151-153.
[7]Tanaka A,Nagate T,Matsuda H,et al.Acceleration of wound healing by gelatin film dressings with epidermal growth factor[J].J Vet Med Sci,2005,67(9):909-913.
[8]Kim MS,Ahn HH,Shin YN,et al.An in vivo study of the host tissue response to subcutaneous implantation of PLGA-and/or porcine small intestinal submueosa-based scafrolds[J].Biomaterials,2007,29(34):5137-5143.
[9]Kroll J,WaltenbergerJ.Regulation of the endothelial function and angiogenesis by vascular endothelial growth factor-A(VEGF-A)[J].Z Kardiol,2000,89(3):206-218.
