鸡γ-干扰素的可溶性表达及纯化产物的抗NDV活性
2011-08-08单安山孙进华尹佳佳李远见
代 丽,单安山,孙进华,尹佳佳,李远见
(东北农业大学动物营养研究所,哈尔滨 150030)
干扰素作为人们研究的热点,不论是在人类临床还是在畜牧应用和临床兽医中都发挥着重要的作用。IFN-γ属于Ⅱ型干扰素,它的抗病毒活性较Ⅰ型干扰素低,但它的免疫调节和疫苗佐剂效应较强[1-2],所以又称免疫干扰素。实践证明:鸡γ-干扰素(chIFN-γ)在抗鸡球虫作用、抗新城疫病毒、抗传染性法氏囊病病毒和对马立克氏病、传染性脑脊髓炎和传染性喉气管炎等方面都具有较好疗效,同时也能增强禽流感疫苗免疫作用[3-4]。在饲养过程中这就大大地降低了鸡的死亡率,为广大的饲养者创造出更高的经济价值。
本研究成功扩增了鸡IFN-γ成熟蛋白基因,亚克隆至原核表达载体pProEXTMHTa,在大肠杆菌BL21中诱导表达,非变性条件下进行纯化并获得了可溶性蛋白,并检测了该蛋白的生物学活性。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
宿主菌:大肠杆菌DH5α和BL21(DE3)、表达载体pProEXTMHTa、带有信号肽的重组质粒PMD-18T-preIFN-γ为本实验室保存[5];克隆载体pMD18-T载体购自TaKaRa公司;新城疫Ⅳ系弱毒苗为本实验室保存。
1.1.2 主要试剂
EcoRⅠ、SalⅠ、Taq DNA Polymerase、dNTP Mix、T4DNA Ligase、2 000 bp DNA Ladder Marker、15 000 bp DNA Ladder Marker、蛋白分子质量标准(低)、IPTG(dioxane free)、氨苄青霉素(Amp)等(均购自TaKaRa公司);DNA琼脂糖凝胶回收试剂盒、质粒小量提取试剂盒(购于北京天根生化科技有限公司);硝酸纤维素膜(NC膜)(购自Amersham公司);转膜滤纸(购自Whatman公司);蛋白纯化试剂盒(购自Novagen公司);鼠源抗His单克隆抗体和HRP-兔抗鼠IgG(购自中杉金桥生物技术有限公司);细胞培养基为M199培养基。其他试剂均为国产或进口分析纯。
1.1.3 引物
根据GenBank上已登录的鸡γ-干扰素序列(ID:X99774)及pProEXTMHTa多克隆位点,设计引物如下 : chIFN-γ 上 游 P1: 5′GAGGAATTCATGCA TACTGCAAGTAGTCT3′(斜体下划线处为EcoRⅠ酶 切 位 点); chIFN-γ 下 游 P2: 5′GAGGTCGAC TTAGCAATTGCATCTCCTC3′(斜体下划线处为SalⅠ酶切位点),用以扩增鸡γ-干扰素成熟蛋白基因序列。引物由上海生工有限公司合成,预期扩增目的片段为459 bp。
1.2 ChIFN-γ基因的克隆与鉴定
1.2.1 PCR扩增chIFN-γ基因
以带有信号肽的重组质粒PMD 18T-preIFN-γ为模板,扩增无信号肽chIFN-γ基因片段。PCR反应条件:95℃4 min;94℃30 s,55℃30 s,72℃40 s,40个循环;72℃10 min。取2 μL PCR产物于2%的琼脂糖凝胶电泳检测。
1.2.2 ChIFN-γ cDNA克隆
将PCR产物用DNA琼脂糖凝胶回收试剂盒纯化后与pMD18-T载体连接,转化E.coli DH5α感受态细胞,LB平板(Amp抗性)过夜培养筛选,挑选单菌落,振荡培养后用质粒小量提取试剂盒提取质粒,PCR和双酶切鉴定均为阳性的质粒送上海生工生物工程技术服务有限公司测序,进一步测序鉴定正确的阳性重组质粒命名为PMD 18T-chIFN-γ。
1.3 ChIFN-γ原核表达载体的构建与鉴定
Eco RⅠ和SalⅠ双酶切阳性重组质粒pMD 18-T-chIFN-γ,切出chIFN-γ目的基因,同时用Eco RⅠ和SalⅠ双酶切pProEXTMHTa空载体;经DNA琼脂糖凝胶回收试剂盒分别回收chIFN-γ目的基因和pProEXTMHTa空载体部分;在T4DNA Ligase作用下进行连接反应,连接产物转化E.coli DH5α感受态细胞,涂布含Amp的LB平板,37℃培养箱过夜,挑取单菌落,振荡培养后用质粒小量提取试剂盒提取质粒,进行PCR鉴定及Eco RⅠ/SalⅠ双酶切鉴定,鉴定均为阳性的质粒送上海生工生物工程技术服务有限公司公司测序,进一步测序鉴定正确的阳性重组质粒命名为pProEXTMHTach-IFN-γ。
1.4 rchIFN-γ的诱导表达及SDS-PAGE分析
将pProEXTMHTa-chIFN-γ转化表达受体菌E.coli BL21(DE3),挑选单菌落接种于LB培养基(含Amp 100 μg·mL-1),37 ℃,230 r·min-1,振荡培养过夜,次日按1%接种量接种于含10 mL新鲜LB培养基(含Amp 100 μg·mL-1)的 100 mL 锥形瓶中,30℃,230 r·min-1振荡培养,当菌液OD600值达0.6~0.8时加入1 mmol·L-1的Isopropylthio-β-D-galactoside(IPTG)诱导4 h,同时取诱导前的菌液作对照。各取1.5 mL菌液于4℃,12 000 r·min-1离心10 min,收集菌体沉淀用100 μLPBS悬浮,加入100 μL的1×SDS-PAGE上样缓冲液,充分混匀100℃煮沸7~8 min,进行15%SDS-PAGE电泳,用考马斯亮蓝染色,观察蛋白表达结果。
1.5 Western blot分析
将表达的rchIFN-γ蛋白及空载体诱导表达菌经15%的SDS-PAGE电泳后,用半干转印法转印到NC膜上,5%脱脂奶封闭过夜,一抗选择抗6His的单克隆抗体,二抗为HRP标记兔抗鼠IgG,4-CN显色液显色,蒸馏水终止后拍照记录。
1.6 表达蛋白的可溶性分析及纯化
将诱导4 h的菌液于4℃,4 100 r·min-1离心10 min,将沉淀悬浮于PBS溶液中,混匀,置冰浴进行超声波破碎,设置程序为每超声6 s,间隔6 s,功率300 W,全程6 min。裂解菌液于4℃,12 000 r·min-1离心30 min,分别取上清和沉淀进行15%的SDS-PAGE分析。然后进行纯化,首先将沉淀悬浮于PBS溶液中,加入5%的甘油和终浓度为1 Mm的PMSF混匀,接着按Novagen蛋白纯化试剂盒的操作指南进行天然纯化,收集洗脱下来的目的蛋白,然后按照蛋白纯化仪中的脱盐程序进行脱盐,收集蛋白液,并用考马斯亮兰蛋白测定试剂盒(南京建成生物工程研究所)测定其蛋白的浓度。
1.7 纯化的rchIFN-γ蛋白生物学活性测定
利用鸡成纤维细胞-新城疫(新城疫Ⅳ系弱毒苗)(CEF-NDV)系统测定天然纯化的rchIFN-γ蛋白的抗病毒效价。将纯化的rchIFN-γ用维持液(M199+2%FCS)依次进行5倍稀释,稀释6个梯度,加至已长成单层的96孔板的CEF细胞上,每孔100 μL,每个稀释度做6个重复孔,37℃,5%CO2孵育24 h;弃上清,每孔接种100TCID50的NDV,每孔200 μL,同时设立NDV阳性对照(不加干扰素,只加NDV)、阴性对照(只加干扰素,不加NDV)和空白对照(不加干扰素,也不加NDV)。37℃培养24~48 h后在倒置显微镜下观察,待阳性对照细胞出现明显致细胞病变效应(Cytopathogenic effect,CPE)时判定结果,能抑制50%细胞病变的rchIFN-γ的最高稀释度的倒数作为干扰素抗NDV活性单位[6]。
2 结果与分析
2.1 ChIFN-γ基因原核表达载体的构建与鉴定
重组质粒经PCR和双酶切鉴定,均可以得到459 bp左右的目的条带,与预期结果相符。结果见图1。
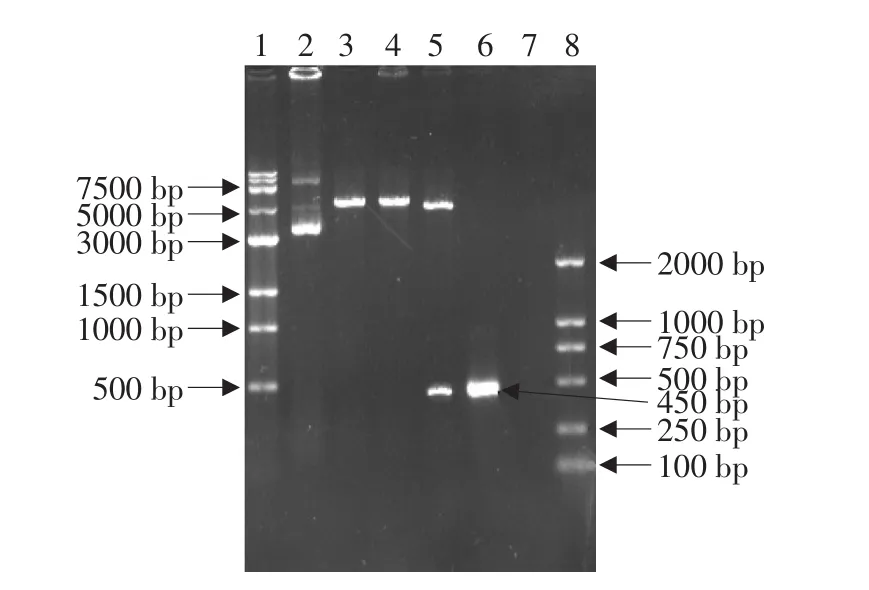
图1 重组pProEXTMHTa-chIFN-γPCR和酶切鉴定Fig.1 Restriction enzyme analysis of recombinant plasmid pProEXTMHTa-chIFN-γ
2.2 核苷酸序列测定
克隆的chIFN-γ基因经上海生工生物工程技术服务有限公司测序结果如下,片段大小为459 bp,与预期大小相符。序列与1995年Digby等人首次成功克隆的chIFN-γ基因序列完全相同[7]。
2.3 表达产物SDS-PAGE鉴定
SDS-PAGE电泳结果显示,在约20.0 ku处出现特异性目的条带,大小与预期相符,而未诱导对照无此特异性条带(见图2),利用Bandscan软件分析目的蛋白的表达量在40%左右。
2.4 Western blot分析
Westernblot结果表明,表达rchIFN-γ蛋白能与抗6His的单克隆抗体在目的带20.0 ku处发生特异性显色反应,而未诱导的没有显色反应(见图3)。

图2 SDS-PAGE分析鸡IFN-γ在pProEXTMHTa表达系统中的表达Fig.2 SDS-PAGE analysis of chIFN-γ expressed in pProEXTMHTa system

图3 Western blot鉴定rchIFN-γ蛋白Fig.3 Western blot analysis
2.5 表达产物可溶性分析及纯化
可溶性分析表明:表达蛋白一部分在上清中以可溶的形式存在;而一部分在裂解沉淀中以包涵体的形式存在(见图4)。
利用Bandscan软件分析可溶性蛋白的含量占总蛋白含量的50%左右。利用Novagen公司纯化试剂盒对表达产物进行纯化,经SDS-PAGE电泳,结果显示了良好的纯化效果,pProEXTMHTa-IFN-γ得到了单一的目的条带(见图5)。
纯化的重组chIFN-γ原核表达蛋白的浓度经试剂盒测定后结果为1.9mg·mL-1。

图4 SDS-PAGE分析rchIFN-γ蛋白的可溶性Fig.4 SDS-PAGE analysis of the solubility of rchIFN-γ protein
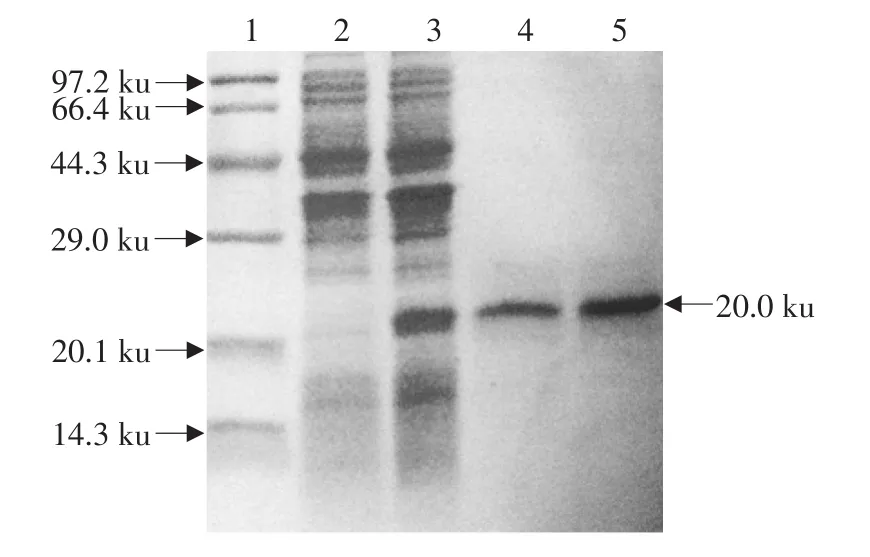
图5 表达产物的纯化Fig.5 Purified product of expressed pProEXTMHTa-chIFN-γ protein
抗病毒活性试验结果表明:细胞对照组生长良好(见图6-a),纯化rchIFN-γ蛋白(1∶54稀释)能抵抗100TCID50的病毒攻击(见图6-b),而病毒对照组细胞基本死亡(见图6-c),说明纯化获得的rchIFN-γ蛋白具有较好的抗病毒活性。

图6 抗病毒活性测定中的细胞Fig.6 Cells in detection of anti-NDV activity of IFN-γ
3 讨论
在家禽养殖生产中,预防禽类传染性疾病主要采用疫苗免疫,但疫苗往往比较单一,而病毒却复杂多样且变异快,常导致疫苗未能达到很好的免疫效果,严重的还能导致人畜共患。在疾病的治疗方面常常又会因为大量使用药物引起一系列的药物残留和抗药性的问题。因此研究一种新型的广谱抗感染类生物制剂就迫在眉睫。干扰素因其作用机理的独特性而具有广谱的抗病毒活性和免疫增强作用。研究表明,重组干扰素与天然干扰素具有同样的抗病毒和免疫调节活性[8],因此重组干扰素的研究和应用将成为家禽养殖生产中增强鸡的免疫,减少鸡的疾病,降低鸡的死亡率的重要方向。
李娜等用能够在大肠杆菌、昆虫细胞和哺乳动物细胞中表达的pQE trisystem载体表达了鸡γ-干扰素,但是表达的融合蛋白主要以包涵体形式存在[9];蔡梅红等将鸡γ-干扰素与pRLC原核非融合性表达载体重组并得到高效表达,其表达产物也主要以包涵体形式存在[10];由于表达产物主要以包涵体形式存在,必须对包涵体成分进行复杂的变性复性处理。而本研究选用pProEXTMHTa表达载体,经过摸索并且采取了一系列措施直接对表达的可溶性蛋白在非变性条件下纯化。如温度控制在30℃,在超声前加入甘油、PMSF等保护蛋白不被氧化从而维持它的活性。超声波裂解后,上清和沉淀分别进行SDS-PAGE分析,结果总蛋白的50%左右以可溶性的形式存在,避免了包涵体的大量产生,从而解决了天然条件下分泌太少的缺陷,也避免了包涵体表达进行变性复性处理等复杂步骤。在脱盐试验中利用蛋白纯化仪的脱盐柱进行脱盐,避开了传统的透析,为鸡γ-干扰素通过天然纯化从而保持其活性提供了保证。
据文献报道用原核载体表达真核基因,真核基因中信号肽的存在可能会在一定程度上影响其表达产物的生物活性[13]。蔡梅红等只扩增鸡γ干扰素成熟蛋白基因,而不是全基因序列[10];戴华将含信号肽和不含信号肽序列分别与表达载体构建了重组大肠杆菌,最后表明去除chINF-γ基因信号肽序列的重组菌的表达产物能以可溶性和包涵体的形式同时并存[11];齐静构建重组表达质粒pET-32a(+)-chIFN-γ得到了大量的可溶性蛋白[12]。本研究在本实验室构建好了的含有信号肽的重组质粒基础上重新扩增出无信号肽的chINF-γ与pProEXTMHTa高效表达载体重组并进行表达。pProEXTMHTa表达载体中带有6×His的标签,可以和目的蛋白一起融合表达,因此表达产物可以通过镍柱亲和层析柱进行纯化,纯化rchIFN-γ蛋白浓度为 1.9 mg·mL-1;同时由于pProEXTMHTa载体中6×His标签分子质量小,生理条件下不带电荷,因而基本上不影响目的蛋白的结构与功能,从而使融合蛋白的生物学活性更高,利于以后的生产应用,这是在选择表达载体时和以前的研究的不同之处,是本实验创新之处之一。本试验中用鼠源的6×His的单克隆抗体作为一抗,HRP的兔抗鼠抗体作为二抗可检测到表达和纯化rchIFN-γ蛋白在约20 ku处出现特异性显色条带。史喜菊等曾利用真核表达系统和原核表达系统同时构建了rBoIFN-γ的重组体,同时比较了两者之间的活性,结果表明酵母表达的rBoIFN-γ蛋白的抗病毒活性大约为大肠杆菌表达的rBoIFN-γ蛋白抗病毒活性的2倍[13],也就是说在活性方面,原核表达系统还是存在着不足之处。
通过CEF-NDV系统测定表明纯化蛋白具有很好的抗病毒活性。水泡性口炎病毒作为活性检测试验中常被采用的病毒,但黄建宝利用NDV强毒株F48E9对复性后的IFN-γ进行了活性测定,结果表明纯化的重组IFN-γ具有良好的生物学活性[14]。同时新城疫只需要在普通的细胞间操作,减少实验过程中不少的繁杂工序,节约成本,所以本实验采用了鸡成纤维细胞-新城疫(新城疫Ⅳ系弱毒苗)(CEF-NDV)系统检测重组IFN-γ的生物学活性。本实验采用新城疫Ⅳ系弱毒苗对融合蛋白进行活性测定,也是本实验的创新之处。这也为研究开发新型抗病毒制剂和免疫佐剂奠定了重要基础。
4 结论
a.本试验采用PCR方法成功克隆到编码鸡γ-干扰素(chIFN-γ)基因,与1995年Digby等人首次成功克隆的chIFN-γ基因序列进行比较,其同源率为100%。
b.采用原核表达系统成功表达了chIFN-γ融合蛋白,SDS-PAGE和Western blot分析显示,表达的鸡IFN-γ融合蛋白分子质量约为20 ku,能与抗His的单克隆抗体发生特异性反应。
c.重组chIFN-γ融合蛋白经可溶性分析表明,表达的蛋白一部分形成包涵体,另一部分以可溶形式存在,可溶性蛋白经镍柱在天然条件下的纯化得率约为1.9 mg·mL-1。
d.利用利用鸡成纤维细胞-新城疫(新城疫Ⅳ系弱毒苗)(CEF-NDV)系统测定的非变性条件下纯化的重组chIFN-γ具有良好的抗NDV病毒活性,为研制新型抗病毒干扰素制剂奠定基础。
[1] Weining K C,Schultz U,Munster U,et al.Biological properties of recombinant chicken interferon-gamma[J].Immunol,1996,26(10):2440-2447.
[2] Lowenthal J W,O'Neil T E,Broadway M,et al.Coadmin-istration of IFN-gamma enhances antibody responses in chickens[J].Interferon Cytokine Res,1998,18(8):617-622.
[3] 叶秀华,蔡建平,吴志光,等.重组鸡γ干扰素的抗球虫作用[J].中国兽医杂志,2004,40(7):3-5.
[4] 贾立军,刘秀梵,张艳梅,等.鸡γ-干扰素对H5亚型禽流感疫苗的免疫增强作用[J].农业生物技术学报,2004,12(4):427-430.
[5] 孙进华,姜文博,代丽,等.AA肉鸡IFN-γ的表达及蛋白结构的初步预测[J].东北农业大学学报,2009,40(4):74-79.
[6] 陈忠广.犬干扰素-γ的复性及活性测定[D].哈尔滨:东北农业大学,2007.
[7] Digby M R,Lowenthal J W.1995.Cloning and expression of the chicken interferon-gamma gene[J].Interferon Cytokine Res,15:939-945.
[8] Lambrecht B,Gonze M,Morales D,et al.Comparison of biological activities of natural and recombinant chicken interferon gamma[J].Veterinary of Immunology and Immunopathology,1999,70(3-4):257-267.
[9] 李娜,张保平,王文彬,等.鸡γ-干扰素表达载体的构建[J].湖南文理学院学报,2009,21(1):51-52.
[10] 蔡梅红,曹瑞兵,周斌,等.鸡干扰素成熟蛋白基因的表达及其产物抗病毒活性测定[J].中国病毒学,2004,19(1):32-35.
[11] 戴华.鸡γ-干扰素基因cNDA的克隆、表达及其产物单克隆抗体的制备与初步鉴定[D].扬州:扬州大学,2005.
[12] 齐静,杜以军,朱小玲,等.鸡γ-干扰素的可溶性表达及纯化产物的抗病毒活性[J].微生物学报,2009,49(1):85-91.
[13] 史喜菊,张灿,韩春来,等.牛γ-干扰素在大肠杆菌与毕赤酵母中的表达及抗病毒活性比较[J].农业生物技术学报,2005,13(4):461-467.
[14] 黄建宝,黄溢泓,谢芝勋,等.鸡IFN-γ基因的原核表达及其表达产物的抗NDV活性[J].中国兽医科学,2007,37(10):887-891.
