蛹虫草继代培养后主要生物学性状的变化*
2011-08-08张国珍
王 熙,张 佳,张国珍
(中国农业大学植物病理学系,农业部植物病理学重点实验室,北京 100193)
蛹虫草(Cordyceps militaris)又称北冬虫夏草、北虫草等,是一种虫生药用真菌,为我国名贵的中药材之一,具有很高的药用价值和营养价值。蛹虫草在自然界有着广泛的分布,但自然资源匮乏,远不能满足人们的需求[1]。因此,如何高产优质地人工培养蛹虫草显得尤为重要。目前,蛹虫草的栽培方式主要是在固体培养基上接种或在昆虫活蛹上接种蛹虫草,在一定温度、湿度和光照条件下培养后收获子实体[2-4]。子实体是蛹虫草的药用部位,也是有性生殖的产物。已有研究表明蛹虫草为异宗配合真菌[5],即需要2个相反交配型(MAT-1、MAT-2)的菌株才能完成有性生殖,产生子实体。子实体的产生除了与交配型基因有关外,还与栽培过程中的外界环境条件有关。为了促进子实体的形成,提高蛹虫草的产量,可以从选种、培养料配制以及栽培条件和技术等的改进来提高产量[6-8]。与其他丝状真菌相似,蛹虫草在培养过程中其生物学性状会发生一些变化,如菌种 “退化”[3]、发生菌落角突变和子实体产量下降[9]等。本研究组对蛹虫草有性孢子的萌发过程和有性后代群体的培养性状进行了观察[10]。但是,对于蛹虫草菌株尤其是来自有性后代子囊孢子的菌株,在继代培养过程中其生物学性状的变化缺乏系统观察和研究。本试验的目的是研究蛹虫草不同菌株经多次继代培养后,在菌落性状、生长速率、产孢量以及子实体形成等生物学性状方面会发生哪些变化,以便为深入研究菌株退化问题提供一定的线索。
1 材料和方法
1.1 供试菌株
根据菌株来源、菌落特征等,本试验选取了4个单子囊孢子菌株和1个组织分离的菌株,其中2个单子囊孢子菌株分离自野生蛹虫草子实体,2个单子囊孢子菌株分离自人工培养的子实体,5株代表菌株的信息见表1。

表1 供试菌株的交配型、菌落性状及其来源
4个单子囊孢子菌株单独培养时均不能形成子实体,组织分离的菌株可以形成子实体。单子囊孢子菌株的分离参照梁月等[10]的方法。交配型的确定采用分子生物学方法(专利号: 200910085789.4)。
1.2 培养基及培养条件
单子囊孢子的分离使用2.0%水琼脂培养基,菌株的培养使用改良的PDA培养基,改良PDB液体培养基用于子实体形成试验中接种体的制备,子实体形成试验所用培养基为大米培养基,参照梁月等[10]的方法进行。
1.3 菌丝生长速率测定及菌落形态的观察
将供试菌株在改良PDA培养基上于21℃、光照条件下培养,至菌落将要长满6 cm培养皿时,用直径5 mm的打孔器在菌落边缘打取菌饼,定量接种至新的改良PDA培养基上,同样条件下培养15 d,记为第1代菌株,用同样的方法进行继代培养,每培养15 d为1代。在培养过程中,每天测量菌落直径,取15 d的平均值为当代的平均菌丝生长速率。同时,观察菌落的颜色与质地。每个菌株每代重复3皿。
分离自野生子实体的2个菌株已培养至第18代,来自于人工栽培子实体的3个菌株已培养至第11代。
1.4 产孢量的测定
将菌株按方法1.3培养15 d,在菌落半径1/2处用8 mm打孔器打取3个菌饼,放入10 mL 0.45‰吐温水溶液中,用振荡器震荡1 min后制成分生孢子悬浮液,稀释后用血球计数板计数分生孢子的浓度,最终换算成单位菌落面积的孢子数(个·cm-2)。每隔5代测定1次菌株的产孢量。每个菌株重复3皿。
1.5 子实体形成能力的测定
用PDB液体培养基洗下平板培养基上培养的孢子和菌丝,取1 mL接种到含有40 mLPDB培养基的三角瓶中,摇床培养3 d~4 d后,接种到大米培养基上培养。45 d后观察子实体的产生情况并称重。每隔5代进行1次子实体产生试验,每个菌株重复4次。
2 结果与分析
2.1 继代培养过程中菌丝生长速率的变化
继代培养过程中菌丝生长速率的变化情况见图1。

图1 蛹虫草不同菌株继代培养过程中生长速率变化
5个菌株的菌丝生长速率有一定差异,来自于野生子实体的2个菌株09-40-4和09-40-5,在第7代之前生长速率有一定波动,之后有比较明显的下降,第18代的生长速率与第1代相比分别下降了19%和27%;来自于人工栽培子实体的2个菌株5E-10-2和5E-10-7,在第2代之后生长速率就有明显的下降,第11代的生长速率与第1代相比分别下降了21%和19%,而组织分离的菌株5E-10-Z2生长速率在第5代之后开始下降,第11代的生长速率比第1代下降了6.2%。总体来看,随着继代培养代数的增加,各菌株的菌丝生长速率呈明显下降的趋势,来自于野生子实体的菌株表现生长速率下降的时间,比来自人工栽培子实体的菌株要慢。
2.2 继代培养过程中菌落形态的变化
继代培养过程中菌落形态的变化情况见图2。

图2 蛹虫草不同菌株继代培养过程中菌落形态变化(以09-40-4为例)
供试的5个菌株在继代培养过程中菌落形态都发生了明显的改变,主要表现为菌落颜色逐渐变淡和出现角突变。菌落颜色由橙色变成杏黄色或是由杏黄色变成淡柠檬黄色,特别是粉状菌株在培养5代之后菌落边缘开始形成白色绒状的角突变。而菌落质地没有发生明显变化。
2.3 继代培养过程中菌株产孢量的变化情况
继代培养过程中菌株产孢量的变化情况见图3。

图3 蛹虫草不同菌株继代过程中产孢量的变化
来自于野生子实体的2个菌株在第1代时产孢量很大,但第5代时产孢量明显下降,之后随着培养代数的增加继续减少,09-40-4和09-40-5第15代的产孢量与第1代相比分别下降了约88%和97%;来自于人工栽培子实体上的3个菌株,在培养过程中也出现了产孢量减少的情况,5E-10-2、5E-10-7以及5E-10-Z2第10代产孢量与第1代相比分别下降了约55%、67%和42%。
2.4 继代过程中菌株子实体产生能力的变化情况
继代过程中菌株子实体产生能力的变化情况见表2、图4。

表2 供试菌株不同培养代数的子实体产生情况(鲜重)
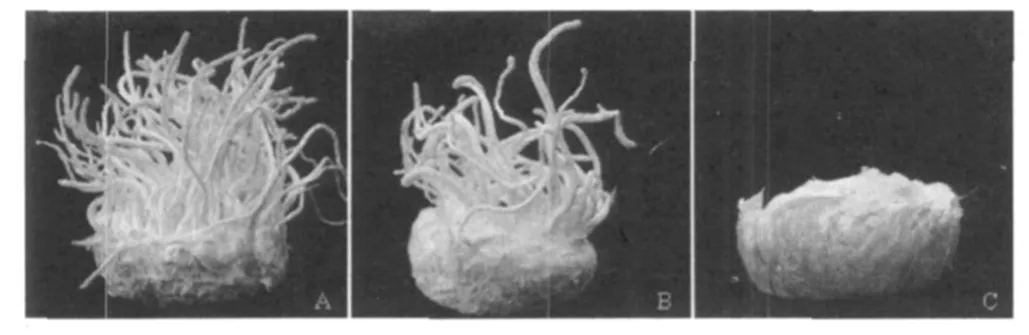
图4 蛹虫草菌株继代过程中子实体形成能力的变化情况(以 09-40-4×09-40-5 为例)
将培养1代后的2个相反交配型的菌株进行配对或将组织分离的菌株单独培养,都能够产生正常的子实体,产量也较高(表2),但培养5代后的菌株组合09-40-4与09-40-5的子实体产生明显下降,或有些子实体发育不良,子实体上没有子囊壳(图4B),另一对菌株组合5E-10-2与5E-10-7甚至不产生子实体。培养第10代后的菌株全部丧失了产生子实体的能力,只长有类似于子实体原基的菌丝体(图4C)。
3 讨论
本研究除了1株组织分离的菌株外,其余4个菌株均是单子囊孢子的菌株,保证了初始菌株在遗传上的单一。根据本试验的观察,随着培养代数的增加,蛹虫草的生物学性状发生了明显的改变,包括菌丝生长速率短暂升高之后逐步下降,菌落颜色逐渐变淡并有角突变出现,菌株产孢能力明显减弱,子实体形成能力也逐渐减弱,由子实体产量减少发展为不能形成子实体。当然不同菌株生物学性状发生改变的程度是有差异的,如菌株09-40-4和09-40-5配对相对比5E-10-2和5E-10-7配对所表现的 “退化”程度慢(表2)。因此,在实际生产中应该注重优良菌株的选择和保藏,并尽量减少菌种在人工培养基上的培养代数,以防止或减缓菌种的 “退化”。蛹虫草菌株在培养过程中除了上述生物学性状的变化外,还表现在退化菌株的脱氢酶活性和在色度培养基中的脱色能力都明显比正常菌株减弱[11]。但对于继代培养过程中菌株生物学性状的变化尤其是子实体形成能力 “退化”的机制还有待进一步深入研究。
[1]代君君,范涛,吴传华,等.人工栽培蛹虫草研究的概述[J].安徽农业科学,2007,35(18):5469-5471.
[2]王雅玲,郑双双,吕国忠,等.我国蛹虫草人工栽培培养基的现状调查[J].食用菌,2009 (1):1-2.
[3]韩燕峰,梁建东,杜文,等.蛹虫草几个问题的最新研究进展[J].微生物学通报,2009,36(9):1423-1428.
[4]姜新良,赵占春,杨兴国,等.蚕蛹栽培蛹虫草技术[J].食用菌,2008(2):40-41.
[5]Okoyama E,Yamagishi K,Hara A.Development of a PCR-based mating-type assay for Clavicipitaceae[J].FEMS Microbiol.Lett.,2004,237 (2):205-212.
[6]任士升.人工培育蛹虫草优质高产的技术环节[J].中国食用菌,1997,17(1): 22.
[7]林群英,宋斌,钟月金,等.蛹虫草人工栽培条件优化研究[J].中国食用菌,2006,25(6):17-19.
[8]王生厚,王尊生,宋玉宏.蛹虫草人工栽培技术的改进[J].沈阳农业大学学报,1998,29(2):144.
[9]刘荻,何莉莉,王作乔,等.继代培养对北虫草菌落形态及子实体产量的影响[J].沈阳农业大学学报,2006,37(3):538-541.
[10]梁月,张国珍,安沫平,等.蛹虫草子囊孢子萌发及其后代群体培养性状观察[J].菌物学报,2005,24(4):525-532.
[11]林清泉,丘雪红,郑壮丽,等.蛹虫草退化菌株的特征研究[J].菌物学报,2010,29(5):670-677.
