增生性肾小球肾炎伴晶格状结构的单克隆IgG沉积
2011-08-07曾彩虹朱小东
曾彩虹 朱小东
病例摘要
病史 男性患者,51岁,因“血压升高伴尿检异常1月余,发现血清肌酐(SCr)升高1d“于2011-01-17入院。
患者于2010-11-22日上感,并感视物模糊,无头晕,发现血压升高达190/130 mmHg,服用降压药(具体不详)后多次复测血压160/120 mmHg。同时查尿蛋白3+,隐血2+,血清白蛋白(Alb)34.8 g/L,肝功能正常,SCr 67.4 μmol/L,血红蛋白(Hb)109 g/L,予“雷公藤多苷”(60 mg/d)、依那普利、氨氯地平及呋塞米等药物治疗后,血压控制正常,尿检无改善。2011-01-14至我科门诊查尿蛋白定量3.98 g/24h,尿沉渣红细胞计数 9万/ml(多形型),Alb 39.7 g/L,球蛋白(Glo)25.8 g/L,SCr 118 μmol/L,血脂、空腹血糖均正常,轻度正细胞正色素性贫血(Hb 96 g/L)。病程中有轻度眼睑水肿,夜尿1次/夜,无皮疹、关节痛,精神饮食好,体重无明显变化。
既往史无特殊。
个人史:吸烟史20余年,20支/d。
家族史:母亲因脑溢血去世,父亲瘫痪后去世,家族中否认肾脏病、糖尿病病史。
体格检查 体温37.8℃,脉搏90次/min,呼吸18次/min,血压130/90 mmHg。体质量指数(BMI)25.6 kg/m2。发育正常,营养中等,查体合作,皮肤黏膜无黄染、溃疡,无出血点及紫癜,浅表淋巴结未触及肿大。甲状腺无肿大,气管居中。胸廓无畸形,肋骨无压痛及串珠样改变,心率90次/min,律齐,未闻及病理性杂音。双肺未及干湿啰音。腹软,肝、脾肋下未触及,肝区无叩压痛。四肢关节无畸形,生理反射正常。
实验室检查
血常规 Hb 88 g/L,WBC 4.7×109/L,中性粒53%、淋巴37%,PLT 139×109/L,网织红细胞比例2.5%。
尿液 尿蛋白定量6.29 g/24h,尿沉渣红细胞计数9万/ml(多形型);视黄醇结合蛋白(RBP)5.19 mg/L(正常值≤0.5 mg/L),溶菌酶1.49 mg/L(正常值 < 1.0 mg/L),N-乙酰-β-氨基葡萄糖苷酶(NAG)30.9 U/g·cr(正常值≤16.5 U/g·cr),C3 3.0 mg/L,α2微球蛋白 2.41 mg/L,氨基酸 83.1 mg/L。本周氏蛋白阴性,尿κ游离轻链81.41 mg/L(正常值<11.52 mg/L),尿λ游离轻链53.30 mg/L(正常值 <1.46 mg/L),尿κ/λ=1.52。禁水13h尿渗量 484 mOsm/(kg·H2O)。
血生化及血清学检查 Alb 34.7 g/L,Glo 22.2 g/L,尿 素 氮 (BUN)6.03 mmol/L,SCr 134.3 μmol/L,尿酸 472 μmol/L,胱抑素 C 1.85 mg/L,谷丙转氨酶26 U/L,谷草转氨酶29 U/L,乳酸脱氢酶207 U/L,总胆固醇4.85 mmol/L,三酰甘油 1.85 mmol/L,高密度脂蛋白0.78 mmol/L,低密度脂蛋白3.18 mmol/L,电解质正常,钙2.11 mmol/L,磷1.31 mmol/L。C反应蛋白 0.7 mg/L。空腹血糖4.53 mmol/L,餐后2 h血糖11.69~12.85 mmol/L,糖化血红蛋白 4.9%。ANA、A-dsDNA、抗心磷脂抗体、ANCA 阴性,IgG 12.1 g/L,IgA 0.877 g/L,IgM 0.355 g/L,IgE 55.9 IU/ml,ASO 和类风湿因子阴性。补体C3 0.990 g/L,C4 0.245 g/L。冷球蛋白221.3 mg/L(正常值 <193 mg/L)。乙肝两对半HBcAb、HBsAb、HBeAb阳性,丙肝抗体检查阴性。外周血淋巴细胞亚群 CD4+812个/μL,CD8+401个/μL,CD3+1 257 个/μL,CD20+50 个/μL。甲状腺功能:FT3 3.86 pmol/L,FT4 7.9 pmol/L,TSH 5.49 mIU/L。血免疫固定电泳:见κ型IgG单克隆免疫球蛋白条带。血κ轻链28.65 mg/L(正常值7~23 mg/L),血λ轻链 16.16 mg/L(正常值6~20 mg/L),κ/λ=1.77(正常值 0.7 ~1.6)。间接抗人球蛋白试验阴性。
双肾B超 左肾:106 mm×40 mm×53mm,右肾:104 mm×49 mm×53mm,皮质结构清晰。肾血管超声未见明显异常。
其他 心电图:T波窄尖;胸片、腹部B超、甲状腺B超、胸部CT未见异常;心脏超声:室间隔厚度11 mm,LVEF 61%,左室舒张功能减低,轻度二尖瓣关闭不全。眼底:动静脉比例2∶3,动脉硬化程度1级。颈部血管超声:双侧颈总动脉球部软斑形成,左侧颈部各级动脉阻力指数略偏低;头颅及骨盆平片未见明显异常。
骨髓活检及细胞学检查未见明显异常。
肾活检
光镜 皮质肾组织1条。55个肾小球中23个球性硬化,多位于组织一端。未硬化的正切肾小球体积增大,明显增宽的系膜区中心基质增多,呈PAS阳性,部分系膜区结构不清晰,系膜区周围袢融合(图1A),袢内较多细胞增生及少量炎性细胞浸润,增生的细胞胞质较丰富,袢腔及内皮下大量嗜伊红的物质沉积(图1B)。PASM-Masson:节段肾小球外周袢分层,多处袢内皮下较多团块状、节段系膜区少量、上皮侧散在颗粒状嗜复红物沉积(图1C、D)。肾小管间质慢性病变基础上存在急性病变,灶性肾小管萎缩、基膜增厚,间质灶性纤维化,多处灶性浆细胞及单个核细胞浸润,硬化球周呈聚集性分布。急性病变包括灶性肾小管上皮细胞刷状缘脱落、细颗粒变性,管腔内较多蛋白管型,部分肾小管基膜(TBM)断裂,管型突入间质,周围见炎症细胞浸润。动脉未见明确病变。
免疫荧光和免疫组化 肾小球8个,冰冻切片荧光染色IgG++、C3+,弥漫分布,呈颗粒状沉积于血管袢及部分系膜区(图2A、B)。IgA、IgM、C1q阴性。TBM未见免疫复合物、补体沉积。球门区血管、管周毛细血管、间质血管未见免疫复合物、补体沉积。肾小球纤维蛋白节段毛细血管袢阳性。免疫荧光IgG亚型染色:IgG1++,呈颗粒状沉积于血管袢及少数系膜区(图2C)。IgG2、IgG3、IgG4阴性。冰冻切片荧光染色κ轻链,节段毛细血管袢及系膜区阳性(图2D),λ轻链阴性,κ、λ轻链肾小管上皮细胞胞质阳性。肾组织石蜡切片行CD68染色,肾小球袢内增生的细胞CD68阳性,CD8、CD20、CD138阴性,间质一处硬化球周见CD20+细胞聚集。
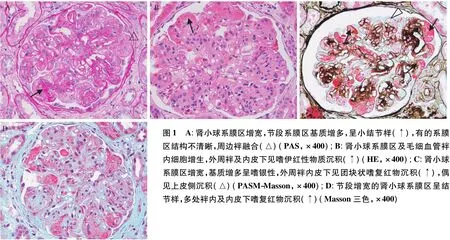
图1 A:肾小球系膜区增宽,节段系膜区基质增多,呈小结节样(↑),有的系膜区结构不清晰,周边袢融合(△)(PAS,×400);B:肾小球系膜区及毛细血管袢内细胞增生,外周袢及内皮下见嗜伊红性物质沉积(↑)(HE,×400);C:肾小球系膜区增宽,基质增多呈嗜银性,外周袢内皮下见团块状嗜复红物沉积(↑),偶见上皮侧沉积(△)(PASM-Masson,×400);D:节段增宽的肾小球系膜区呈结节样,多处袢内及内皮下嗜复红物沉积(↑)(Masson三色,×400)

图2 A:IgG在外周袢及部分系膜区沉积;B:C3在部分外周袢沉积;C:IgG1亚型在肾小球外周袢及系膜区沉积;D:κ轻链在肾小球部分外周袢和系膜区沉积(IF,×400)
电镜 电镜下观察1个肾小球,系膜区增宽,基质增多,毛细血管袢内皮下区域显著增宽,少数袢内皮细胞从肾小球基膜(GBM)剥脱,致袢腔狭小,系膜区及内皮下见大量菱形或长方形、高电子密度的物质,少数类似沉积物见于基膜上皮侧(图3),内见晶格状结构,晶格横切面内径为13~16 nm左右,晶格条纹间的间隔距离为8~10 nm,多数块状沉积物内晶格状条纹呈平行排列,少数块状物内晶格条纹呈束状分布,有的呈横切面,有的呈纵切面,界限清晰。偶见袢腔内细胞胞质内亦见类似晶格状物,被双层膜包绕,有的裸露于胞质中,有的紧贴胞膜位于细胞外,呈内吞样改变(图4)。毛细血管袢腔内尚见单核细胞。肾小球足细胞足突节段性融合增宽。免疫电镜显示IgG和κ轻链金颗粒在肾小球内晶格状物质处阳性(图5)。
小结:本例患者光镜下肾小球呈增生性病变,伴内皮下及系膜区嗜复红物沉积,免疫荧光证实为IgG1亚型,单一κ轻链沉积,超微结构显示GBM内皮下及系膜区,少量上皮侧和细胞胞质内见晶格状物质沉积,结合临床血清免疫固定电泳见κ型IgG单克隆免疫球蛋白条带,骨髓活检未见异常。肾组织沉积的κ型IgG1与血清κ型IgG单克隆免疫球蛋白有关,最终诊断考虑增生性肾小球肾炎伴具有晶格状结构的单克隆IgG沉积。
讨 论
本例患者以高血压起病,肾脏损害主要表现大量蛋白尿,低白蛋白血症,伴少量镜下血尿,肾功能异常。肾外表现有轻度正细胞正色素性贫血,血清免疫固定电泳提示κ型IgG单克隆免疫球蛋白条带,骨髓活检和骨髓细胞学检查均阴性,临床诊断符合意义未明的单克隆γ病(monoclonal gammopathy of undetermined significance,MGUS)。肾活检肾小球内见单一κ型IgG1亚型沉积,因此肾脏损害考虑为单克隆IgG沉积相关的肾脏疾病。而单克隆IgG沉积相关肾脏疾病包括多种类型,需从以下几方面进行鉴别。

图3 A、B:肾小球系膜区增宽,基质增多,内皮下区域增宽,见高密度的块状电子致密物(↑);C:少数袢上皮侧见类似的电子致密物(↑);D:致密物在高倍镜下呈排列有序、中空的晶格状结构,内径为13~16 nm(EM)

图4 A、B:细胞胞质内见中等密度的物质(↑);C:高倍镜下观察晶格样物质被膜包绕,有的膜破裂,直接裸露于胞质中(↑);D:有的紧贴胞膜呈内吞样(↑)(EM)

图5 A、B:肾小球内晶格状物质沉积处可见IgG金颗粒沉积(金颗粒为10 nm);C、D:肾小球内晶格状物质沉积处可见κ轻链金颗粒沉积(金颗粒为10 nm)(EM)
轻链及重链沉积病 本例节段肾小球的系膜区呈结节样病变,肾小球有单一IgG1亚型和单一κ型轻链沉积,应与轻、重链沉积病鉴别。轻链和重链沉积病光镜多表现为结节性病变,免疫荧光见IgG和(或)单一轻链在肾小球和TBM沉积,同时超微结构观察可见GBM内侧缘和TBM外侧颗粒状电子致密物沉积,也常继发于MGUS和骨髓瘤。该患者TBM未见IgG和κ型轻链沉积,电镜下未见GBM内侧缘和TBM外侧缘细颗粒状的电子致密物沉积,而是在GBM内皮下及系膜区见晶格样物质分布,因此不符合轻链和重链沉积病的病理表现。
免疫管状肾小球病和纤维性肾小球肾炎 免疫管状肾小球病(immunotactoid glomerulopathy,ITG)和纤维性肾小球肾炎(fibrillary glomerulonephritis,FGN)也可有肾小球单一IgG亚型伴单一轻链沉积。ITG电镜下观察到的沉积物为中空微管状物,多数直径为30~60 nm,少数小至20 nm,大至90 nm,微管状物呈平行有序排列,有的排列紧密,有的排列松散。微管状物主要在肾小球系膜区沉积,致系膜区增宽,系膜细胞增生,有时沉积于GBM内皮下、基膜内,造成GBM分层,少数见上皮侧沉积,有的微管状物被基膜样物质分隔或包绕。免疫荧光染色显示IgG阳性,常呈颗粒状分布于系膜区及外周袢,IgG在外周袢常呈不连续的线样或颗粒样。半数患者IgM弱阳性,约1/3患者IgA弱阳性。补体C3常阳性,但强度低于IgG。IgG亚型则以IgG1或IgG4阳性多见,轻链以 κ轻链阳性多见[1,2]。本例沉积的物质在电镜低倍镜下为菱形或长方形或多边形,高倍镜下具有晶格状结构,而非独立的中空微管状物,且有的分布于胞质内,因此不支持 ITG的诊断。FGN电镜下肾小球系膜区增宽,见无分枝,无序排列的纤维丝,直径10~30 nm,多数20 nm左右。纤维丝还分布于基膜内、内皮下和上皮侧。沉积物免疫荧光最常见为 IgG,C3,κ和 λ轻链,少数(<10%)为单克隆免疫球蛋白沉积(一般为IgG κ型)。IgG 以 IgG4 和 IgG1 亚型最常见[3,4]。因此本例沉积物的超微结构特点也不支持FGN的诊断。
I型冷球蛋白血症 I型冷球蛋白血症约占冷球蛋白血症的10% ~15%,是单克隆免疫球蛋白,多数情况下为IgM型,少数为IgG型,常见于浆细胞异常增生性疾病如多发性骨髓瘤,华氏巨球蛋白血症。冷球蛋白血症引起的肾脏损伤可表现为膜增生样病变,球内细胞浸润,伴袢腔内冷球蛋白栓塞,超微结构结构观察GBM内皮下、系膜区电子致密物沉积,有时见弯曲的微管状结构或指纹状结构[5-8]。而该患者沉积物的超微结构特点为晶格状,且冷球蛋白水平仅略高于正常,也不符合I型冷球蛋白血症的诊断。
增生性肾小球肾炎伴单克隆IgG免疫球蛋白沉积 2004年Nasr报道10例增生性肾小球肾炎伴单克隆 IgG免疫球蛋白沉积(proliferative glomerulonephritis with monoclonalIgG deposits,PGNMID),光镜下以增生性病变为突出表现,免疫荧光只有单一亚型IgG和单一轻链沉积,电镜下为颗粒状电子致密物沉积于系膜区和(或)内皮下,类似于一般的免疫复合物性肾炎[9,10]。本例光镜和荧光染色特点与PGNMID类似,肾小球内沉积的物质也是单一的IgG1亚型和单一κ轻链,但沉积物的超微结构不是颗粒状电子致密物,而是具晶格状结构。所以不完全等同于PGNMID。
分析该患者的特点,光镜为肾小球增生性病变,除系膜细胞、内皮细胞增生外,袢内浸润的细胞主要为CD68+细胞,同时见大量GBM内皮下、少量系膜区、偶见上皮侧嗜复红物沉积,沉积物只有IgG1和κ轻链阳性,电镜观察到的沉积物具有晶格状结构。免疫电镜证实这些晶格状的物质IgG和κ轻链阳性,与PGNMID不同之处在于沉积物的超微结构为晶格状,因此本例诊断考虑增生性肾小球肾炎伴具有晶格状结构的单克隆 IgG沉积,以区别于PGNMID。
在肾活检标本中可观察到晶格状超微结构的物质还可见于轻链肾小管病(immunoglobulin light chain proximal tubulopathy)。结晶状物质主要位于近端肾小管上皮细胞胞质内,低倍镜下外观呈针状、圆形、矩形或棒状的电子密度较高的物质,在高倍镜下部分见周期性的平行线样排列的晶格状结构(lattice-like structure)或条纹状结构,条纹间隔为80Å,包涵体被一单层膜包绕。免疫胶体金技术证实包涵体轻链阳性。而轻链肾小管病也可继发于意义未明的单克隆γ病或早期骨髓瘤[11-14]。本例患者的晶格状物质主要沉积于内皮下区域,少量见于袢内细胞胞质内,临床也存在MGUS,提示单克隆IgG在肾小球内皮下区域局部沉积,形成晶格状结构,沉积的结晶状物质可刺激局部细胞增生。综合文献,这是首次报道在肾小球内晶格状结构物质沉积的病例。
从以上分析看,单克隆免疫球蛋白肾脏沉积性疾病有多种表现形式,包括免疫管状病、纤维性肾小球肾炎,轻链和(或)重链沉积病,I型冷球蛋白血症,增生性肾小球肾炎伴单克隆IgG免疫球蛋白沉积,还有文献报道单克隆IgG沉积性疾病表现系膜增生性病变、膜性病变等[15]。以上疾病多数继发于异常副球蛋白血症及骨髓瘤,有的则在随访过程中出现骨髓瘤。虽然这些疾病的光镜和超微结构有不同之处,但共同点是免疫荧光染色为单克隆性的IgG沉积。同为单克隆免疫球蛋白在肾脏沉积,却可造成不同的光镜、超微结构改变和临床表现,造成这种差异及现象的具体机制目前并未阐述清楚。
单克隆免疫球蛋白肾脏沉积性疾病光镜和超微结构表现多样,确诊主要依赖免疫荧光检查,肾组织仅有单一免疫球蛋白沉积,多数为IgG,可伴有C3和(或)C1q沉积。对于这类患者,需进一步进行IgG亚型和轻链的染色,如果只有单一IgG亚型和单一轻链亚型沉积,则单克隆免疫球蛋白IgG肾脏沉积性疾病诊断成立,那么光镜和超微结构特点则有助于鉴别(图6),必要时免疫电镜对进一步明确诊断有帮助。因此IgG亚型和轻链的染色对诊断及鉴别诊断具有非常重要的作用,应加以重视。
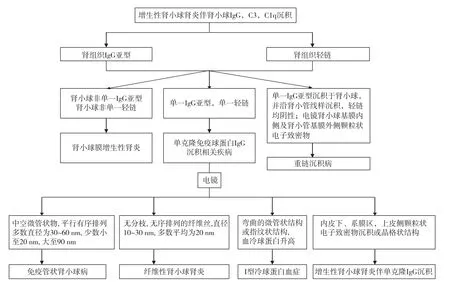
图6 增生性肾小球肾炎伴IgG沉积的鉴别诊断流程
单克隆免疫球蛋白肾脏沉积性疾病一旦确诊,寻找系统性原因很重要,如骨髓活检、血清免疫固定电泳,血清免疫球蛋白水平,血、尿轻链等检查,多数患者继发于MGUS或骨髓瘤,也有患者诊断时无明确继发原因,在随访中出现MGUS或骨髓瘤。因此诊断后的随访非常必要。
1 Alpers CE,Kowalewska J.Fibrillary glomerulonephritis and immunotactoid glomerulopathy.J Am Soc Nephrol,2008,19(1):34-37.
2 Schwartz MM,Korbet SM,Lewis EJ.Immunotactoid glomerulopathy.J Am Soc Nephrol,2002,13(5):1390-1397.
3 Ivanyi B,Degrell P.Fibrillary glomerulonephritis and immunotactoid glomerulopathy.Nephrol Dial Transplant,2004,19(9):2166-2170.
4 Bridoux F,Hugue V,Coldefy O,et al.Fibrillary glomerulonephritis and immunotactoid(microtubular)glomerulopathy are associated with distinct immunologic features.Kidney Int,2002,62:1764-1775.
5 Dammacco F,Sansonno D,Piccoli C,et al.The cryoglobulins:an overview.Eur J Clin Invest,2001,31(7):628-638.
6 Beddhu S,Bastacky S,Johnson JP.The clinical and morphologic spectrum of renal cryoglobulinemia.Medicine(Baltimore),2002,81(5):398-409.
7 Tedeschi A,Barate C,Minola E,et al.Cryoglobulinemia.Blood Rev,2007,21(4):183-200.
8 Alpers CE,Smith KD.Cryoglobulinemia and renal disease.Curr Opin Nephrol Hypertens,2008,17(3):243-249.
9 Nasr SH,Markowitz GS,Stokes MB,et al.Proliferative glomerulonephritis with monoclonal IgG deposits:a distinct entity mimicking immune-complex glomerulonephritis.Kidney Int,2004,65(1):85-96.
10 Nasr SH,Satoskar A,Markowitz GS,et al.Proliferative glomerulonephritis with monoclonal IgG deposits.J Am Soc Nephrol,2009,20(9):2055-2064.
11 Cai G,Sidhu GS,Wieczorek R,et al.Plasma cell dyscrasia with kappa light-chain crystals in proximaltubular cells:a histological,immunofluorescent,and ultrastructural study.Ultrastruct Pathol,2006,30(4):315-319.
12 Kapur U,Barton K,Fresco R,et al.Expanding the pathologic spectrum of immunoglobulin light chain proximal tubulopathy.Arch Pathol Lab Med,2007,131(9):1368-1372.
13 Herlitz LC,RoglieriJ,Resta R,etal.Lightchain proximal tubulopathy.Kidney Int,2009,76(7):792-797.
14 Elliott MR,Cortese C,Moreno-Aspitia A,Dwyer JP.Plasma cell dyscrasia causing light chain tubulopathy without Fanconi syndrome.Am J Kidney Dis,2010,55(6):1136-1141.
15 Komatsuda A,Masai R,Ohtani H,et al.Monoclonal immunoglobulin deposition disease associated with membranous features.Nephrol Dial Transplant,2008,23(12):3888-3894.
