IgA肾病患者AGT M235T基因多态性分析
2011-08-07黄海东李新娟王立瑞蒋更如
黄海东,李新娟,王立瑞,蒋更如,朱 淳
(上海交通大学医学院附属新华医院肾脏内科,上海,200092)
IgA肾病(IgAN)是临床最为常见的原发性肾小球疾病[1],病理上表现为免疫球蛋白A(IgA)为主的免疫球蛋白在肾小球系膜区的沉积,但其临床表现多样,预后相差悬殊,高血压、大量蛋白尿、较重的病理损害是影响其预后的危险因子[2]。近年来,越来越多的研究表明遗传因素在IgAN的发病机制中起重要作用。肾素-血管紧张素-醛固酮系统(RAAS)可以调节机体的水、钠平衡,在血压调控、肾损伤及慢性肾功能不全进展中起重要作用。研究发现IgAN患者血管紧张素Ⅱ活性升高,应用血管紧张素转化酶抑制剂(ACEI)和血管紧张素受体抑制剂(ARB)治疗可以减少蛋白尿,延缓肾功能进展,证实RAAS系统在IgAN中的作用。血管紧张素原(AGT)是RAAS的重要组成部分,AGT基因M235T的多态性影响RAAS的活性。本研究旨在对本院I-gAN患者的AGT M235T基因多态性进行分析,以探讨该多态性与IgAN患者的临床表现和病理特点的关系。
1 资料与方法
1.1 一般资料
选取2009年1月~2011年3月上海市新华医院肾脏内科IgAN患者共105例。所有患者经肾穿刺病理活检证实。排除过敏性紫癜性肾炎、系统性红斑狼疮、慢性肝病等继发性肾脏IgA沉积患者。其中男 45例,女60例,年龄14~73岁,平均(43.2±12.9)岁。另选择120例正常体检者作为对照组。
1.2 方法
基因型检测:抽取空腹静脉血5 mL,提取外周血基因组DNA。采用聚合链式反应-限制性片段长度多态性技术(PCR-RFLP)检测AGT M235T基因多态性[4]。引物序列:引物1:5′-CCG TTT GTG CAG GGC CTG GCT TCT T-3′;引物 2:5′-CAG GGT GCT GTC CAC ACT GGA CCC C-3′。对 IgAN 患者的年龄 、性别 、血压、血清肌酐、24 h尿蛋白定量、初始的估算肾小球滤过率(eGFR)[3]、肾穿刺活检的病理进行观察和检测。计算出IgAN患者AGT各基因亚型的频率,经Hardy-Weinberg遗传平衡定律检验。
2 结 果
2.1 AGT M235T基因型分析
AGT基因第2外显子编码产物第235号氨基酸由蛋氨酸(M)变异为苏氨酸(T),即核苷酸704处碱基T被C代替,丢失了TthⅢ限制性酶切位点:GACNNNGTC,故酶切产物电泳后可出现3种情况:T T纯合型(有酶切位点):141 bp,24 bp;MM纯合型(无酶切位点):165 bp;MT杂合型:165 bp,141 bp,24 bp。见图1。
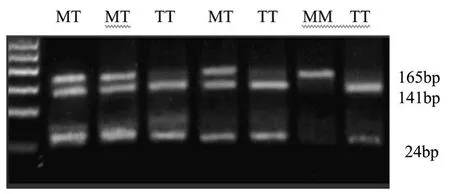
图1 ACT M235T基因型
2.2 IgAN患者和正常对照AGT M235T基因频率的比较
本院的105例IgAN患者中,MM基因型、MT基因型、TT基因型的患者分别占2.9%、20.0%、77.1%,120例健康体检者中,MM基因型、MT基因型、TT基因型的人数分别占0.8%、31.7%、67.5%,2组人群的基因型分布无统计学差异(P>0.05)。见表1。
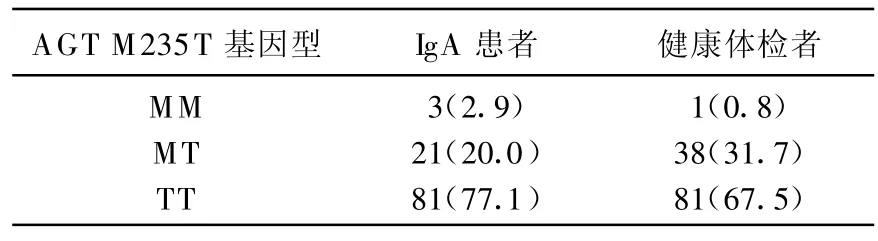
表1 IgA肾病患者和正常对照组AGT M235T基因频率的比较[n(%)]
2.3 AGT M235T多态性与IgAN临床特征的比较
IgAN患者的发病年龄、性别、平均动脉压、24 h尿蛋白定量、血清肌酐值、初始的eGFR值在AGT M 235T基因型之间无统计学差异(P>0.05)。见表2。
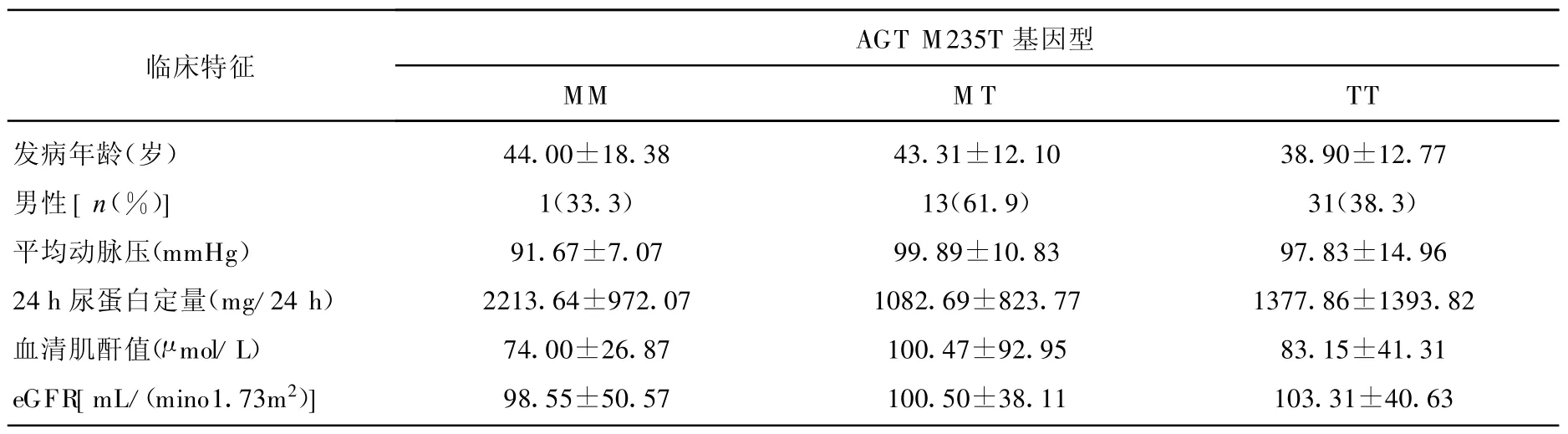
表2 AGT M235T基因多态性与IgAN患者主要临床特征的关系( x±s)
2.4 AGT M235T多态性与IgAN病理特征的比较
在AGT M235T 基因MM 、MT、TT 3种基因亚型的患者中,有肾小球硬化的患者所占的比例之间无统计学差异(P>0.05)。有球性硬化或节段性硬化的患者所占的比例在3种基因亚型间也无统计学差异。在3种基因亚型的患者间,肾小球硬化程度(球性硬化+节段性硬化比例)无统计学差异。有肾间质纤维化、肾小管萎缩、肾血管病变的患者在3种基因亚型间的分布同样无统计学差异(P>0.05)。见表3。
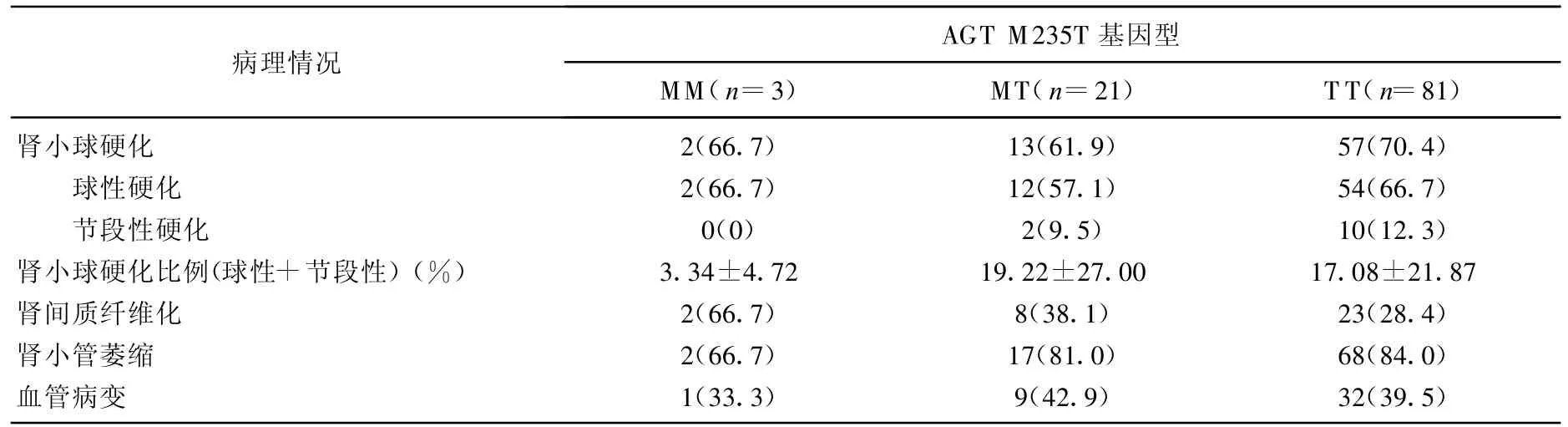
表3 AGT M235T基因多态性与IgAN患者病理情况的关系[n(%)]
3 讨 论
IgA肾病的发病率有明显的地区和种族差异,亚洲是IgA肾病的高发地区。在我国、日本和新加坡,IgA肾病占肾活检诊断原发性肾小球肾炎的30%~50%,在印度其发病率仅为4%~7%,泰国为9.2%[5]。黄种人是IgA肾病的高发人群,而黑人极少见IgA肾病,同时IgA肾病还有家族聚集现象,这些提示该病可能与遗传因素密切相关。鉴于IgA肾病发病的地区和种族差异,本文就上海人群的IgA肾病患者做一研究。
IgA肾病的发病机制目前尚未完全清楚,然而越来越多的研究证据表明,遗传因素对IgA肾病的发病起着重要的作用,其机制可能是一种多基因、多因素参与的复杂的遗传性疾病。研究与IgA肾病发生、发展有关的基因变异是当前的一个热点,其中RAAS的基因变异也与IgA肾病密切相关。RAAS在肾脏疾病的发生、发展中发挥了重要影响[6]。AGT是RAAS的重要组成部分。AGT是RAAS中唯一的限速反应初始底物,血浆中AGT水平的高低直接影响RAS的强弱。AGT基因M235T多态性影响RAAS的活性,有报道TT型人群血浆ACT水平明显高于MM型[7]。近年来虽然研究结论并不一致,但大多数研究不支持AGT M235T基因多态性与IgA肾病的发生有关[4,8-9],即AGT基因并非IgA肾病的易感基因。本研究通过比较105例IgA肾病患者与120例正常人群的AGT M235T各基因亚型的分布频率,发现其差异并无统计学意义,与以往研究结果一致,再次验证了AGT M235T的基因多态性与IgA肾病的发病无关。
研究表明,大量蛋白尿、发病时已有血肌酐升高、持续性高血压、发病时年龄较大及肾脏病理损害严重均是IgA肾病患者预后不良的重要指标[10]。但在本研究中,性别、发病年龄、血压、蛋白尿、发病时学肌酐、GFR等临床指标,AGT各基因型均无明显差异,提示AGT基因型在IgA肾病发展中可能不起主要作用。肾小球硬化、肾间质纤维化、肾小管萎缩和肾血管病变是IgA患者预后不良的重要病理指标,但本研究发现AGT各基因型的病理表现并无差别,再次验证AGT基因型在IgA肾病法中不起主要作用。提示IgA肾病是一个受多基因、多因素影响的疾病,发病过程涉及多个环节,需要进一步研究不同多态位点的交互作用,才能揭示遗传多态性在IgA肾病发生发展中的作用。
综上所述,IgA肾病是一个多基因、多因素影响的疾病,本研究需要进一步加大样本量,并随访患者的病情进展,才能正确判断AGT基因多态性和IgA肾病的关系。
[1] GONG R,LIU Z,CHEN Z,et al.Genetic variation of mannose-binding protein associated with glomerular immune deposition in IgA nephropathy[J].Chinese Medical Journal,2002,115(2):192.
[2] 陈香美,陈以平,李 平,等.1016例IgA肾病患者中医证候的多中心流行病学调查及相关因素分析[J].中国中西医结合杂志,2006,26(3):197.
[3] M a YC,Li Z,Chen JH,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937.
[4] 张 怡,初少莉,高平进,等.肾素血管紧张素系统基因多态性与低肾素性高血压的相关性研究[J].中国分子心脏病学杂志,2010,10(4):229.
[5] 钱雅新,赵燕俐,彭 文,等.柴芩肾安方对IgA肾病大鼠肾小球TGF-β1和CTGF表达的影响[J].实用临床医药杂志,2008,12(3):78.
[6] 章晓燕,吕文律,滕 杰,等.慢性肾脏病患者尿血管紧张素原与肾脏肾素血管紧张素系统活性的相关性[J].中华肾脏病杂志,2011,27(5):327.
[7] 孙洪英,和姬苓,杨玉蓉,等.肾素基因G10631A和血管紧张素原基因T704C多态性与脑梗死的关系[J].国际脑血管病杂志,2011,19(6):442.
[8] 孟 群,沈 颖,江载芳,等.原发性肾病综合征患儿血管紧张素原和血管紧张素转换酶基因多态性的检测与临床分析[J].中国实用儿科杂志,2007,22(6):420.
[9] 于克洲,孙 晶,王 荣,等.8例伴恶性高血压的IgA肾病临床与病理分析[J].山东大学学报(医学版),2007,45(8):864.
[10] HUANG Hai-dong,LIN Fu-jun,et al.Genetic polymorphisms of the renin-angiotensin-aldosterone system in Chinese patients with end-stage renal disease secondary to IgA nephropathy[J].Chinese Medical Journal,2010,123(22):3238.
